
- •Основы молекулярной физики и термодинамика
- ••Молекулярная физика – раздел физики, в котором изучаются физические и физико- химические свойства
- •Броуновское движение
- ••Разделами молекулярной физики являются:
- ••Термодинамика – это наука о тепловых явлениях.
- ••Общим для всех разделов молекулярной физики является теоретический подход, основанный на применении феноменологического
- ••Атомы и молекулы, взаимодействуют друг с другом, образуют разнообразные вещества (системы).
- ••Для описания состояния макросистемы вводят параметры, которые называются параметрами состояния.
- ••Объем газа V — это объем сосуда, в котором газ находится. В СИ
- ••Температура — скалярная физическая величина вводится для количественной характеристики внутренней энергии тела. Опыт
- •Идеальный газ
- •Идеальный газ
- •Идеальный газ
- •Состояние системы
- •Состояние системы
- •Состояние системы
- •Состояние системы
- •Состояние системы
- •Изопроцессы
- •Изопроцессы
- •Закон Шарля
- •Изопроцессы
- •Изобарный процесс
- •Закон Гей-Люссака
- •Закон Авогадро
- •Закон Дальтона
- •Уравнение Клапейрона - Менделеева
- •Уравнение Клапейрона - Менделеева
- •Уравнение Клапейрона - Менделеева
- •Давление идеального газа
- •Основное уравнение молекулярно- кинетической теории идеальных газов
- •• Если газ в объеме V содержит N молекул, движущихся со скоростями ,
- ••Средняя кинетическая энергия поступательного движения одной молекулы идеального газа из уравнений (2) и
- •Закон Максвелла для распределения молекул идеального газа по скоростям
- ••Закон Максвелла описывается некоторой функцией f(v), называемой функцией распределения молекул по скоростям.
- ••Применяя методы теории вероятностей, Максвелл нашел функцию f(v) – закон распределения молекул идеального
- ••В показателе степени стоит отношение
- •Распределение Максвелла имеет вид
- ••Из графика видно, что при «малых» υ, т.е. при
- •• Величину скорости, на которую приходится
- ••Для одного моля газа:
- ••Все три скорости незначительно отличаются друг от друга множителем порядка единицы, причем
- •На рисунке показана зависимость f(υ) при различных температурах и массах молекул газа
- ••Закон Максвелла для распределения молекул идеального газа по скоростям и все вытекающие следствия
- •Распределение Больцмана
- •Распределение Больцмана
- ••Если высота сосуда много меньше чем kT/mg, то зависимостью концентрации от высоты можно
- •Распределение Больцмана
- •Опытное обоснование молекулярно- кинетической теории
- •Броуновское движение
- •Броуновское движение
- •Броуновское движение
- •Броуновское движение
- •Первое экспериментальное определение скорости молекул. Опыты Штерна.
- •Опыт Штерна
- •Опыт Штерна
- •Опыт Штерна
- •Опыт Штерна
- ••Легко связать это смещение S со скоростью молекул v. Молекулы достигают стенки за
- ••По формуле рассчитывали скорость.

•В показателе степени стоит отношение
•т.е. кинетической энергии, соответствующей данной скорости υ к (kТ) – средней энергии
теплового движения молекул при данной температуре, значит распределение
Максвелла характеризует распределение молекул по значениям кинетической
энергии (то есть показывает, какова
вероятность при данной температуре иметь
именно такое значение кинетической энергии).
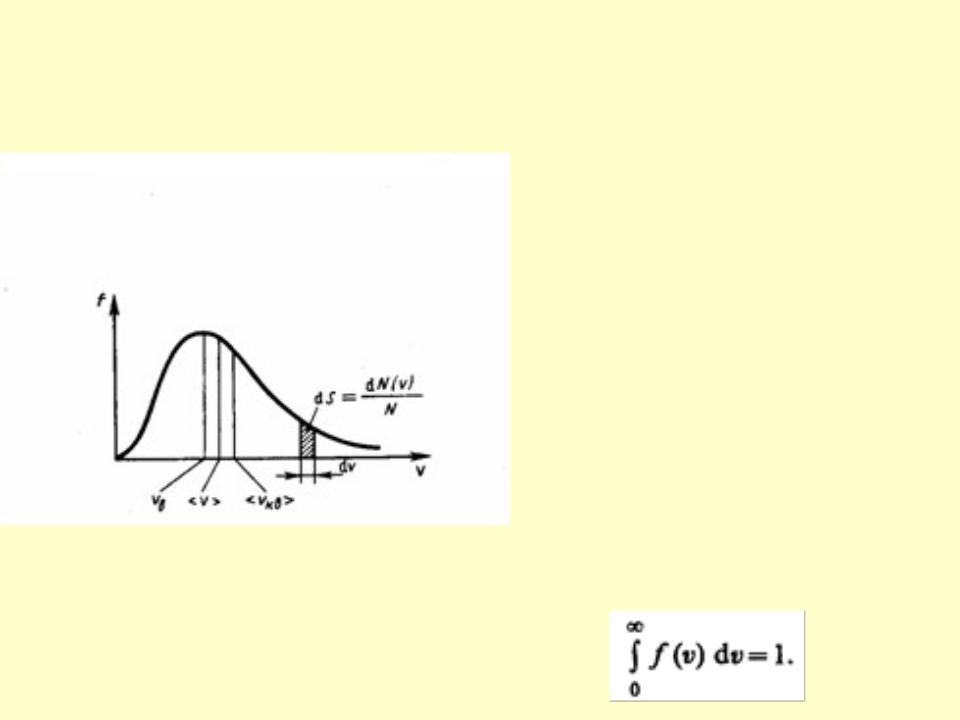
Распределение Максвелла имеет вид
• Относительное число молекул dN(v)/N,
скорости которых лежат в интервале от v до v+dv, находится как площадь заштрихованной полоски на рис.
• Площадь, ограниченная кривой распределения и осью абсцисс, равна единице. Это означает, что функция f(v) удовлетворяет условию нормировки
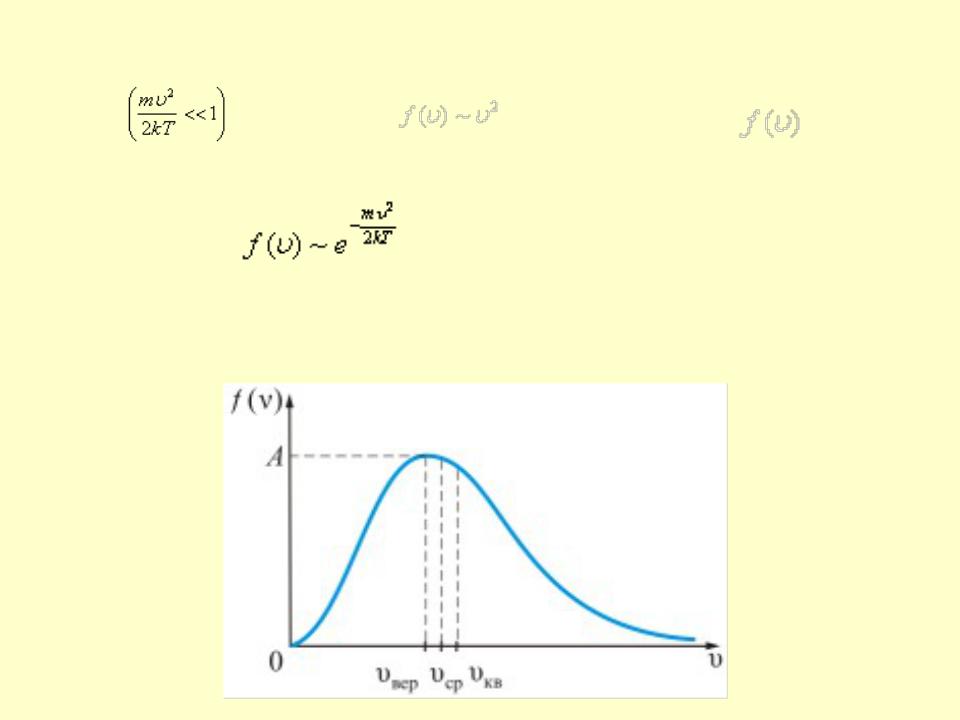
•Из графика видно, что при «малых» υ, т.е. при
имеем |
; |
затем |
достигает максимума А и далее экспоненциально спадает
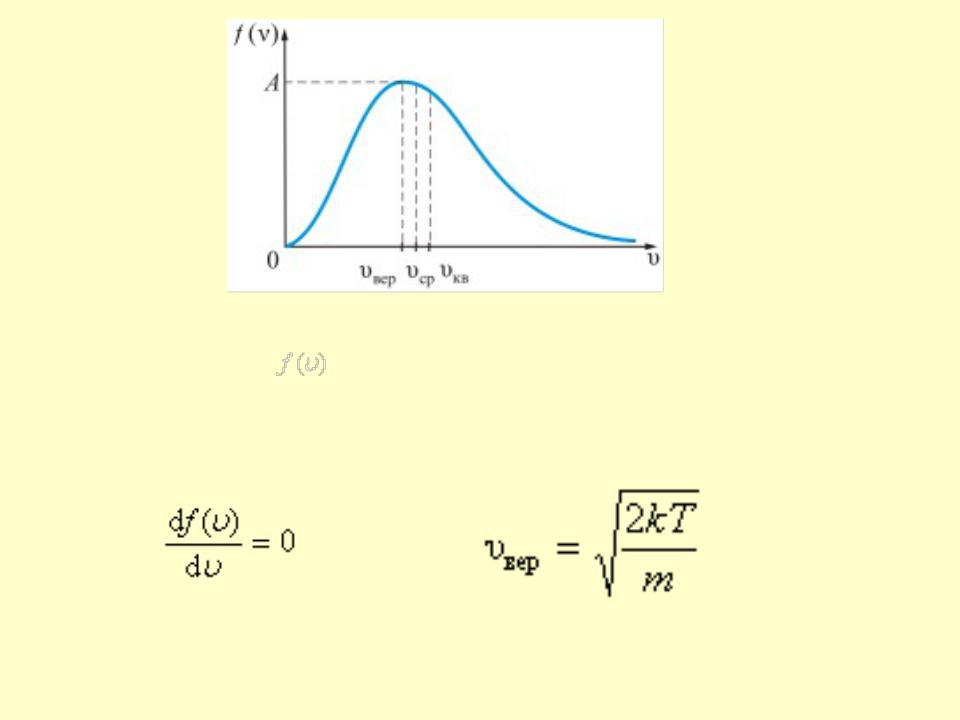
• Величину скорости, на которую приходится
максимум зависимости |
, называют наиболее |
вероятной скоростью. |
|
•Найдем эту скорость из условия равенства производной
-наиболее вероятная скорость одной молекулы

•Для одного моля газа:
•где µ - молярная масса, m – масса молекулы
•Среднюю квадратичную скорость найдем, используя
•соотношение
• |
- для одной молекулы, |
•
• |
- для одного моля газа |
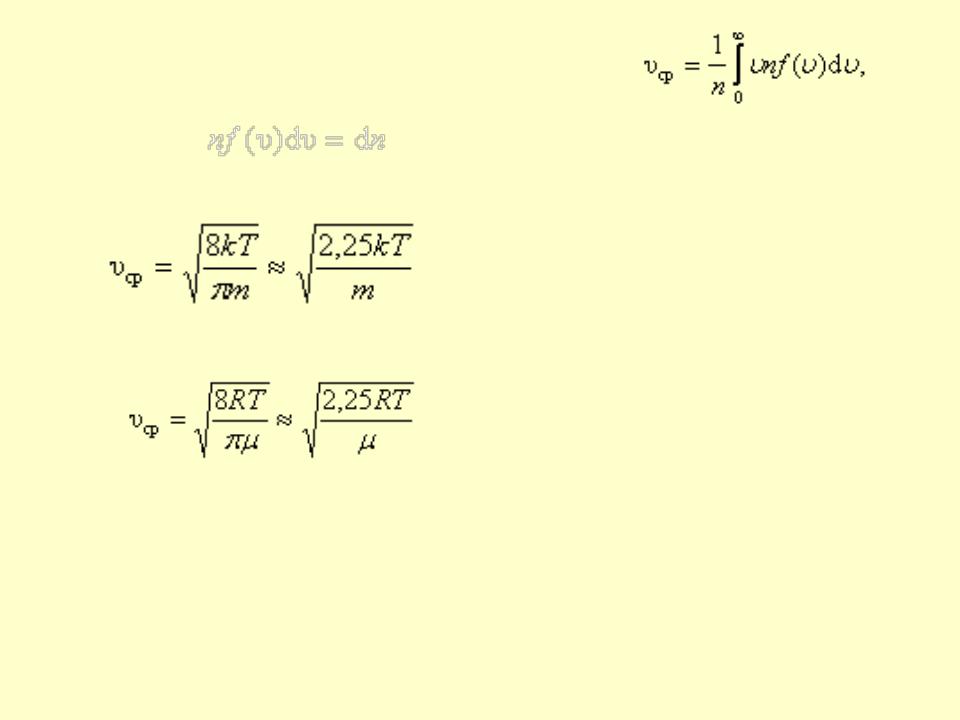
• |
Средняя арифметическая скорость: |
|
• |
где |
число молекул со |
|
скоростью от υ до υ+dυ. Если подставить сюда |
|
|
f(υ) и вычислить, то получим: |
|
• |
молекулы, |
- для одной |
|
|
|
• |
- для одного |
|
моля газа |
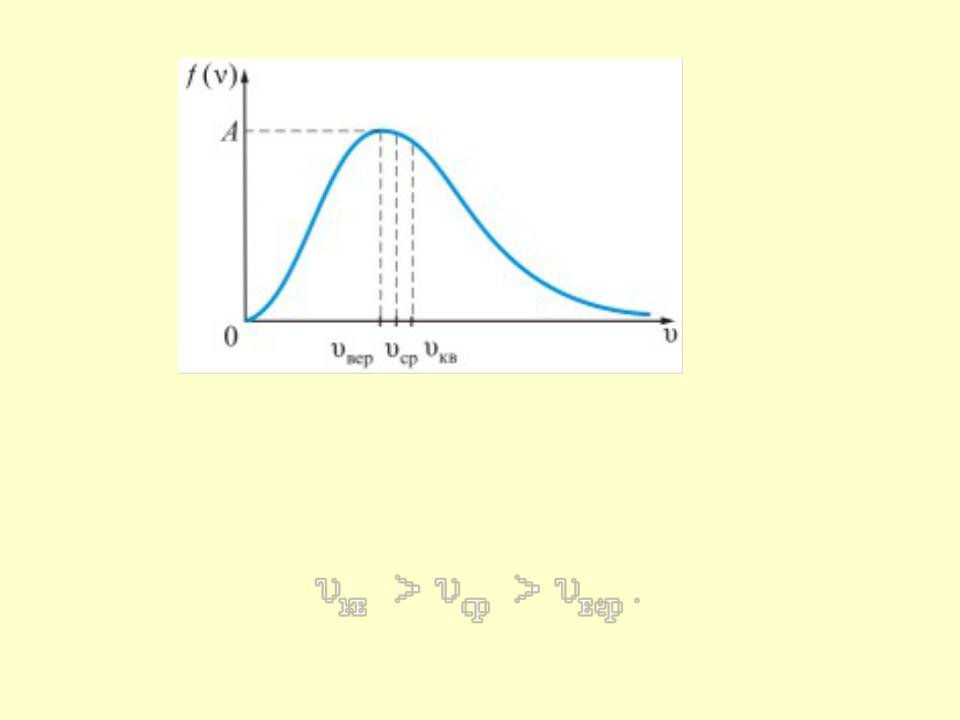
•Все три скорости незначительно отличаются друг от друга множителем порядка единицы, причем
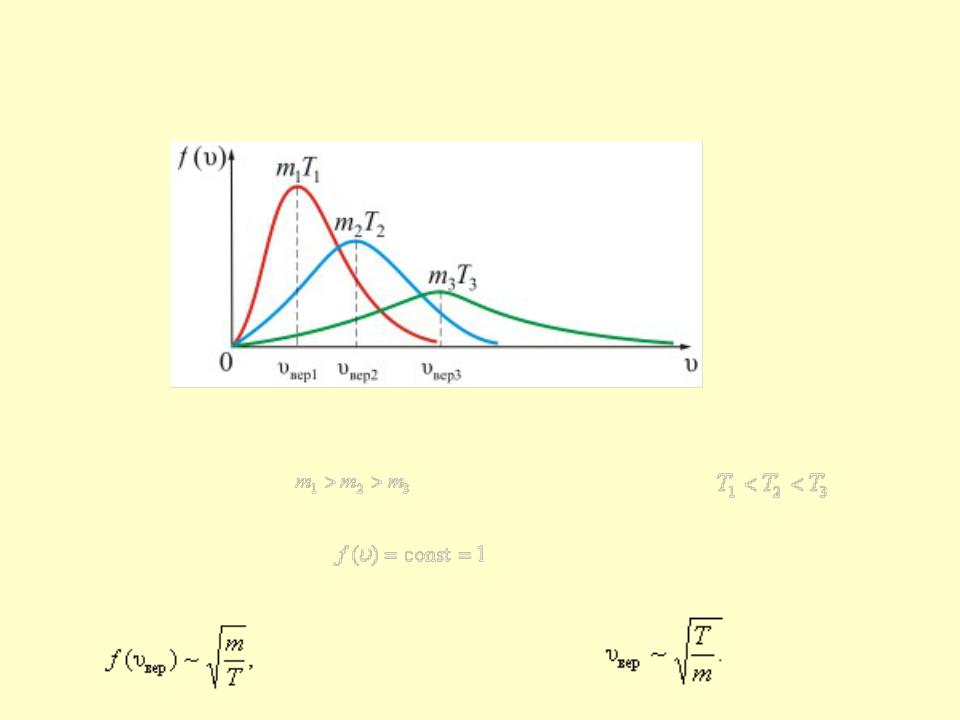
На рисунке показана зависимость f(υ) при различных температурах и массах молекул газа
• |
Проследим за изменением f(υ) при изменении m |
||
|
и T. В данном случае |
(при T = const ) |
|
|
или |
(при m = const). Площадь под |
|
|
кривой величина постоянная, равная единице ( |
||
|
|
), поэтому важно знать как будет |
|
|
изменяться положение максимума кривой: |
||
• |
|
|
кроме того |

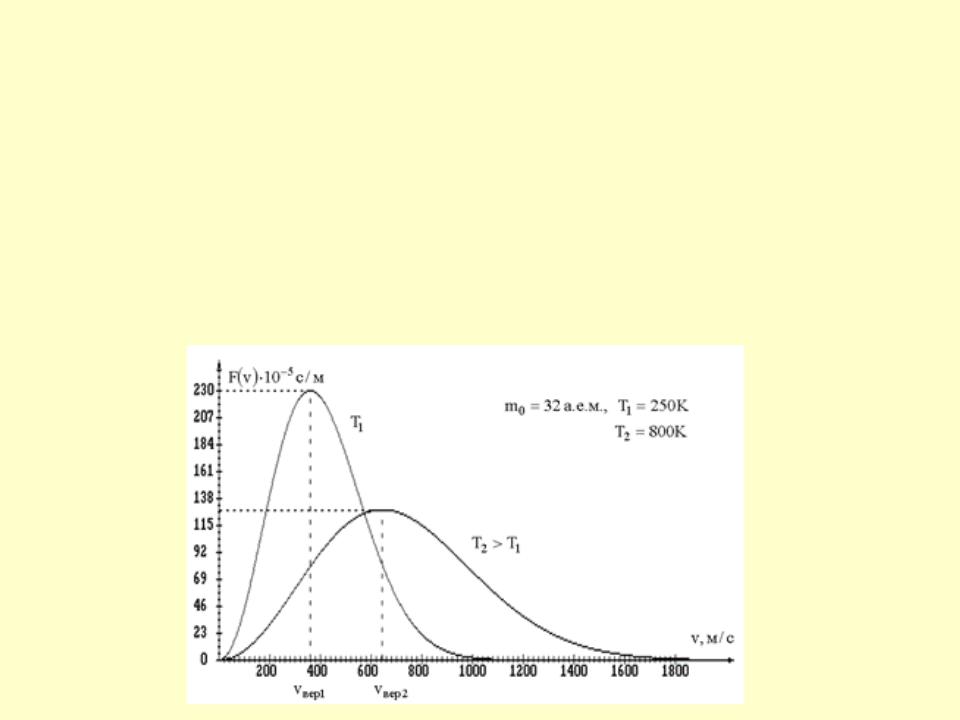
•Закон Максвелла для распределения молекул идеального газа по скоростям и все вытекающие следствия справедливы только для газа в равновесной системе.
•Закон статистический, и выполняется тем лучше, чем больше число молекул.
