
- •Основы молекулярной физики и термодинамика
- ••Молекулярная физика – раздел физики, в котором изучаются физические и физико- химические свойства
- •Броуновское движение
- ••Разделами молекулярной физики являются:
- ••Термодинамика – это наука о тепловых явлениях.
- ••Общим для всех разделов молекулярной физики является теоретический подход, основанный на применении феноменологического
- ••Атомы и молекулы, взаимодействуют друг с другом, образуют разнообразные вещества (системы).
- ••Для описания состояния макросистемы вводят параметры, которые называются параметрами состояния.
- ••Объем газа V — это объем сосуда, в котором газ находится. В СИ
- ••Температура — скалярная физическая величина вводится для количественной характеристики внутренней энергии тела. Опыт
- •Идеальный газ
- •Идеальный газ
- •Идеальный газ
- •Состояние системы
- •Состояние системы
- •Состояние системы
- •Состояние системы
- •Состояние системы
- •Изопроцессы
- •Изопроцессы
- •Закон Шарля
- •Изопроцессы
- •Изобарный процесс
- •Закон Гей-Люссака
- •Закон Авогадро
- •Закон Дальтона
- •Уравнение Клапейрона - Менделеева
- •Уравнение Клапейрона - Менделеева
- •Уравнение Клапейрона - Менделеева
- •Давление идеального газа
- •Основное уравнение молекулярно- кинетической теории идеальных газов
- •• Если газ в объеме V содержит N молекул, движущихся со скоростями ,
- ••Средняя кинетическая энергия поступательного движения одной молекулы идеального газа из уравнений (2) и
- •Закон Максвелла для распределения молекул идеального газа по скоростям
- ••Закон Максвелла описывается некоторой функцией f(v), называемой функцией распределения молекул по скоростям.
- ••Применяя методы теории вероятностей, Максвелл нашел функцию f(v) – закон распределения молекул идеального
- ••В показателе степени стоит отношение
- •Распределение Максвелла имеет вид
- ••Из графика видно, что при «малых» υ, т.е. при
- •• Величину скорости, на которую приходится
- ••Для одного моля газа:
- ••Все три скорости незначительно отличаются друг от друга множителем порядка единицы, причем
- •На рисунке показана зависимость f(υ) при различных температурах и массах молекул газа
- ••Закон Максвелла для распределения молекул идеального газа по скоростям и все вытекающие следствия
- •Распределение Больцмана
- •Распределение Больцмана
- ••Если высота сосуда много меньше чем kT/mg, то зависимостью концентрации от высоты можно
- •Распределение Больцмана
- •Опытное обоснование молекулярно- кинетической теории
- •Броуновское движение
- •Броуновское движение
- •Броуновское движение
- •Броуновское движение
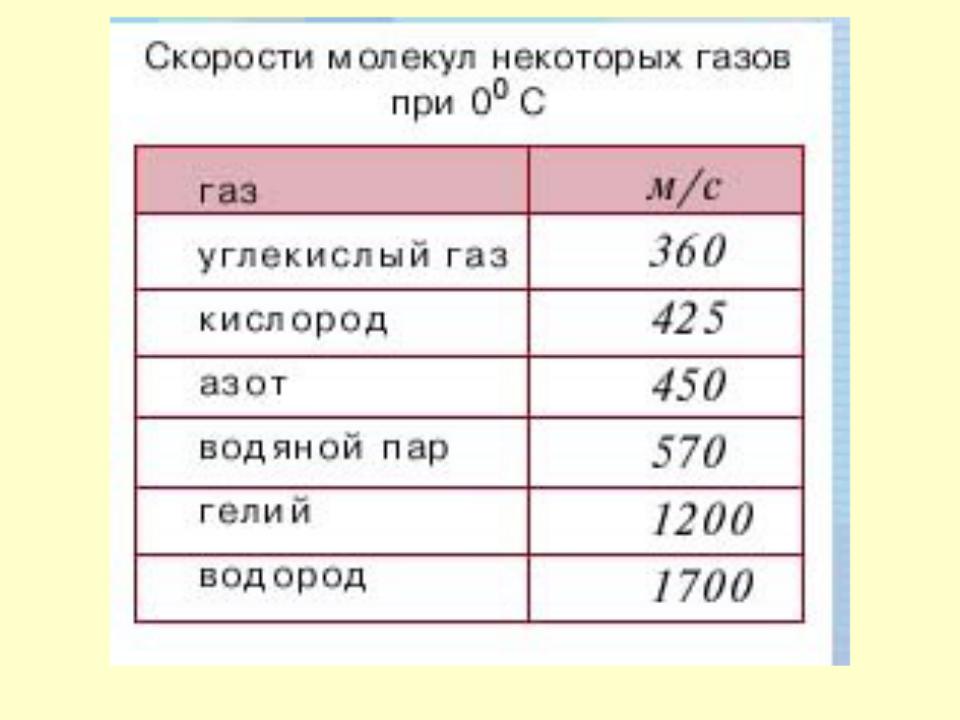
- •Первое экспериментальное определение скорости молекул. Опыты Штерна.
- •Опыт Штерна
- •Опыт Штерна
- •Опыт Штерна
- •Опыт Штерна
- ••Легко связать это смещение S со скоростью молекул v. Молекулы достигают стенки за
- ••По формуле рассчитывали скорость.

Давление идеального газа
•Запишем уравнение состояния идеального газа с использованием постоянной Больцмана:
• k = R/ = 1,38 Дж/К
•Р = RT/ = k T/ = n k T,
•где n = / - концентрация молекул (число молекул в единице объема).
•Р = n k T - давление идеального газа при
данной температуре прямо пропорционально концентрации его молекул (или плотности газа).

Основное уравнение молекулярно- кинетической теории идеальных газов
• Давлениесосуда газа, оказываемое им на стенку
• |
Р = 1/3 n |
где n – концентрация молекул - масса молекулы
V – скорость молекулы
1/3 – замена хаотического движения молекул движением вдоль трех взаимно перпендикулярных направлений

• Если газ в объеме V содержит N молекул, движущихся со скоростями , , …, ,
• то средняя квадратичная скорость
P = 1/3 n ˂
•- основное уравнение молекулярно- кинетической теории идеальных газов

• Так как концентрация молекул n = N/V
(1)
или
(2)
Где Е – суммарная кинетическая энергия поступательного движения всех молекул газа.
Так как масса газа m = N ,
то уравнение (1) запишем в виде
Для 1 моля газа m = M (М – молярная масса газа)
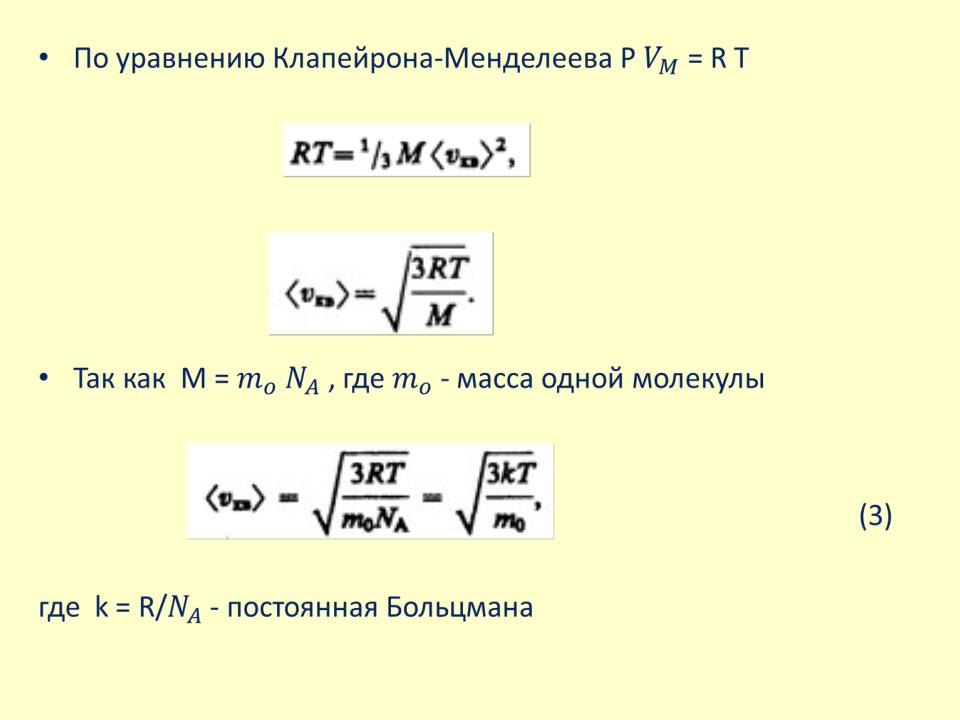
•По уравнению Клапейрона-Менделеева P = R T
•Так как M = , где - масса одной молекулы
(3)
где k = R/ - постоянная Больцмана

•Средняя кинетическая энергия поступательного движения одной молекулы идеального газа из уравнений (2) и (3)
(4)
•При Т = 0 ˂˃ = 0 , т.е. поступательное движение молекул прекращается, а, следовательно, его давление равно нулю.
•Таким образом, термодинамическая температура является мерой кинетической энергии поступательного движения молекул идеального газа,
•а формула (4) – молекулярно-кинетический смысл температуры.

Закон Максвелла для распределения молекул идеального газа по скоростям
•Из-за хаотического движения молекул все направления движения являются равновероятными, т. е. в любом направлении в среднем движется
одинаковое число молекул.
•Средняя квадратичная скорость молекул массой т0 в газе, находящемся в состоянии равновесия при Т= const. остается постоянной и равной
•В газе, находящемся в состоянии равновесия, устанавливается некоторое стационарное, не меняющееся со временем распределение молекул по скоростям, которое подчиняется вполне определенному статистическому закону. Этот закон теоретически выведен Дж. Максвеллом (1831-1849).
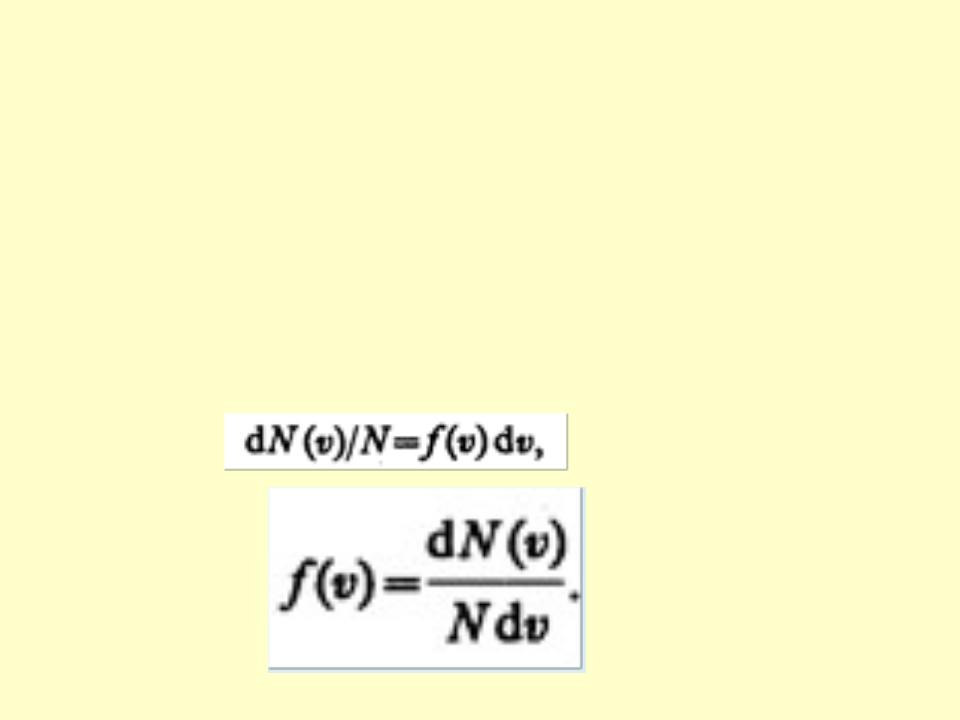
•Закон Максвелла описывается некоторой функцией f(v), называемой функцией распределения молекул по скоростям.
•Если разбить диапазон скоростей молекул на малые интервалы, равные dv, то на каждый
интервал скорости будет приходиться некоторое число молекул dN(v), имеющих скорость, заключенную в этом интервале. Функция f(v) определяет относительное число молекул dN(v)/N, скорости которых лежат в интервале от v до v+dv,
•т. е.
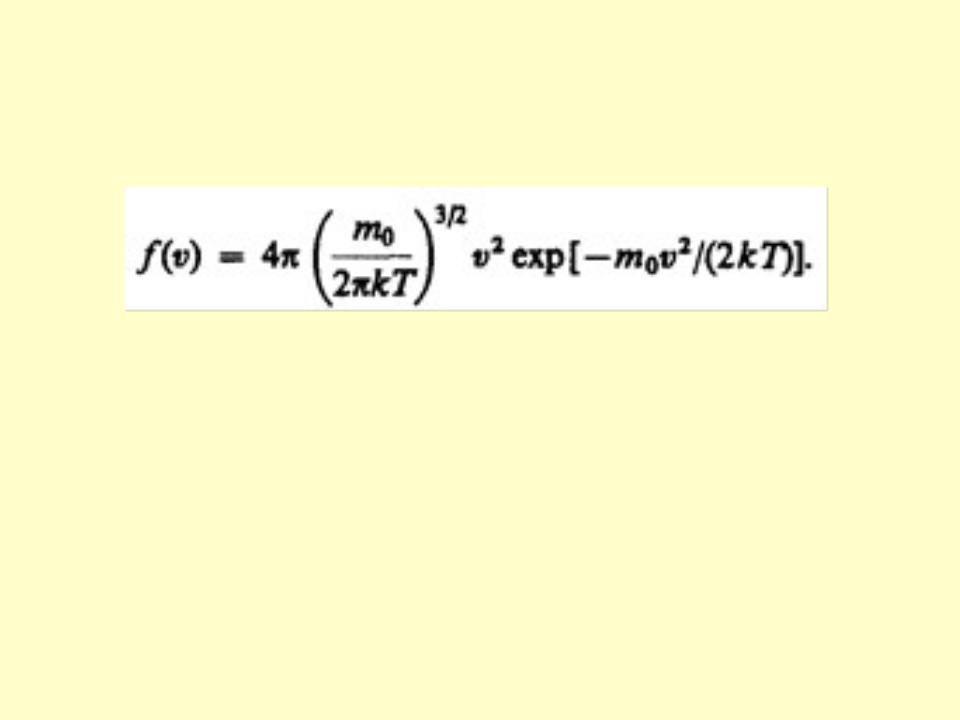
•Применяя методы теории вероятностей, Максвелл нашел функцию f(v) – закон распределения молекул идеального газа по скоростям
•Выводы:
•Вид распределения молекул газа по скоростям для каждого газа зависит от рода газа (m) и от параметра состояния (Т).
Давление P и объём газа V на распределение молекул не влияют.
