
- •Основы молекулярной физики и термодинамика
- ••Молекулярная физика – раздел физики, в котором изучаются физические и физико- химические свойства
- •Броуновское движение
- ••Разделами молекулярной физики являются:
- ••Термодинамика – это наука о тепловых явлениях.
- ••Общим для всех разделов молекулярной физики является теоретический подход, основанный на применении феноменологического
- ••Атомы и молекулы, взаимодействуют друг с другом, образуют разнообразные вещества (системы).
- ••Для описания состояния макросистемы вводят параметры, которые называются параметрами состояния.
- ••Объем газа V — это объем сосуда, в котором газ находится. В СИ
- ••Температура — скалярная физическая величина вводится для количественной характеристики внутренней энергии тела. Опыт
- •Идеальный газ
- •Идеальный газ
- •Идеальный газ
- •Состояние системы
- •Состояние системы
- •Состояние системы
- •Состояние системы
- •Состояние системы
- •Изопроцессы
- •Изопроцессы
- •Закон Шарля
- •Изопроцессы
- •Изобарный процесс
- •Закон Гей-Люссака
- •Закон Авогадро
- •Закон Дальтона
- •Уравнение Клапейрона - Менделеева
- •Уравнение Клапейрона - Менделеева
- •Уравнение Клапейрона - Менделеева
- •Давление идеального газа
- •Основное уравнение молекулярно- кинетической теории идеальных газов
- •• Если газ в объеме V содержит N молекул, движущихся со скоростями ,
- ••Средняя кинетическая энергия поступательного движения одной молекулы идеального газа из уравнений (2) и
- •Закон Максвелла для распределения молекул идеального газа по скоростям
- ••Закон Максвелла описывается некоторой функцией f(v), называемой функцией распределения молекул по скоростям.
- ••Применяя методы теории вероятностей, Максвелл нашел функцию f(v) – закон распределения молекул идеального
- ••В показателе степени стоит отношение
- •Распределение Максвелла имеет вид
- ••Из графика видно, что при «малых» υ, т.е. при
- •• Величину скорости, на которую приходится
- ••Для одного моля газа:
- ••Все три скорости незначительно отличаются друг от друга множителем порядка единицы, причем
- •На рисунке показана зависимость f(υ) при различных температурах и массах молекул газа
- ••Закон Максвелла для распределения молекул идеального газа по скоростям и все вытекающие следствия
- •Распределение Больцмана
- •Распределение Больцмана
- ••Если высота сосуда много меньше чем kT/mg, то зависимостью концентрации от высоты можно
- •Распределение Больцмана
- •Опытное обоснование молекулярно- кинетической теории
- •Броуновское движение
- •Броуновское движение
- •Броуновское движение
- •Броуновское движение
- •Первое экспериментальное определение скорости молекул. Опыты Штерна.
- •Опыт Штерна
- •Опыт Штерна
- •Опыт Штерна
- •Опыт Штерна
- ••Легко связать это смещение S со скоростью молекул v. Молекулы достигают стенки за
- ••По формуле рассчитывали скорость.

Закон Шарля
•Уравнение изохорного процесса называется законом Шарля и может быть записано в виде:
•где p0 – давление газа при T = T0 = 273,15 К (т. е. при температуре 0 °С). Коэффициент α, равный (1/273,15) К–1, называют температурным коэффициентом давления.
Изопроцессы
Изобарный процесс p=const
•В области низких температур все изобары идеального газа сходятся в точке T=0.
•Но это не означает, что объем реального газа обращается в нуль.
•Все газы при сильном охлаждении превращаются в жидкости, а к жидкостям уравнение состояния неприменимо.
•Именно поэтому, начиная с некоторого значения температуры, зависимость объема от температуры проводится на графике штриховой линией. В действительности таких значений температуры и давления у вещества в газообразном состоянии быть не может.
Изобарным можно считать расширение газа при нагревании его в цилиндре с подвижным поршнем, если внешнее давление постоянно. Постоянство давления в цилиндре обеспечивается атмосферным давлением на внешнюю поверхность поршня.
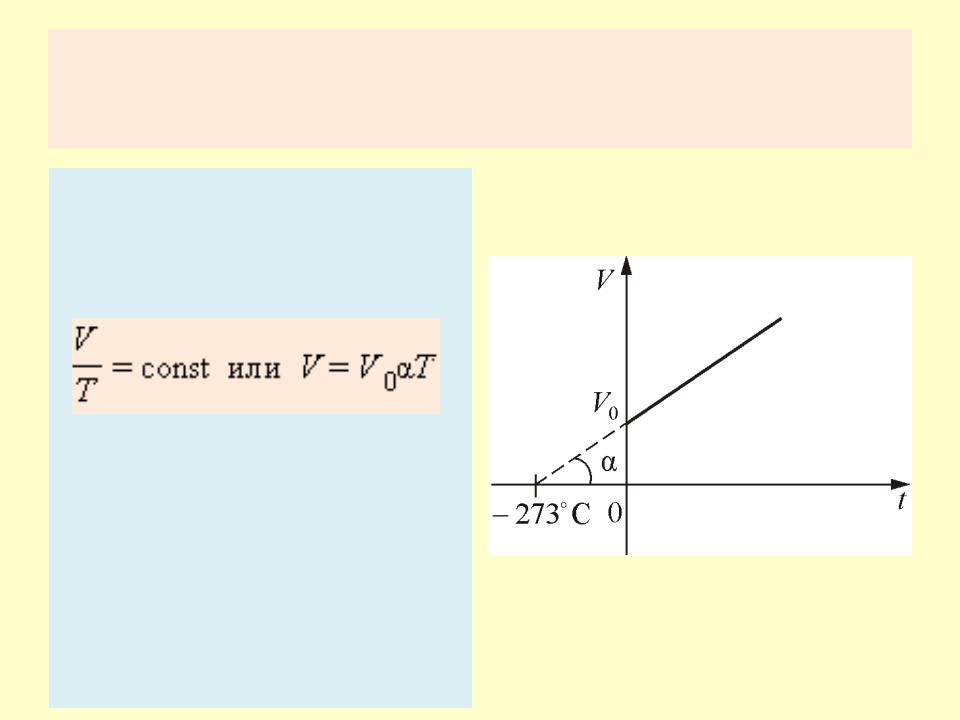
Изобарный процесс
• Уравнение изобарного процесса для некоторого неизменного количества вещества ν имеет вид:
• где V0 – объем газа при
температуре 0 °С. Коэффициент α равен (1/273,15) К–1. Его называют температурным коэффициентом объемного расширения газов.

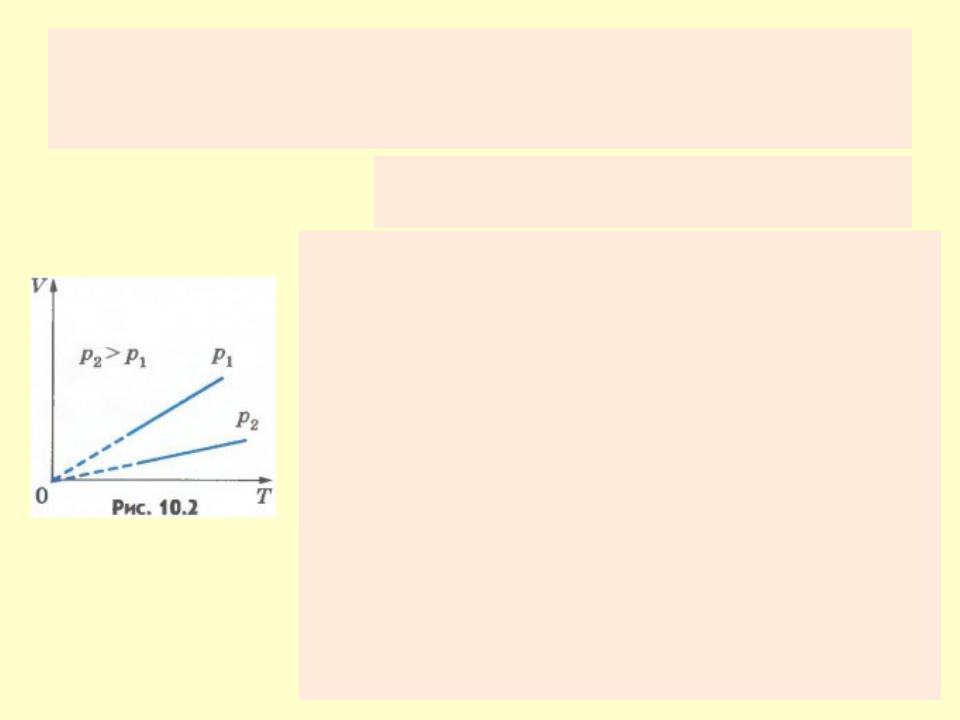
Закон Гей-Люссака
Семейство изобар на плоскости (V, T). p3 > p2 > p1.
•Уравнение изобарного процесса называют законом Гей-Люссака.
•На плоскости (V, T) изобарные процессы при разных значениях давления p изображаются семейством прямых линий, которые называются изобарами


Закон Авогадро
•1 моль любого газа при нормальных условиях (0 и 760 мм рт. ст.) занимает объем 22,4 л
(или 22.4
Молярный объем = 22,4 /моль
Закон Дальтона
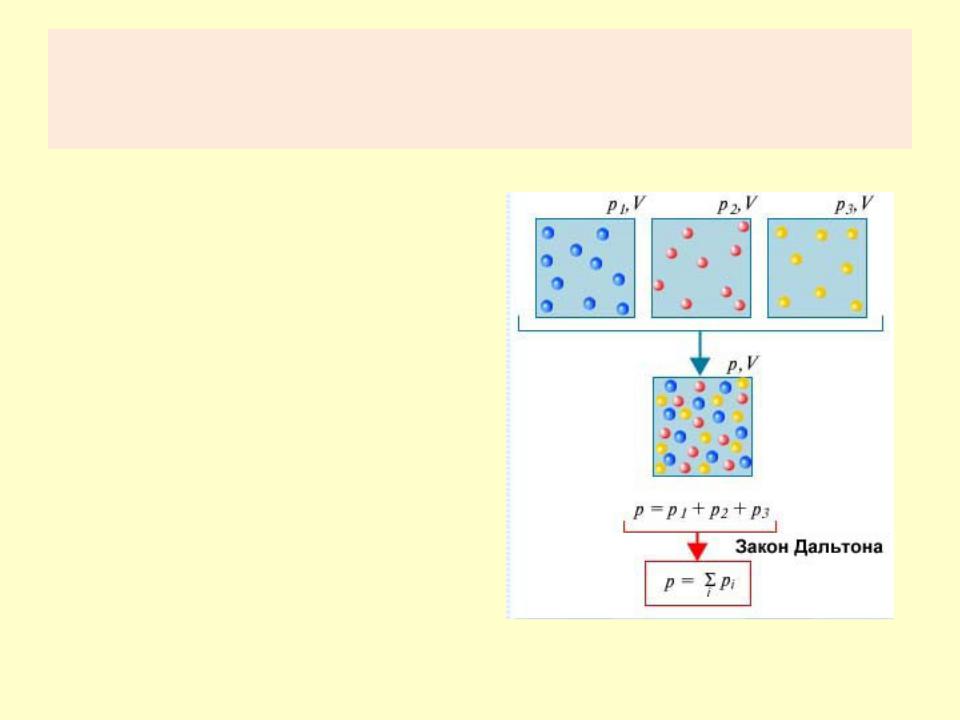
•Исследование давления смеси газов впервые произведено в 1809 г. английским химиком Джоном Дальтоном (1766— 1844).
•Давление, которое будет
иметь каждый из газов, составляющих смесь, если удалить остальные газы из объема, занимаемого смесью, называют парциальным давлением этого газа (от латинского слова pars — парциальный, частичный).
•Давление смеси газов равно сумме их парциальных давлений (закон Дальтона).
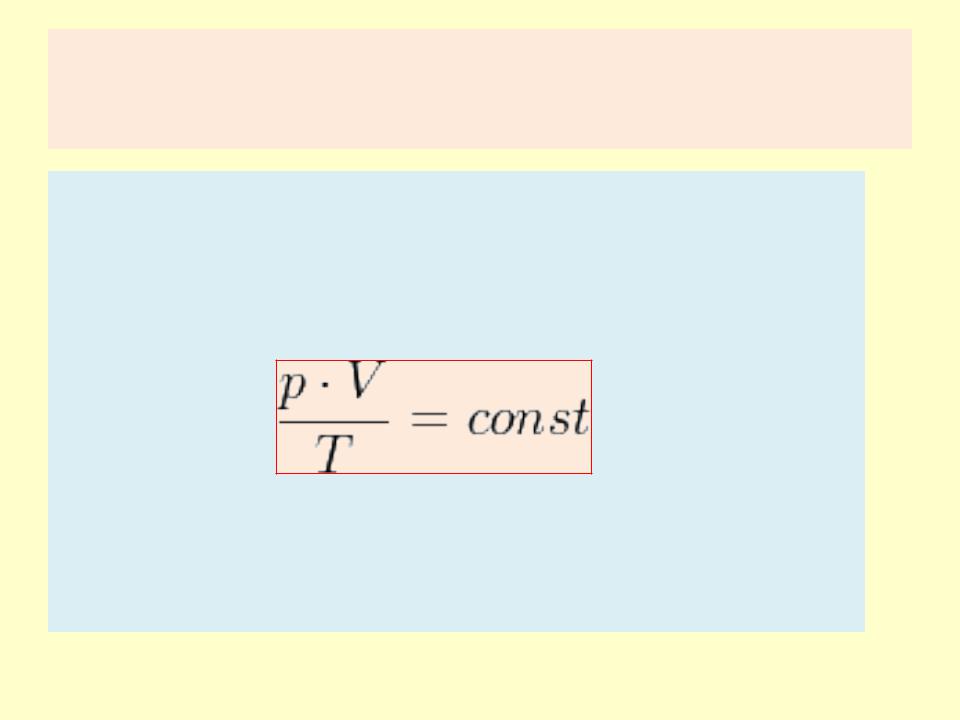
Уравнение Клапейрона - Менделеева
•Клапейрон вывел уравнение состояния идеального газа, объединив законы Бойля- Мариотта, Шарля и Гей-Люссака для данной массы газы
-уравнение Клапейрона

Уравнение Клапейрона - Менделеева
•Менделеев объединил уравнение Клапейрона с законом Авогадро, отнеся уравнение Клапейрона к 1 молю, используя молярный объем
•R – молярная газовая постоянная одинаковая для всех газов, R = 8,31 Дж/(моль при н.у.
-уравнение Клаперойна-Менделеева

Уравнение Клапейрона - Менделеева
•Уравнение Клапейрона-Менделеева для массы m газа
• где ν = - количество вещества (моль),
•µ - молярная масса (кг/моль)
