
- •Введение
- •1. Теоретические основы
- •1.1. Адсорбция. Теория адсорбции ленгмюра. Уравнение фрейндлиха
- •1.2. Поверхностное натяжение чистых жидкостей и растворов. Уравнение гиббса
- •1.3. Суспензии, их свойства. Седиментационный анализ суспензий
- •1.4. Методы получения дисперсных систем. Коагуляция коллоидных растворов
- •2. Экспериментальная часть
- •2.1. Изучение адсорбции уксусной кислоты углем и определение констант уравнения ленгмюра
- •Обработка экспериментальных данных
- •Техника безопасности
- •Контрольные вопросы
- •2.2. Измерение поверхностного натяжения и вычисление адсорбции поверхностно – активного вещества
- •Порядок проведение эксперимента
- •Обработка экспериментальных данных
- •Техника безопасности
- •Контрольные вопросы
- •2.3. Седиментационный анализ суспензий
- •Порядок проведение эксперимента
- •Обработка экспериментальных данных
- •Определение порога коагуляции золя гидрата окиси железа солями кс1 и к2s04
- •Взаимная коагуляция золей берлинской лазури и гидрата окиси железа
- •3. Построение касательной к кривой в данной точке при графическом дифференцировании
- •Техника безопасности
- •Контрольные вопросы
- •Список литературы
- •Содержание
- •Редактор л.А. Маркешина
- •450062, Г. Уфа, ул. Космонавтов,1.
Обработка экспериментальных данных
Данные, полученные при проведении эксперимента, представляют графически в виде седиментационной кривой (рисунок 10).
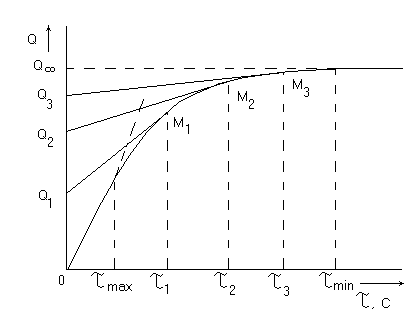
Рисунок 10 - Кривая накопления осадка, или седиментационная кривая
На различных участках кривой седиментации проводят 5...7 касательных и продолжают их до пересечения с осью ординат с таким расчетом, чтобы на ней отсекались отрезки примерно одинаковой длины, для построения касательных выбирают участки кривой, где кривизна изменяется наиболее резко. Массовый процент каждой фракции, полностью осевшей в интервале времени τi...τi+1, pаcсчитывают по формуле
![]()
(% масс.), (26)
где Qi Qi+1- длина отрезка, отсекаемого на оси ординат касательными к кривой седиментации в точках Мi и Мi+1; ОQ∞- длина отрезка, отсекаемого на оси ординат продолжением горизонтального участка кривой седиментации.
Производят расчет эквивалентных радиусов, полностью осевших к моменту времени τi. Под эквивалентными радиусами понимают следующее: при определении размеров частиц любой формы с помощью закона Стокса получают не истинные радиусы частиц, а так называемые "эквивалентные" радиусы сферических частиц, осаждающихся с такой же скоростью, как и данные частицы.
Для этого прежде всего определяют значение константы К в уравнении (13). Для расчета значения К принимают следующие значения: η = 1.10-3 Па.с, ρср=1000 кг/м3, ρф= 2600...2800 кг/м3, g = 9,81 м/с ( для водной суспензии ).
Затем в уравнение (15) поочерёдно подставляют значение времени, соответствующее каждой точке Мi на кривой седиментации. Для нахождения максимального радиуса rmax проводят касательную к седиментационной кривой из начала координат. Конец прямолинейного участка кривой, то есть точка отрыва касательной от кривой седиментации даёт время, соответствующее rmax.
Минимальный эквивалентный радиус rmin вычисляется по времени, соответствующему той точке, где кривая переходит в прямую, параллельную оси абсцисс, то есть в момент, когда осаждение частиц полностью закончилось.
Вычисленные значения радиусов частиц являются пограничными для фракций, содержание которых определяется по величине отрезков, отсекаемых касательными на оси ординат, по уравнению (14). Данные, полученные при обработке седиментационной кривой, заносят в таблицу 4.
Таблица 4 - Результаты обработки седиментационной кривой
|
Время осаждения частиц τ, с |
Радиус частиц τ, мкм |
Интервалы размеров частиц отдельных фракций, мкм |
Длина отрез- ков между касательными, мм |
Содержание фракций в дисперсной системе ΔQ, % (масс.) |
|
|
|
|
|
|
Используя данные таблицы 4, строят суммарную кривую распределения, или "интегральную кривую распределения" (рисунок 11).
Для этого на оси ординат откладывают суммарное процентное содержание фракций ΔQ, начиная с наиболее мелких частиц, а по оси абсцисс - радиусы, соответствующие большему значении радиуса данной фракции.
Из суммарной (интегральной) кривой распределения (рисунок 11) находят величины приращения процентного содержания частиц ΔQ, через равные интервалы радиусов, например, через 2 мкм. Найденные величины записывают в таблицу 5.
По
данным таблицы
5
строят дифференциальную кривую
распределения.
Для
этого
по оси
ординат откладывают величины
![]() ,
а
по
оси
абсцисс - радиусы. На графике рисунка
12
это представлено
прямоугольником.
,
а
по
оси
абсцисс - радиусы. На графике рисунка
12
это представлено
прямоугольником.

Рисунок 11 - Интегральная кривая распределения частиц по их радиусам
Таблица 5 - Таблица данных для построения дифференциальной кривой распределения частиц дисперсной фазы по радиусам
|
Интервалы радиусов частиц Δr, мкм |
Суммарное содержание фракций ΔQ, %(масс.) |
Содержание фракций частиц ΔQ в данном интервале радиусов, %(масс.) |
|
|
|
|
|
|
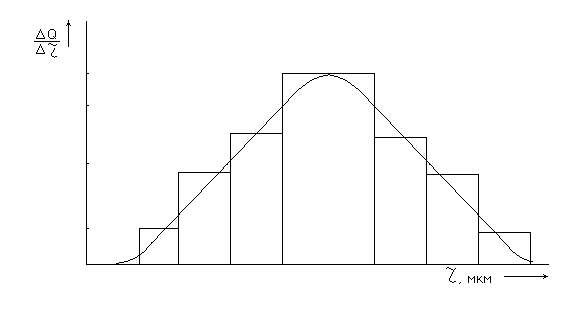
Рисунок 12 - Дифференциальная кривая распределения частиц
дисперсной фазы по радиусам
Так как интервалы радиусов для построения кривой дифференциального распределения одинаковы, то высоты прямоугольников пропорциональны процентному содержанию отдельных фракций.
Соединяя середины оснований прямоугольников, получим плавную кривую, подобную изображенной на рисунке 12. Максимум на дифференциальной кривой распределения соответствует наиболее вероятному размеру частиц. Этим размером практически и характеризуется дисперсность суспензий и эмульсий.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Суспензии. Свойства, получение и применение.
2. Седиментационная и агрегативная устойчивость суспензий.
3. Седиментация.
4. Седиментационный анализ полидисперсных систем.
5. Седиментационный анализ монодисперсных систем.
6. Условия, ограничивающие применение седиментационного анализа.
2.4. ПОЛУЧЕНИЕ КОЛЛОИДОВ И ИХ КОАГУЛЯЦИЯ
ЭЛЕКТРОЛИТАМИ
Цель работы: определить порог коагуляции и коагулирующее действие золя гидроокиси железа и берлинской лазури.
ПОРЯДОК ПРОВЕДЕНИЯ ЭКСПЕРИМЕНТА
Получение коллоидных растворов (золей).
Получение золя гидроокиси железа методом гидролиза
В конической колбе емкостью 300 см3 нагревают до кипения 200 см3 дистиллированной воды. В кипящую воду приливают по каплям около 20 см3 2%-ного раствора хлорного железа. После нескольких минут кипячения в результате гидролиза получается красно-коричневый золь гидроокиси железа.
Строение мицеллы полученного золя:
[(Fе(ОН)3
)m∙![]() n
FeO+∙(n-x)
Cl¯]+∙х
Сl¯
n
FeO+∙(n-x)
Cl¯]+∙х
Сl¯
Гидрат окиси железа Fе(ОН)3 и потенциалопределяющий ион Fe0+ образуется в результате гидролиза хлорного железа FеС13.
Получение золя берлинской лазури
К 200 см3 дистиллированной воды добавляют 2 см3 1%-ного раствора К4Fe(CN)6 и приливают по каплям 2%-ный раствор хлорного железа (FeCI3) до синего цвета.
Коагуляция коллоидных растворов.
Определение порога коагуляции золя берлинской лазури
солями КС1, ВаС12, А1С13
Золь берлинской лазури имеет отрицательно заряженные частицы, поэтому коагулирующее действие на него будут оказывать ионы К+, Ва2+, Al3+.
Для определения порога коагуляции используют растворы 3N КС1; 0,02N BaCl2 и 0,003N А1С13.
Из исходных растворов путем последовательного их разбавления готовят 6 растворов различных концентраций по 5 см3.
Растворы КС1, BaCl2 готовят следующим образом: в первую пробирку наливают 5 см3 исходного раствора, во вторую пробирку наливают 5 см3 исходного раствора и 5 см3 воды и встряхивают. Из второй пробирки переносят 5 см3 раствора в третью, туда же добавляют 5 см3 воды и встряхивают. Из третьей пробирки 5 см3 раствора переносят в четвертую пробирку и т.д.
Растворы А1С13 готовят таким образом: наливают в первую пробирку 5 см3 0,003N раствора А1С13, 5 см3 воды и встряхивают. Из первой пробирки 5 см3 раствора переносят во вторую пробирку, туда же добавляют 5 см3 воды и встряхивают. Из второй пробирки 5 см3 раствора переносят в третью пробирку и т.д. После того, как растворы всех 3-х электролитов будут приготовлены, к каждому из них прибавляют по 5 см3 золя берлинской лазури и встряхивают пробирки для того, чтобы растворы хорошо перемешались.
Примерно через сутки одновременно отмечают (знаком «+» в графе "результаты опыта") те пробирки, в которых произошла коагуляция золя.
На основании результатов наблюдений вычисляют порог коагуляции, коагулирующее действие и соотношение между коагулирующими действиями ионов К+, Ва2+, А13+.
Полученные данные записывают в таблицу 6.
Таблица 6 – Экспериментальные данные
|
Концентрация электролитов
|
Результаты опыта
|
Порог коагуляции, γ |
Коагулирующее действие, (1/γ) |
|
|
в воде
|
в растворе золя
|
|||
|
|
|
|
|
|
