
- •Краснодар 2009
- •Список исполнителей
- •1 Синтез феромонов вредителей плодовых, овощных культур, сахарной свеклы и виноградника
- •Додецин-8-ол-1
- •Лабораторный регламент
- •Технические условия
- •1 Технические требования
- •2 Правила приемки
- •3 Методы испытаний
- •5 Указания по эксплуатации
- •Технические условия
- •1 Технические требования
- •2 Правила приемки
- •3 Методы испытаний
- •5 Указания по эксплуатации
1 Синтез феромонов вредителей плодовых, овощных культур, сахарной свеклы и виноградника
В 2009 году для проведения аналитических исследований и биологических испытаний был осуществлен синтез половых феромонов ряда вредителей плодовых, овощных культур, сахарной свеклы, кукурузы и виноградника.
Е, Е-8,10-додекадиенол, половой феромон яблонной плодожорки был синтезирован по методике [1,2] из 1-(2-тетрагидропиранилокси)-6-хлоргексана и сорбилацетата.
Z-8-Додеценилацетат - основной компонент полового феромона сливовой и восточной плодожорок был синтезирован по следующей схеме (рисунок 1):
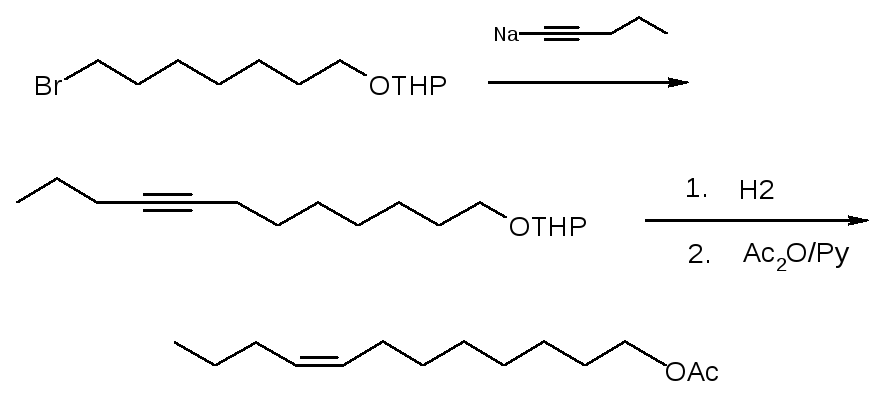
Рисунок 1 – Схема синтеза Z-8-додеценилацетата
1-Тетрагидропиранилокси-7-бромгептан был получен взаимодействием 1-тетрагидропиранилоксибутил-4-магний хлорида с 1,3-дибромпропаном.
Половой феромон одного из опаснейших вредителей сахарной свеклы, свекловичной минирующей моли Scrobipalpa ocellatella, E-3-додеценилацетат, получали взаимодействием деканаля с малоновой кислотой в триэтаноламине (рисунок 2):
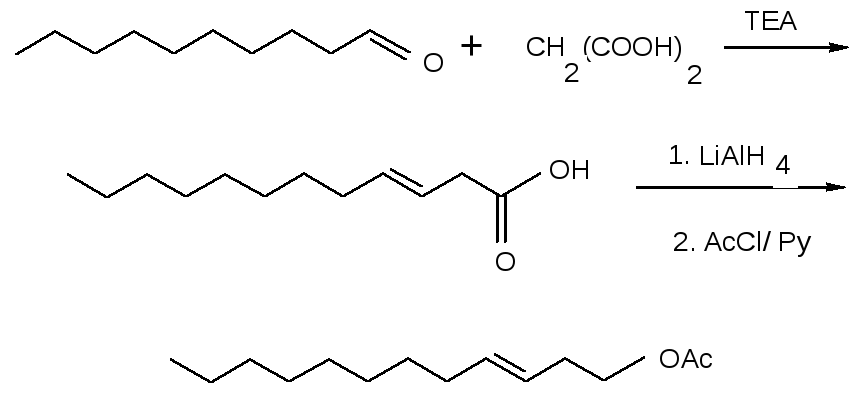
Рисунок 2 – Схема синтеза Е-3- додеценилацетата
Половой феромон хлопковой совки, состоящий из двух компонентов, Z-11- гексадеценаля и Z-9-гексадеценаля в соотношении 10:1 синтезирован из гексинил- и октинилнатрия и 1- тетрагидропиранилокси-10-бромдекана и 1- тетрагидропиранилокси-8-бромоктана соответственно в тетрагидрофуране в присутствии гексаметапола с последующим гидрированием алкинолов и окислением спиртовых групп в альдегидные [3-5].
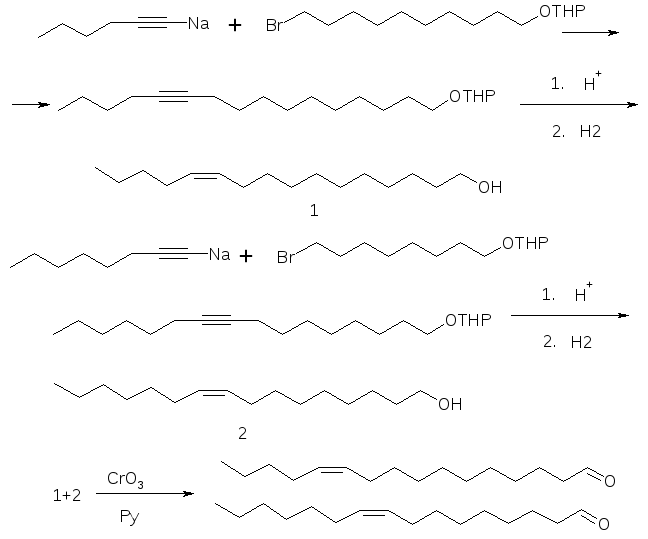
Рисунок 3 – Синтез полового феромона хлопковой совки
Половой феромон нижнесторонней минирующей моли для его использования в разработке метода диссеминации получен по схеме [6] (рисунок 4):
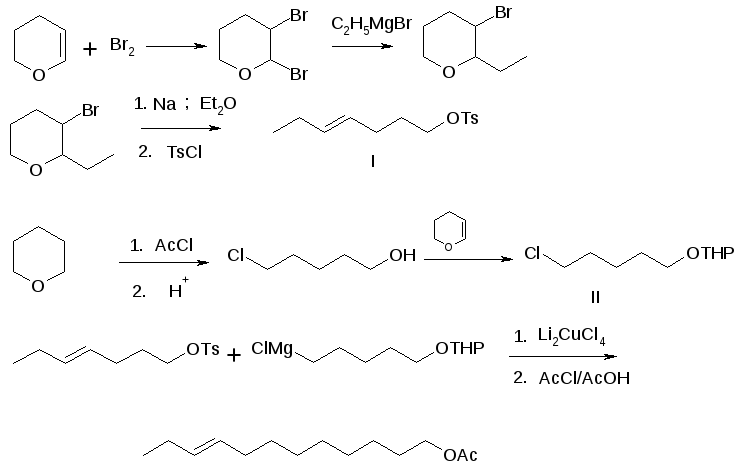
Рисунок 4 – Схема синтеза полового феромона нижнесторонней минирующей моли
Строение всех синтезированных соединений подтверждены данными физико-химических методов анализа (ИК, ПМР, масс-спектрометрия). Биологические испытания этих веществ подтвердили их высокую аттрактивность по отношению к соответствующим вредным насекомым.
Синтезированные феромоны были использованы для разработки новых методов регулирования численности вредителей.
По результатам исследований нами разработаны лабораторные регламенты синтеза феромонов восточной плодожорки, свекловичной минирующей моли и гроздевой листовертки. Для этих же вредителей разработаны ТУ на феромонные ловушки.
-
РАЗРАБОТКА МЕТОДОВ СИНТЕЗА И СИНТЕЗ
ФЕРОМОНОВ КАРАНТИННЫХ ВРЕДИТЕЛЕЙ
В 2009 году продолжены исследования по усовершенствованию методов синтеза и осуществлен синтез половых феромонов карантинных вредителей, как ограниченно распространенных, так и отсутствующих на территории Российской Федерации, например таких, как персиковая плодожорка Carposina niponensis, азиатская хлопковая совка Spodoptera litura, капровый жук Trogoderma granarium, азиатский усач Anoplophora glabripennis, яблонная муха Rhagoletis pomonella и некоторых других вредителей.
Половой феромон капрового жука был получен нами по схеме (рисунок 5):
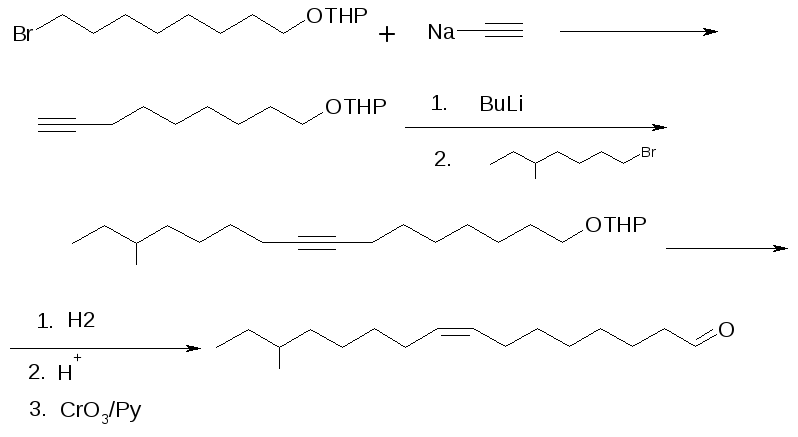
Рисунок 5 – Схема синтеза полового феромона капрового жука
Тетрагидропиранилокси-7-бромгептан, полученный также, как и в синтезе феромона сливовой и восточной плодожорок, вводили во взаимодействие с ацетилидом натрия в тетрагидрофуране и получали тетрагидопиранилокси-8-нонин. Второй реагент – 5-метил-1-бромгептан синтезирован из вторичного хлормагнийбутана с 1,4-дибромбутаном. Взаимодействие этих реагентов привело к 14-метилгексадецин-8-олу-1. После восстановления тройной связи в двойную с цис-геометрией, спиртовую группу окисляли в альдегидную и получали целевой феромон.
Еще одним из опаснейших карантинных вредителем, ограниченно присутствующим на территории Российской Федерации является непарный шелкопряд Lymantria dispar. Это первый феромон из известных, который впервые выделен и идентифицирован шведским химиком К. Бутенандтом 50 лет назад. Он представляет собой длинноцепочечный разветвленный углаводород, содержащий эпоксидную группу – 2-метил-Z-7,8 – эпоксиоктадекан [7]. Нами разработан простой метод синтеза феромона непарного шелкопряда с использованием легкодоступного сырья по следующей схеме (рисунок 6):
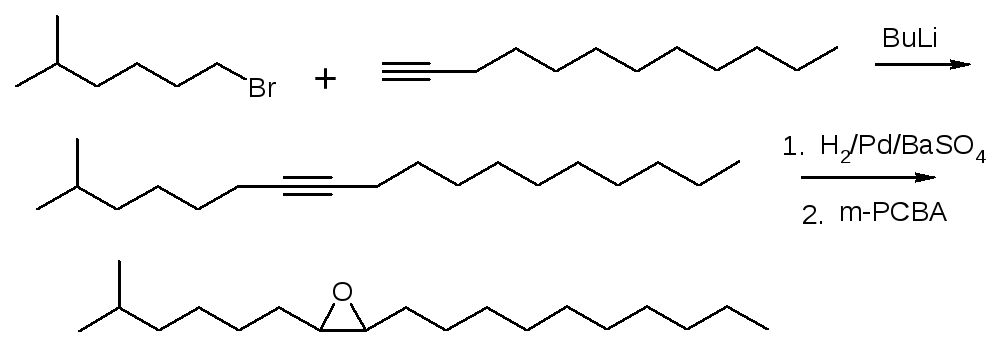
Рисунок 6 – Схема синтеза полового феромона непарного шелкопряда
С учетом того, что в 2009 году в ряде районов Краснодарского края наблюдалась вспышка массового размножения вредителя, применение синтетического аналога его полового феромона для мониторинга представляется весьма актуальным.
Азиатская хлопковая совка Spodoptera litura на территории Российской Федерации не зарегистрирована, но в связи с расширяющимся импортом пищевой продукции из-за рубежа, ее появление в России не исключено, поэтому иметь инструмент для обнаружения этого вредителя необходимо. Самым тонким инструментом для мониторинга азиатской хлопковой совки является ее половой феромон, содержащий в составе два соединения – Z9,E11- и Z9,E12 – тетрадекадиенилацетаты в соотношении 9:1[8]. Основной компонент феромона мы синтезировали с использованием реакции Виттига (рисунок 7):
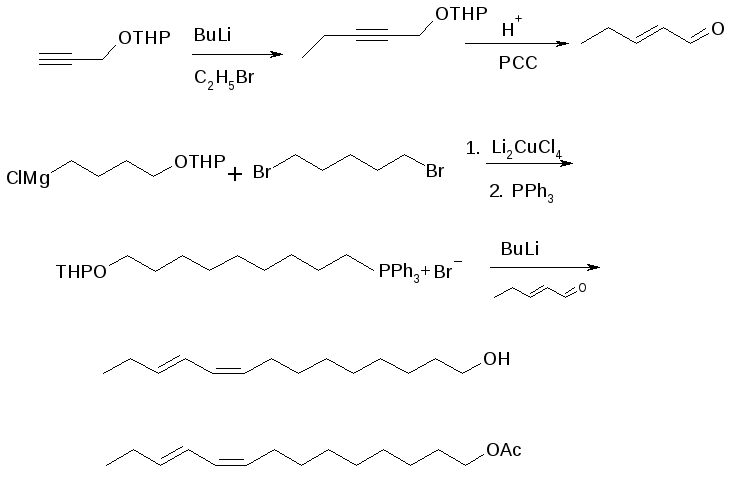
Рисунок 7 – Синтез Z9,E11-тетрадекадиенилацетата
-
СИНТЕЗ ЦИС-9-ТРАНС-12-ТЕТРАДЕКАДИЕНИЛАЦЕТАТА –
ОСНОВНОГО КОМПОНЕНТА ПОЛОВЫХ ФЕРОМОНОВ
ВРЕДИТЕЛЕЙ ЗАПАСОВ
В 2009 году по результатам исследований был разработан новый метод синтеза феромонов вредителей запасов (южной амбарной, шоколадной и мельничной огневок) исходя из легкодоступного сырья (рисунок 8):
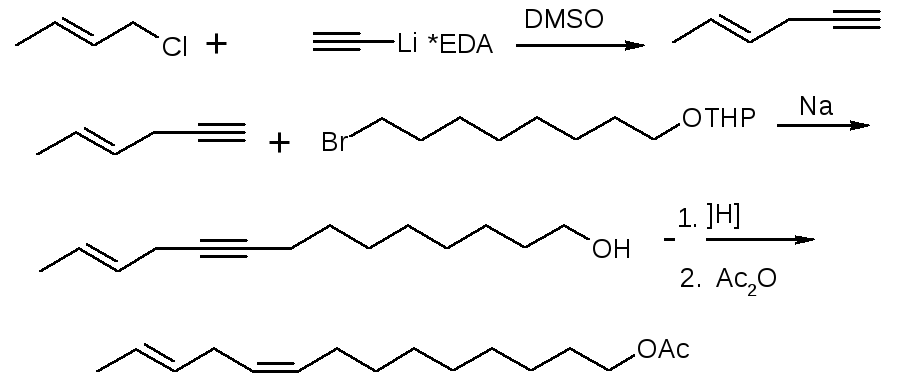
Рисунок 8 – Схема синтеза Z9,E12 – тетрадекадиенилацетата
Из схемы видно, что при взаимодействии хлористого кротила с легкодоступным комплексом ацетилида лития и этилендиамина в диметилсульфоксиде образуется высокореакционноспособный гексен-4-ин-1. Натриевое производное этого енина легко реагирует с 8-бром-1-тетрагидропиранил-оксиоктаном. После гидролиза и гидрирования основного продукта реакции, его ацилируют и получают искомый Z9,E12 – тетрадекадиенилацетат. Это соединение входит в состав половых феромонов вредителей запасов, а также многих других вредителей, включая и азиатскую хлопковую совку Spodoptera litura.
4 РАЗРАБОТКА МЕТОДОВ РЕГУЛИРОВАНИЯ
ЧИСЛЕННОСТИ ВРЕДИТЕЛЕЙ С ПОМОЩЬЮ ПОЛОВЫХ
ФЕРОМОНОВ
Синтетические половые феромоны широко используются в практике защиты сельскохозяйственных культур от вредителей. Использование ловушек с синтетическими половыми феромонами позволяет регулярно проводить наблюдения за развитием вредных чешуекрылых в агроценозах различных сельскохозяйственных культур, определять их численность и устанавливать сроки защитных мероприятий. Своевременное и точное определение сроков борьбы с вредителями является ключевым способом повышения эффективности химических обработок и сокращения объемов применения инсектицидов.
В 2009 году были продолжены исследования методов дезориентации сливовой и яблонной плодожорки. Так, применение синтетического полового феромона сливовой плодожорки для дезориентации вредителя в сливовом саду показали, что этот метод позволяет получить почти 100 % эффект дезориентации, тогда как стандартный метод защиты сливового сада с использованием набора инсектицидов позволяет получить эффект в 86,9 % (табли-ца 1).
Таблица 1 – Эффект дезориентации сливовой плодожорки
|
Вариант |
Наименование препаратов, применяемых в защите сливы системе защиты
|
Биологическая эффективность,% урожая |
|
||
|
Хим. инсектициды - стандарт |
Карбофос, КЭ 1,3л/га – Ди-68,КЭ 2л/га – Ди-68,КЭ 1,7л/га – Тагор, КЭ 1,5л/га – Сумитион, КЭ 2л/га – Ципи плюс, КЭ 1,5л/га – Тагор, КЭ 1,5л/га |
83,4 |
|
||
|
|
Дезориен- тация |
Без обработок инсектоакарицидами |
98,5 |
|
|
|
|
Контроль |
Без обработок инсектоакарицидами |
47,4 % повреж-денных плодов
|
|
|
На контрольном участке сада, где не проводились обработки пестицидами было повреждено почти 50 % плодов.
Опыты по дезориентации яблонной плодожорки, проведенные в 2009 году в опытном саду «Колледж Ейский» показали, что при высокой численности вредителя эффект дезориентации составил 95,8 % (таблица 2):
Таблица 2 – Эффективность дезориентации яблонной плодожорки
|
Период вегетации |
Отловлено бабочек в среднем на 1 ловушку |
Эффективность дезориентации, % |
|
|
опыт |
контроль |
||
|
май |
0 |
6,5 |
100 |
|
июнь |
3 |
33,5 |
95,5 |
|
июль |
5 |
31,5 |
91,0 |
|
август |
3,4 |
16,5 |
97,0 |
|
В среднем |
95,8 % |
||
В 2009 году продолжена разработка нового метода применения феромонов для регулирования численности вредных насекомых (метод диссеминации) на примере основного экономически значимого вредителя яблони – яблонной плодожорки. Метод основан на модификации предложенного нами ранее приема наводнения популяции вредителя насекомыми, несущими феромонную метку [9]. Для этих целей разработаны специальные препаративные формы феромонов, представляющие собой нефиксирующие носители феромона на основе молекулярных сит. Основные итоги испытаний представлены в отчете по подэтапу 05.04.03.02.01.
5 ИЗУЧЕНИЕ ХИМИЧЕСКОЙ КОММУНИКАЦИИ
КОЛОРАДСКоГО ЖУКА LEPTINOTARSA DECEMLINEATA
SAY (COLEOPTERA:CHRYSOMELIDAE)
Проблема создания саморегулирующихся биоценозов, в которых необходимо установить равновесие между полезной и вредной энтомофауной, связана с изучением внутри- и межвидовой химической коммуникации этих организмов. Особое место в решении основной фундаментальной проблемы является изучение химической коммуникации колорадского жука Leptinotarsa decemlineata Say (Coleoptera:Chrysomelidae) – основного вредителя пасленоых культур с применением синтетических аналогов сигнальных веществ для мониторинга и биологического контроля колорадского жука.
Разработка технологии регулирования численности колорадского жука с использованием агрегационного феромона, аттрактантов, репеллентов и кайромонов является актуальной задачей для создания управляемых агроэкосистем.
В настоящее время в мировой практике борьба с колорадским жуком - опаснейшим вредителем пасленовых культур, в особенности, картофеля, осуществляется с помощью пестицидов, к которым у вредителя с каждым годом возникает резистентность. Это приводит к необходимости увеличивать дозы применяемых ядохимикатов, что отрицательно сказывается на окружающей среде и здоровье человека, либо проводить дорогостоящие исследования по усовершенствованию пестицидов.
Для борьбы с колорадским жуком предложено использование хищных членистоногих путем сезонного наводнения ценоза картофеля, например, хищных клопов семейства Pentatomidae. Однако этот способ регулирования численности является весьма трудоемким и требует массового разведения хищников в лабораторных условиях.
Использование терпеновых соединений в качестве репеллентов колорадского жука представляется наиболее перспективным при борьбе с этим вредителем.
В 2009 году мы синтезировали или выделили из природного сырья и провели скриннинг ά-терпинена, карвона и туйона. [10]ά-Терпинен был синтезирован путем нагревания линалоола с муравьиной кислотой. Карвон был выделен из кетонной фракции укропного масла, в которм карвон содержится в количестве 70 %, а туйон был получен нами из туевого масла методом колоночной хроматографии. В настоящее время разрабатываются методы синтеза карвона и туйона.
Полевые испытания смеси показали, что обработка картофельных посадок раствором смеси этих соединений приводит к сокращению взрослых особей колорадского жука на посадках картофеля в 4-5 раз по сравнению с контролем.
В дальнейшем планируется синтез и испытания в качестве репеллентов дигидрокарвона и цинеола, а также разрабатывается синтез 3,7 -диметил-2-оксо-6-октен-1,3-диола - аттрактанта колорадского жука, который может быть использован для элиминации вредителя. Это соединение будет синтезировано на основе чистого энантиомера (S)(+) - линалоола, который будет выделен из кориандрового масла, содержащего 70 % линалоола. В кориандровом масле содержание (S)(+)- энантиомера составляет 88 %, а (R)(-)-энантиомера линалоола — 12 %. Дробной перекристаллизацией 3,5-динитробензоата линалоола из 95 % этанола можно получить практически чистый (S)энантиомер.
Работа выполнена при финансовой поддержке РФФИ и администрации Краснодарского края (проект № 09-04-96540).
6 РАЗРАБОТКА МЕХАНИЧЕСКИХ УСТРОЙСТВ ДЛЯ
ПРОИЗВОДСТВА ФЕРОМОННЫХ ЛОВУШЕК
В 2008 году для массового изготовления феромонных диспенсеров и ловушек в институте создано специализированное оборудование, в том числе, установка для нанесения феромонов на диспенсеры и приспособления для изготовления корпусов ловушек плодожорок, калифорнийской щитовки, капрового жука и других вредных насекомых [11].
Более подробная информация по устройствам для производства феромонных ловушек изложена в отчете по теме 05.02.02.04.
-
З А К Л Ю Ч Е Н И Е
Синтезированы феромоны основных вредителей сельскохозяйственных культур.
Разработаны новые методы синтеза и осуществлен синтез половых феромонов некоторых карантинных вредителей, отсутствующих или ограниченно распространенных на территории Российской Федерации.
Продолжены исследования методов дезориентации и диссеминации яблонной плодожорки с использованием средств химической коммуникации индифферентных нецелевых видов, в частности нижнесторонней минирующей моли.
Проведен мониторинг хлопковой совки на кукурузе с помощью синтетического полового феромона.
Проведены исследования химической коммуникации колорадского жука Leptinotarsa decemlineata Say.
Разработаны, изготовлены и испытаны приспособления, обеспечивающие изготовление корпусов феромонных ловушек из ламинированной бумаги для плодожорок, калифорнийской щитовки и капрового жука. Доработана и испытана установка для пропитки заготовок феромонных диспенсеров.
Разработаны лабораторные регламенты синтеза половых феромонов восточной плодожорки, свекловичной минирующей моли и гроздевой листовертки и ТУ на феромонные ловушки для этих вредителей.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1 Поиск биологически активных веществ, разработка их препаративных форм и оценка биологической активности новых препаратов [Текст] : отчет о НИР (промежуточ.) / Всерос. науч.-исслед. ин-т биологической защиты растений ; рук. Исмаилов В.Я. ; исполн.: Журавлев С.В. [и др.]. – Краснодар, 2002. – 20 с. – Библиогр.: с. 20. - № ГР 01.20 0.2 00082. - Инв. № 02.20.03 06227
2 Изучить механизмы химического взаимодействия вредных и полезных членистоногих в агроценозах и создать на этой основе новые экологически малоопасные средства защиты растений [Текст] : отчет о НИР (промежуточ.) / Всерос. науч.-исслед. ин-т биологической защиты растений ; рук. Исмаилов В.Я. ; исполн.: Журавлев С.В. [и др.]. – Краснодар, 2003. – 20 с. – Библиогр.: с. 20. - № ГР 01.20 0.2 00082. - Инв. № 02.2.00 403189.
3 Разработать экологизированные системы защиты сельскохозяйственных культур от вредных членистоногих на основе использования энтомофагов, энтомопатогенных организмов и биологически активных веществ природного происхождения [Текст]: отчет о НИР (заключ.) / Всерос. науч.-исслед. ин-т биологической защиты растений ; рук. Исмаилов В.Я. ; исполн.: Сеничев В.С. [и др.]. – Краснодар, 2000. – 63 с. – Библиогр.: с. 61-63. - № ГР 01.99.00 06585. - Инв. № 02.200.1 08194.
4 Zhuravlev, S.V. Common Approach to Synthesis Sex Pheromones of Some Species of Insect Order Lepidoptera and Their Application for Plant Protection[Текст] / S.V. Zhuravlev, V.Ya.Ismailov, S.N.Sviridenko, S.A.Ermolenko // Proc. of the 1st KMITL International Conference of Science&Technology for Sustainable Development, Bangkok, Thailand. - 2004. - 25-26 August. - Vol.2. - P.199-200.
5 Ismailov, V.Ya. Technology for Production and Application of Arthropod Pheromones for Monitoring and Regulation of Pest Populations [Текст] / V.Ya. Ismailov, S.V.Zhuravlev // The 5th ISTC/Korea Workshop on Biotechnology. - 2004. - P.155-158.
6 Журавлев, С.В. Синтез Е-10-додеценилацетата – полового феромона нижнесторонней минирующей моли [Текст] / С.В.Журавлев, А.А. Андреев, В.С.Сеничев, В.Я. Исмаилов // Экологизация сельскохозяйственного производства Северного Кавказа - Анапа, 1995.- 121-122.
7 Bierl, B.A. Isolation, identification, and synthesis of the gypsy moth sex attractant [Текст]/ B.A. Bierl, M.Beroza, C.W.Collier// J. Econ. Entomol. - 1972. - Vol. 65, p. 659-664.
8 Sun, F. The behavioral responses of Spodoptera litura (F.) males to the female sex pheromone in wind tunnel and field trapping tests [Текст]/ F.Sun, J.W. Du,T.H. Chen //Acta Entomol. Sin. - 2003. - Vol. 46 p.126-130.
9 Исмаилов, В.Я. Новый подход к регулированию численности насекомых с помощью синтетических половых феромонов [Текст]/ В.Я. Исмаилов, И.Н.Олещенко, В.Н.Орлов, А.В.Алексеенко// Химическая коммуникация животных. – М.: Наука, 1986. – 432 с.
10 Надыкта, В.Д. Исследование основ химической коммуникации клопов-щитников (Hemiptera: Pentomidae) с целью разработки новых методов управления популяциями вредных видов [Текст] / В.Д.Надыкта, В.Я.Исмаилов, С.В.Журавлев, С.Н.Свириденко, Д.С.Скрипник, Д.В.Степанов // Вклад фундаментальных исследований в развитие современной инновационной экономики Краснодарского края: матер. конф. Получателей грантов регионального конкурса Российского фонда фунд. иссл. и адм. Краснодарского края «ЮГ» (п.Агой, декабрь 2008 г.). - Краснодар: изд-во «Просвещение-ЮГ), 2008. – С. 65-66.
11 Журавлев С.В., Технологическое оборудование для изготовления элементов феромонных ловушек. [Текст] / Ю.Г.Соколов, Н.А.Евсюков, Ф.Ф.Худой //Биологическая защита растений – основа стабилизации агроэкосистем. Выпуск 5. Биологическая защита растений, перспективы и роль в фитосанитарном оздоровлении агроценозов и получении экологически безопасной сельскохозяйственной продукции: материалы международной конференции. – 2008, с. 346-347.
ПРИЛОЖЕНИЯ
ПРИЛОЖЕНИЕ А
Российская академия сельскохозяйственных наук
Государственное научное учреждение
ВСЕРОССИЙСКИЙ НАУЧНО-ИССЛЕДОВАТЕЛЬСКИЙ
ИНСТИТУТ БИОЛОГИЧЕСКОЙ ЗАЩИТЫ РАСТЕНИЙ
(ГНУ ВНИИБЗР Россельхозакадемии)
|
|
УТВЕРЖДАЮ Директор ВНИИБЗР д-р техн. наук, проф. академик РАСХН
«___»____________2010 г. |
ЛАБОРАТОРНЫЙ РЕГЛАМЕНТ
Синтеза полового феромона восточной плодожорки
Grapholita molesta T. (Lepidoptera: Tortricidae)
|
|
РАЗРАБОТАНО Лаборатория идентификации и синтеза феромонов Заведующий лабораторией идентификации и синтеза феромонов, к.х.н., с.н.с. _______________С.В.Журавлев «____»___________ 2010 г. |
Краснодар 2009
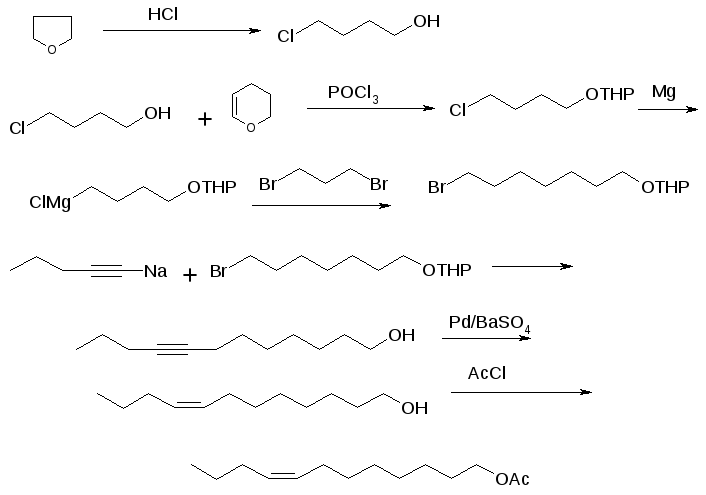
Рисунок А.1 – Принципиальная схема синтеза
-
4-Хлорбутанол
В 90 мл кипящего тетрагидрофурана пропускают медленный ток хлористого водорода, до тех пор, пока температура в парах не станет 101оС. После этого реакционную смесь упаривают в вакууме водоструйного насоса при температуре в бане 80оС, а остаток фракционируют в вакууме, собирая фракцию с Ткип. 64-65оС при 3 мм рт.ст. n20D = 1,4532. Получают 54,4 г 4-хлорбутанола.
-
1-Тетрагидропиранилокси-4-хлорбутан
В трехгорлую круглодонную колбу емкостью 250 мл, снабженную механической мешалкой, обратным холодильником и капельной воронкой, помещают 38 г (0,35 моль) 4-хлорбутанола, прибавляют 0,2 мл хлорокиси фосфора, затем при перемешивании прибавляют по каплям 40 мл (0,4 моль) 2,3-дигидропирана. Реакционную смесь перемешивают в течение 4 часов, после чего фракционируют в вакууме, собирая фракцию с Ткип. 98-100оС при 4 мм рт.ст. Выход 101 г (81%). n18D = 1,4618.
-
1-Тетрагидропиранилокси-8-бромгептан
В трехгорлую круглодонную колбу, снабженную механической мешалкой, обратным холодильником и капельной воронкой с байпасной трубкой в атмосфере сухого аргона помещают 7,6 г (0,314 моль) магниевых стружек, несколько кристаллов иода и нагревают до появления паров иода. Колбу охлаждают до комнатной температуры, затем приливают без перемешивания 20 мл раствора 36 г (0,187 моль) 4-хлор-1-тетрагидропиранил-оксигексана в 100 мл абсолютного тетрагидрофурана, нагревают до начала реакции, что заметно по исчезновению цвета иода, слабому помутнению и закипанию реакционной смеси. После этого вносят 100 мл абсолютного тетрагидрофурана и прибавляют по каплям остальной раствор реагента. Реакцию ведут при перемешивании, прибавляя реагент с такой скоростью, чтобы смесь слегка кипела. После прибавления реагента реакционную смесь кипятят 1 час, охлаждают до комнатной температуры и быстро фильтруют через стеклянную вату в капельную воронку в токе сухого аргона и используют полученный реактив Гриньяра в ключевой стадии. Полученный реактив Гриньяра прибавляют по каплям к охлажденному до – 10 оС раствору 37 г (0,18 моль) дибромпропана в 100 мл абсолютного тетрагидрофурана, содержащего 1,22 г безводной хлористой меди (II) и 0,77 г безводного хлористого лития в токе сухого аргона. Перемешивают при этой температуре 1 час, при 0 оС – 3 часа, а затем нагревают до 40-45 оС в течение 2 часов. Реакционную смесь охлаждают до комнатной температуры и прибавляют насыщенный раствор хлорида аммония. Органический слой декантируют, а осадок промывают трижды по 100 мл диэтилового эфира. Объединенную органическую фракцию промывают 5 % раствором соляной кислоты, 5 % раствором карбоната натрия, насыщенным раствором хлорида натрия и сушат безводным сульфатом натрия, после чего упаривают в вакууме водоструйного насоса. Получают 37 г (74 %) 1-Тетрагидропиранилокси-8-бромгептана.
