
- •Оглавление
- •2 Электрохимические системы
- •2.1. Определение электрохимической системы
- •2.2. Прохождение электрического тока в электрохимической системе. Законы фарадея
- •2.3. Термодинамически обратимые и необратимые электрохимические системы
- •2.4. Классификация термодинамически обратимых электрохимических систем
- •2.5. Составляющие электрохимической системы
- •2.6. Идеальные и реальные электрохимические системы
- •3 Метод активности
- •3.1. Формальный метод активности льюиса
- •3.2. Расчет коэффициента активности по дебдш и хюккелю
- •3.3. Расчет коэффициента активности по робинсону и стоксу
- •3.4. Эмпирические способы расчета коэффициентов активности
- •4 Ионные равновесии
- •4.1. Ионные равновесия в растворах электролитов
- •4.2. Сольволиз и буферные свойства
- •4.3. Константы образования комплексных ионов
- •4.4. Ступенчатая диссоциация электролитов
- •4.5. Ионные равновесия в растворах электролитов в присутствии твердой фазы
- •5 Процессы переноса в электрохимических системах
- •5.1. Электрическая проводимость
- •5.1.1. Электронная проводимость
- •Ионная проводимость
- •Электрическая проводимость газов
- •5.1.2.2. Электрическая проводимость твердых тел
- •5.1.2.3. Электрическая проводимость расплавленных соединений
- •5.1.2.4. Электрическая проводимость растворов
- •5.1.3. Теории электрической проводимости растворов
- •5.1.3.1. Простая гидродинамическая теория
- •5.1.3.2. Теория дебая – хюккеля – онзагера
- •5.1.3.3. Теория эйринга
- •5.1.3.4. Протолитическая теория электролитической проводимости
- •5.1.3.5. Применение средней ионной активности для расчета проводимости
- •5.2. Диффузия в растворах электролитов
- •5.3. Диффузионный, или жидкостный, потенциал
- •5.4. Конвективный перенос в растворах
- •5.5. Термодиффузия
- •6. Напряжение электрохимических систем
- •6.1. Возникновение напряжения в электрохимической системе
- •6.2. Равновесные потенциалы на границах раздела фаз
- •6.3. Уравнения равновесного электродного потенциала
- •6.4. Влияние температуры на электродный потенциал
- •6.5. Выбор относительной шкалы потенциалов
- •6.6. Электроды сравнения
- •6.7. Правило лютера
- •6.8. Термодинамическое равновесие с растворителем
- •6.9. Расчет напряжения электрохимических систем с помощью потенциалов в относительной шкале
- •6.9.1. Напряжение электрохимических систем с химической реакцией
- •Напряжение электрохимических систем без химической реакции
- •Напряжение электрохимических систем без химической реакции
- •6.10. Методы устранения диффузионного потенциала
- •4,2 Кмоль/м3 20,4 кмоль/м3
- •6.11. Термодинамика электрохимических систем
- •6.12. Ионоселективные электроду
- •6.12.1. Уравнение мембранного потенциала
- •6.12.2. Электроды с твердыми ионитовыми мембранами
- •6.12.3. Электроды с жидкими ионитовыми memбpahaми
- •6.12.4. Измерение напряжения электрохимических систем с ионоселективными электродами
- •7 Двой ной электрический слой
- •Явления адсорбции при образовании двойного электрического слоя
- •Злектрокапиллярные явления на ртути и твердых металлах
- •7.3. Емкость двойного электрического слоя
- •7.3.1. Влияние специфической адсорбции ионов на поверхностное натяжение и емкость двойного электрического слоя
- •7.3.2. Заряжение емкости двойного электрического слоя
- •7.4. Теории строения двойного электрического слоя
- •7.5. Двойной слой на твердых электродах
- •7.6. Двойной слой на электродах в расплавленных и твердых электролитах
- •%(%8 Кинетика электродных процессов
- •8.1. Поляризационные кривые
- •8.2. Перенапряжение электрохимической стадии
- •8.2.1. Уравнение поляризационной кривой без учета специфической адсорбции и ψ’-потенциала
- •Влияние ψ’-потенциала на скорость реакции разряда — ионизации
- •8.2.3. Стандартная константа скорости реакции переноса электрона и стандартная плотность тока обмена
- •8.2.4. Способы определения коэффициентов переноса из поляризационных кривых
- •8.3. Стадийные электродные реакции
- •8.4. Электрохимические реакции, включающие быстрые химические стадии
- •8.5. Определение порядков электрохимических реакций
- •8.6. Безбарьерные и безактивациониые электрохимические реакции
- •8.7. Кинетика реакций при конечных степенях заполнения поверхности
- •9 Диффузионная кинетика
- •9.1. Перенапряжение диффузии
- •9.2. Перенапряжение диффузии с учетом миграции
- •9.3. Поляризационные кривые при замедленной стадии диффузии
- •9.4. Окислительно-восстановительные реакции
- •9.5. Сложные окислительно-восстановительные реакции
- •9.6. Наложение перенапряжения диффузии и замедленного переноса электронов (смешанная кинетика)
- •10 Перенапряжение химической реакции
- •10.1. Перенапряжение, обусловленное предшествующей гомогенной химической реакцией в катодном процессе и последующей химической реакцией в анодном процессе
- •10.2. Общий случай электрохимической реакции с замедленной гомогенной химической стадией
- •10.3. Перенапряжение, обусловленное гетерогенными химическими стадиями
- •10.4. Зависимость плотности тока от концентрации и порядок химической реакции
- •11 Примеры различных механизмов электрохимических реакций
- •11.1. Реакция выделения водорода
- •11.2. Кинетика реакций в расплавах и твердых электролитах
- •12 Кинетика реакций электрохимического выделения металлов
- •12.1. Кинетика реакций выделения металлов на жидких катодах
- •12.2. Кинетика реакций при электроосаждении металлов на твердых электродах
- •12.3. Влияние поверхностно-активных веществ на рост кристаллов
- •12.4. Влияние природы металла и состава раствора на кинетические параметры
- •12.5. Электроосаждение металлов из расплавов
- •12.6. Электрохимическое восстановление оксидов
- •13 Анодное растворение и пассивность металлов
- •13.1. Анодное растворение металлов
- •13.2. Пассивность металлов
- •13.2.1. Теория пассивности
- •13.2.2. Кинетика процесса пассивирования
- •14 Короткозамкнутые электрохимические системы
- •14.1. Общие положения
- •14.2. Электрохимическая коррозия
- •14.2.1. Скорость коррозии металла и коррозионный потенциал
- •14.2.2. Растворение металлов под током в коррозйонноактивных средах
- •14.2.3. Коррозия технических металлов
- •14.2.4. Способы снижения скорости коррозионного процесса
- •14.3. Контактное вытеснение металлов (цементация)
- •14.3.1. Общие положения
- •14.3.2. Кинетика процесса цементации
- •14.3.3. Конечный период цементации
- •15 Параллельные электрохимические реакции
- •15.1. Условия протеканий параллельных реакций
- •15.2. Распределение плотности тока между параллельными реакциями
- •16 Основы методов исследования электрохимических реакций
- •16.1. Общие требования к методам исследования
- •16.2. Электроды, применяемые в кинетических исследованиях
- •16.3. Измерение потенциалов под током
- •16.4. Методы исследования
- •Литература
-
Влияние ψ’-потенциала на скорость реакции разряда — ионизации
ψ’-потенциал, с одной стороны, определяет активность частиц, находящихся непосредственно у поверхности электрода, (aOx s, aRed s)
![]() ;
;
![]()
а с другой — оказывает влияние на энергию активации, изменяя скачок потенциала в плотной части двойного слоя, который становится равным Е – ψ’.
В этих уравнениях aOx и aRed — активности окисляющихся и восстанавливающихся частиц в объеме; zOx и zRed — заряды этих частиц с учетом их знака.
Если ψ’-потенциал имеет одноименный знак с разряжающейся частицей, то активность ионов у поверхности электрода (в состоянии, предшествующем переносу заряда) будет меньше, чем в объеме, при разноименных знаках — больше, чем в объеме. На активность незаряженных частиц у поверхности ψ’-потенциал не влияет.
Уравнения для скоростей катодного и анодного процессов с учетом ψ’-потенциала, впервые полученные А. Н. Фрумкиным, запишутся в виде:
![]()
![]()
При равновесии ψ’ = ψ’p и плотность тока обмена определяется уравнением:
![]()
После логарифмирования этого уравнения и решения его относительно Ер получаем:
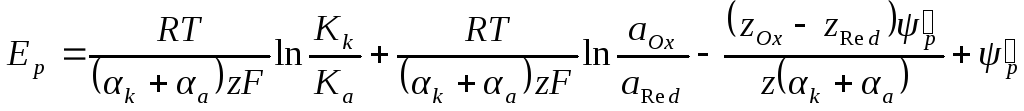
Но так как αk + αa = 1 и zOx – zRed = z, то
![]()
т. е. вновь приходим к формуле Нернста.
Из приведенного вывода следует важное заключение о том, что ψ’p и, следовательно, строение двойного слоя не сказывается на величине равновесного потенциала.
Зависимость плотности тока от перенапряжения с учетом ψ’-потенциала будет иметь вид:
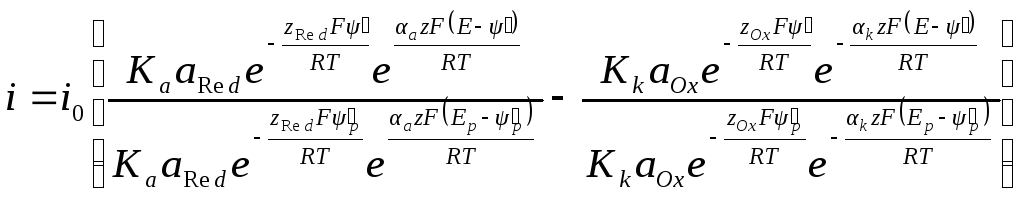
![]()
Величины αaz + zRed и αkz – zOx равны друг другу. В самом деле, решая равенство
αaz + zRed = αkz – zOx
при условии αк + αа = 1 приходим к очевидному выводу:
zOx – zRed = z
Поэтому уравнение поляризационной кривой с учетом ψ’-потен-циала может быть записано в виде:
![]()
или
![]()
Последние уравнения при учете ψ’-потенциала позволяют привести всю поляризационную кривую к потенциалу ψ’p. Однако наиболее удобным является приведение кривой к потенциалу ψ’p = 0. В этом случае уравнения имеют вид:
![]()
или
![]()
Для скоростей катодного и анодного процессов получим:
![]()
![]()
Сравнивая полученные уравнения с уравнениями без учета ψ’-потенциала, можно видеть, что
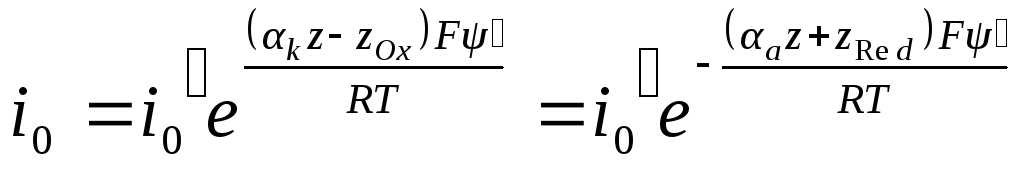
Здесь i0’ — действительная плотность тока обмена в отличие от i0, экспериментально получаемой экстраполяцией поляризационных кривых или другими методами.
Из кинетических уравнений для ik и ia имеем:
![]()
![]()
Следовательно, если в данных конкретных условиях ψ’-потенциал не зависит от потенциала электрода или зависит от него по закону ψ’ = const ± mE, то тафелевские зависимости остаются линейными, ибо dψ’/dE равно нулю либо постоянной величине m. Если же зависимость ψ’ от потенциала имеет более сложный вид, то тафелевские полулогарифмики становятся нелинейными.
При определении из наклона прямолинейных тафелевских зависимостей коэффициентов переноса αk или αa нужно помнить, что из выражений αк = – 2,3RT/zFbk и αа = 2,3RT/zFba правильные значения получаются только в тех случаях, когда ψ’ = 0 или ψ’ ≠f(E). В случае же линейного изменения ψ’ с потенциалом
![]()
![]()
откуда
![]()
![]()
и расчет коэффициентов переноса по формулам, не учитывающим линейный ход ψ’ с потенциалом электрода, может привести при определенных значениях m к искажению величии αк и αа.
Для получения действительной плотности тока обмена и поляризационной кривой с поправкой на ψ’-потенциал применяют исправленные тафелевские зависимости (ИТЗ),
Из полного уравнения поляризационной кривой с учетом ψ’- потенциала получаем:
![]()
или
![]()
Преобразовываем эти уравнения:

или
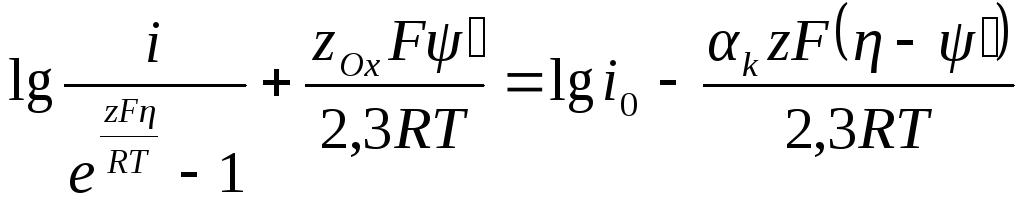
Зная ψ’-потенциал, можно построить поляризационные кривые для истинных скоростей катодного и анодного процессов в координатах: левая часть последних уравнений — (η – ψ’). Полученные таким образом исправленные тафелевские зависимости справедливы во всей области потенциалов и дают действительные значения плотности тока обмена и коэффициентов переноса.
При достаточно высоких перенапряжениях ИТЗ, например, для катодного процесса можно получить в виде:
![]()
Исправленные тафелевские зависимости в соответствии с последним уравнением строят (рис. 8.10) в координатах [lg ik + (zOxFψ’/RT)] — (Е — ψ’); они справедливы в области достаточно высоких перенапряжений. Использование ИТЗ позволило, например, показать (А. Н. Фрумкин, Н. В. Николаева-Федорович), что влияние природы металла на скорость процесса восстановления анионов S2O82– связано с изменением ψ’-потенциала.
Значение ψ’-потенциала рассчитывают на основании теории строения двойного электрического слоя. При этом предполагают, что потенциал на внешней плоскости плотной части двойного слоя (ψ’) равен потенциалу в плоскости, в которой находятся заряженные частицы (ψ0).
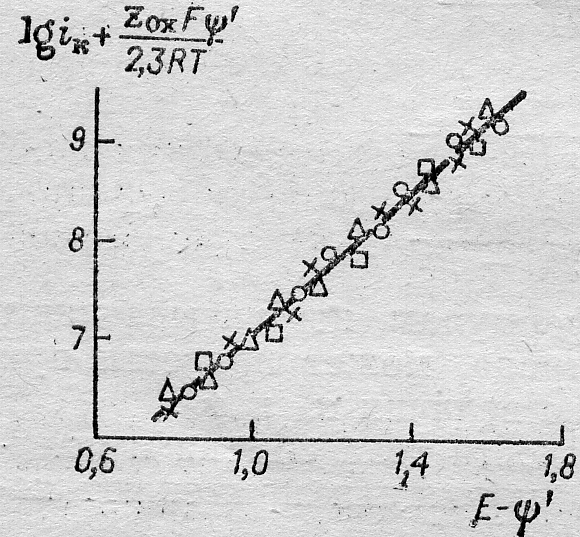
Рис. 8.10. Исправленная тафелевская зависимость при восстановлении анионов S2O82– в растворе NaF концентрации 9∙10–3 кмоль/м3 на электродах из Cd, Pb, Sn, Bi.
