
Лабораторна робота № 4
Тема: Електропровідність розчинів електролітів
Теоретична частина
Електропровідність розчинів електролітів обумовлена наявністю в них іонів - заряджених частинок, які здатні рухатися під дією зовнішнього електричного поля. Здатність розчинів проводити електричний струм кількісно характеризує фізична величина - питома електропровідність.
Питома електропровідність - це електропровідність розчину, розміщеного у вигляді куба з ребром 1м між двома металевими електродами, розташованими на протилежних гранях куба, площа яких 1м . Питома електропровідність обернено пропорційна питомому опорові:
![]() . (4.1)
. (4.1)
Одиниця СІ - См/м (сименс на метр). На практиці використовують См/см. Питома електропровідність, віднесена до одиниці молярної концентрації речовини, називається молярною електропровідністю:
![]() , (4.2)
, (4.2)
де С - молярна концентрація, моль/м3
Одиниця СІ - Смм2 /моль (сименс метр у квадраті на моль). На практиці використовують Смсм2 /моль.
При зменшенні концентрації розчину електроліту молярна електропровідність збільшується і досягає якогось граничного значення, яке називається молярною електропровідністю при нескінченному розведенні. Це пов’язано з тим, що ступінь дисоціації будь-якого електроліту наближається до одиниці, якщо концентрація його розчину наближається до нуля. Молярна електропровідність при нескінченному розведенні - сума рухомостей катіону та аніону.
= + + – . (4.3)
Молярна електропровідність пропорційна ступеню дисоціації електроліту. При нескінченному розведенні = 1, тому = k, звідси:
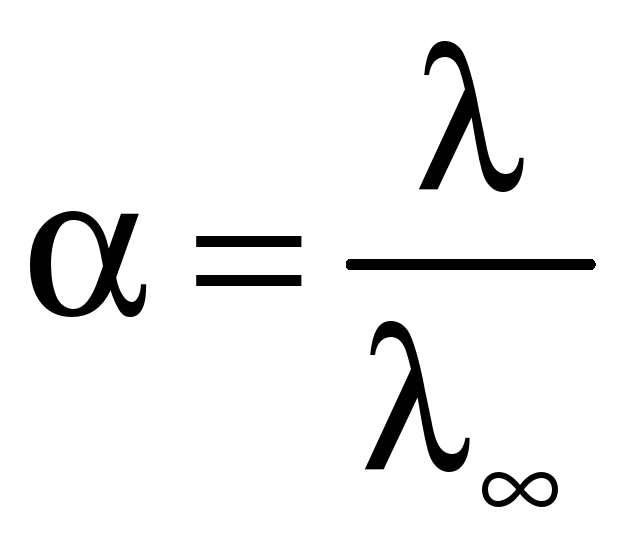 . (4.4)
. (4.4)
Це відношення можна підставити у рівняння Оствальда:
, (4.5)
де K - константа дисоціації електроліту
С - молярна концентрація
- ступінь дисоціації електроліту.
Після цього буде:
![]() . (4.6)
. (4.6)
Вимірювання
електропровідності проводиться у
спеціальному посуді з кварцу, скла або
фторопласту. Електроди виготовляють з
платини та покривають платиновою черню
(платинують), це робиться для досягнення
більшої поверхні контакту з розчином.
Щоб виключити протікання фарадеївських
процесів при вимірюванні електропровідності,
використовують змінний струм частотою
50-2000 Гц при напрузі 5-50 мВ.
Вимірювальна посудина вмикається в
одне з пліч м істка
змінного струму. Схема наведена на
рис.4.1.
істка
змінного струму. Схема наведена на
рис.4.1.
Перед вимірюванням посудина обполіскується досліджуваним розчином, потім заповнюється таким чином, щоб рівень розчину був вище електродів, і міст урівноважується підбором опору на магазині. У момент рівноваги світний еліпс на екрані нуль-індикатора повинен зайняти горизонтальне положення. Якщо цього не можна досягнути за допомогою регулювання магазину, тоді міст урівноважується за допомогою реохорду, а вимірюваний опір буде:
![]() . (4.7)
. (4.7)
Для того, щоб перерахувати виміряний опір в питому електропровідність, необхідно ще визначити константу посудини, заповнюючи її стандартним розчином з відомою питомою електропровідністю ( додаток, табл.2). За визначеним значенням опору розраховують константу посудини:
kп = R0,02МKCl , (4.8)
де kп - константа посудини, см
R - опір, Ом
- питома електропровідність, См/см.
Питому електропровідність досліджуваних розчинів розраховують використовуючи отримані значення константи kп.
![]() . (4.9)
. (4.9)
