
Практична частина
1. Визначення константи дисоціації слабкого електроліту
З вихідного розчину слабкого електроліту концентрацією 0,1 моль/л, розведенням приготувати розчини з концентрацією 0,05; 0,025; 0,0125; 0,00625 моль/л.
Для кожної концентрації виміряти опір та розрахувати питому електропровідність, ступінь та константу дисоціації.
Таблиця 4.1
|
С, моль/л |
R, Ом |
χ, См/см |
, См см2/моль |
|
|
|
0,1 |
|
|
|
|
|
|
0,05 |
|
|
|
|
|
|
0,025 |
|
|
|
|
|
|
0,0125 |
|
|
|
|
|
|
0,00625 |
|
|
|
|
|
Рис.4.2 – Графік залежності - С Рис.4.3 – Графік залежності χ - С
Рис.4.4 – Графік залежності - 1/С
Визначаємо константу посудини: t0оточ.сер. = 0С; χKCl ст.. = (См/см);
R = Ом;
k = χKCl ст. R = =
1) Питома електропровідність розчинів:
![]() ,
,
 См/см;
См/см;
 См/см;
См/см;
![]() См/см;
См/см;  См/см;
См/см;
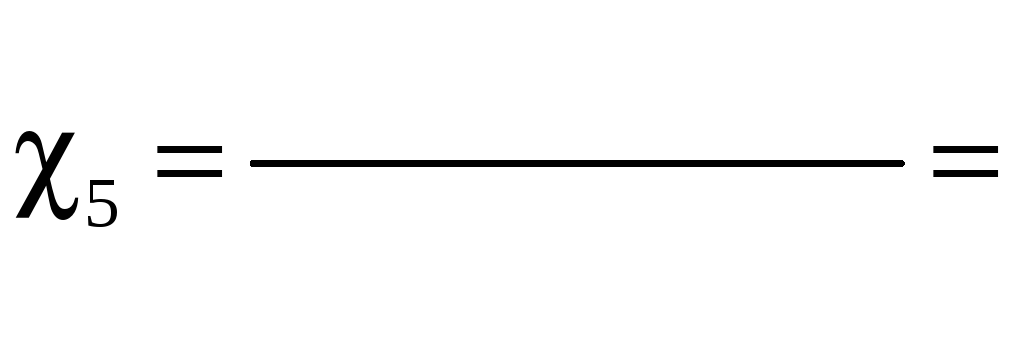 См/см.
См/см.
2) Молярна електропровідність розчинів:
![]() ·1000,
·1000,
![]() См
см2/моль;
См
см2/моль;
![]() См
см2/моль;
См
см2/моль;
![]() См
см2/моль;
См
см2/моль;
![]() См
см2/моль;
См
см2/моль;
![]() См
см2/моль
См
см2/моль
3) Молярна електропровідність при нескінченому розведенні:
= + + - = + =
Ступінь дисоціації:
![]() ,
,
![]()
![]()
![]()
![]()
![]()
4) Константа дисоціації електроліту:
![]()



![]()

2. Визначення добутку розчинності важкорозчинної солі
У насиченому розчині важкорозчинної солі концентрація її дуже невелика, і тому молярна електропровідність практично дорівнює молярній електропровідності при нескінченному розведенні. У такому випадку, беручи до уваги формулу (4.3), можна записати:
 . (4.10)
. (4.10)
Якщо ще брати до уваги питому електропровідність води, формула може бути записана у такому вигляді:
 . (4.11)
. (4.11)
Для бінарних електролітів: Скат. = Сан. = Ссолі.
Тому, ДР = С2 . (4.12)
RH2O
= Ом;
![]() ; χH2O
=
См/см;
; χH2O
=
См/см;
RBaCrO4
= Ом;
![]() ; χBaCrO4
=
См/см;
; χBaCrO4
=
См/см;
= + + - = + = (Смсм2/моль);
![]()
![]() ;
;
![]()
![]() ;
;
![]() ДР
= С2
= (0,001
)2
=
ДР
= С2
= (0,001
)2
=
ДРBaCrO4 при 25 0С дорівнює 1,2·10-10.
![]()
Висновок:
