
- •Вопрос № 28
- •Факторы, влияющие на прочность водородной связи
- •Влияние водородной связи на физические свойства молекул
- •Вопрос № 29
- •Вопрос № 30
- •Вопрос № 32
- •Вопрос № 33
- •Применение в химии
- •Вопрос № 37
- •Основные принципы катализа
- •Вопрос № 38
- •Вопрос № 39
- •Константа равновесия, величина, определяющая для данной хим. Р-ции соотношение между термодинамич. Активностями исходных в-в и продуктов в состоянии хим. Равновесия.
- •Вопрос № 41
- •Вопрос № 42
- •Вопрос № 43
- •Вопрос № 45
- •Суть процесса
- •Вопрос № 46 Произведение растворимости (пр) – это произведение равновесных концентраций ионов малорастворимого электролита.
- •Вопрос № 47 Реакции ионного обмена
- •Вопрос № 48
- •Вопрос № 49 Электролитическая диссоциация воды
- •Вывод значения pH
- •Вопрос № 50 Гидролиз солей – это реакция обменного взаимодействия соли с н2о, в результате чего образуется слабый электролит.
- •Вопрос № 51
- •Вопрос № 52
- •Вопрос № 54
- •Вопрос № 54
Вопрос № 30
Тепловые эффекты химических реакций. Химическая реакция заключается в разрыве одних и образовании других связей, поэтому она сопровождается выделением или поглощением энергии в виде теплоты, света, работы расширения образовавшихся газов.
По признаку выделения или поглощения теплоты реакции делятся на экзотермические и эндотермические.
Количество теплоты, которое выделяется или поглощается в результате реакций между определенными количествами реагентов, называют тепловым эффектом химической реакции и обычно обозначают символом Q.
Наряду с тепловым эффектом термохимические процессы очень часто характеризуют разностью энтальпий ∆H продуктов реакции и исходных веществ.
Энтальпия Н — это определенное свойство вещества, оно является мерой энергии, накапливаемой веществом при его образовании.
При экзотермических реакциях, когда тепло выделяется, ∆Н отрицательно. При эндотермических реакциях (тепло поглощается) и ∆H положительно.
Термохимические уравнения. На первых этапах изучения химии вы часто пользовались равным по абсолютной величине и противоположным по знаку обозначением, например: H2 + Cl2 = 2 HCl + Q
где Q — количество выделенной теплоты.
В справочных таблицах обычно приводят не значения величины Q, а значения величины ∆H, измеренные при определенных условиях (чаще всего при 298 К); их обозначают ∆ H0.
Теплотой образования соединения называется количество теплоты, которое выделяется или поглощается при образовании одного моля химического соединения из простых веществ при стандартных условиях (р = 105 Па, T = 298 К). Она измеряется в кДж/моль. Согласно этому определению, теплота образования простого вещества при стандартных условиях равна О.
Изменение энтальпии ∆Н зависит от давления и температуры.
Вопрос № 32
Согласно II началу (закону) термодинамики:
"Все процессы в изолированных системах происходят в направлении, увеличения беспорядка в системе, т. е. роста энтропии ( ∆S > 0)".
При условии ∆S = 0 единственной движущей силой процесса является убыль энтальпии - энтальпийный фактор - ∆ Н.
Из рассмотренного следует, что в химических процессах одновременно действуют два прямо противоположных фактора - ∆Н и T∆S.
Функцией состояния, одновременно отражающей влияние обоих этих факторов на направление протекания химических процессов, служит энергия Гиббса:
∆ G = ∆H - T∆ S (4)
При постоянстве температуры и давления химические реакции могут самопроизвольно протекать только в таком направлении, при котором энергия Гиббса системы уменьшается ((∆ G< 0) (вторая формулировка II закона термодинамики.)
Изменение энергии Гиббса (D Gх.р.) в результате химической реакции можно найти по стандартным энергиям Гиббса образования веществ.
∆ G0х.р. = a nпрод· D G0f прод - a nисх· D G0f исх (5)
При этом D G0f простых веществ так же, как D Н0f и D U0f, равны нулю.
Поведение химической реакции при изменении температуры можно предсказать, путем анализа уравнение ∆ G = ∆H - T∆S
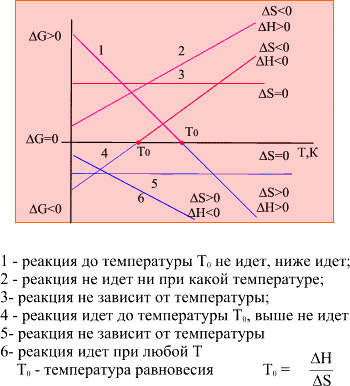
Вопрос № 33
Энергией Гиббса называют термодинамический потенциал следующего вида: G = U + PV – TS,
где U — внутренняя энергия, P — давление, V — объем, T — абсолютная температура, S — энтропия. Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т.д.)
Дифференциал энергии Гиббса для системы с постоянным числом частиц: dG = -SdT + VdP
Для системы с переменным числом частиц этот дифференциал записывается так: dG = -SdT + VdP + µdN
Здесь μ — химический потенциал, который можно определить как энергию, которую необходимо затратить, чтобы добавить в систему ещё одну частицу.
Можно показать, что химический потенциал есть отношение энергии Гиббса к числу частиц в системе: µ=G/N
