
Межпредметні зв'язки теми «Електромагнітне поле»
Таблиця 3.
|
Провідні положення теми |
Знання, використовувані з інших шкільних дисциплін для розкриття провідних положень теми |
|
1. Доказ із погляду діалектико-матеріалістичної методології існування електромагнітних полів |
ОБЩЕСТВОВЕДЕНИЕ: філософські подання про світ і його пізнання. ІСТОРІЯ Й ЛІТЕРАТУРА: соціально-історична обумовленість розвитку науки; історія боротьби науки й релігії. МАТЕМАТИКА: побудова лінії векторів, негативні й позитивні числа |
|
2. Енергія електромагнітних полів як результат взаємодії заряджених часток |
ХІМІЯ: перетворення хімічних елементів; генетичний зв'язок між класами хімічних сполук АСТРОНОМІЯ: будова небесних тіл, процеси Сонячної активності |
|
3. Електромагнітні властивості речовини як основа їхнього застосування в техніку |
ХІМІЯ: властивості хімічних елементів, Періодична система Д. И. Менделєєва БІОЛОГІЯ: електричні явища в нервових процесах людини ТЕХНОЛОГІЯ: використання різних приладів при створенні навчальних проектів |
Аналізуючи даної таблиці межпредметних зв'язків можна побачити, що самі зв'язки в них дані у своєрідному статичному стані (статична сторона межпредметних зв'язків у навчальній темі визначається змістом навчального матеріалу). Однак у реальному навчальному процесі межпредметні зв'язки розглядаються в динаміку (динамічна сторона межпредметних зв'язків у навчальній темі визначається процесом навчання) і в органічній єдності із внутріпредметними й внутрікурсовими зв'язками - у цьому й полягає якісна відмінність складеної дидактичної моделі межпредметних зв'язків від процесу оволодіння ними школярами. Аналіз таблиць також може показати, що опорні межпредметних знання часто носять «стиковий», синтезований характер. Особливо насичені ними останні теми. Це й зрозуміло, оскільки багато понять до кінця навчального року усвідомлюються й застосовуються старшокласниками на високому рівні узагальнення, у згорнутому виді.
Таким чином, таблично текстовий аналіз змісту розглянутих навчальних тим показав, що вони можуть бути вивчені на широкої межпредметній основі з метою наукового, системного, доступного й всебічного розкриття їхніх провідних положень і створення більше цілісної системи знань по кожній темі, а через сукупність тим і по навчальному предметі в цілому. Провідні ідеї й положення навчальних дисциплін виконують при цьому функцію своєрідних «стрижнів, що стикують,».
Розділ I I. МЕЖПРЕДМЕТНІ ЗВ'ЯЗКИ В ШКФ ІЗ ХІМІЄЮ,
2.1. Зв'язок фізики з хімією.
В основі молекулярної фізики лежить подання про атомно-молекулярну будову матерії, що дозволяє пояснити макроскопічні властивості речовини в різних агрегатних станах і закономірності переходу речовин з одного стану в інше. Хімія - це наука, що досліджує сполуку, будову й перетворення одних речовин в інші. Інакше кажучи й у молекулярній фізиці, і хімії за основу взяті будова й властивості речовини, хоча в хімії переважно увага приділяється впливу сполуки «будови речовини на його хімічні властивості, а в молекулярній фізиці - на фізичні властивості речовини.
У зв'язку із цим виникає необхідність розгляду питання взаємозв'язку молекулярної фізики й хімії в курсі середньої школи.
При вивченні молекулярної фізики взаємозв'язок її з хімією проявляється у двох головних напрямках. Перше з них полягають у використанні знань учнів, отриманих ними в процесі вивчення хімії як матеріал для доказу основних положень молекулярної фізики. Другий напрямок полягає в доповненні знань про молекулярну фізику рядом фактичних відомостей, досліджуваних на уроках хімії.
Характерно, що по нині діючих програмах підручникам, починаючи з VII (у хімії - з VIII) і кінчаючи XI класом, атомно-молекулярне навчання одержує свій розвиток, як у фізику, так й у хімії, при цьому відповідний матеріал у підручниках базується на раніше розглянутих відомостях тієї або іншої дисципліни. Тому знання викладачем змісту навчального матеріалу й практичних навичок учнів, отриманих ними при вивченні суміжної дисципліни, є одним з головних факторів, що дозволяють забезпечити міцне засвоєння тієї або іншої теми й курка в цілому.
Важливою ланкою в організації межпредметного зв'язку є наочне зіставлення взаємозалежних тим із вказівкою часу їхнього проходження, глибина вивчення питань у суміжних курсах і переліком демонстрацій, практичних лабораторних робіт, передбачених програмами цих предметів.
Практика роботи показала, що найбільш зручним щодо цього є план межпредметного зв'язку, складений нами по темі «Молекулярна фізика», досліджуване в X класі по нових програмах і новому навчальному посібнику.
|
Фізика |
Хімія |
||||
|
Час вивчення |
Програмні питання |
Час вивчення |
Програмні питання |
||
|
X‑ I |
I. Теплові явища Температура. Теплова рівновага. Рівняння стану. Газові закони. Закон Бойля-Мариотта. Закон Гей-Люссака Закон Авогадро Рівняння стану ідеального газу Кількість переданої теплоти. Теплоємність. Внутрішня енергія. Закон збереження енергії в механічних і теплових процесах Теплові двигуни |
|
|
||
|
VIII‑ I |
Реакції экзо - і ендотермічні |
||||
|
VIII‑ II |
Кисень і його фізичні властивості. Повітря. Сполука повітря. Інертні гази, їхньої властивості, а застосування Горіння в повітрі простих і складних речовин |
||||
|
VIII‑ II |
Водень Фізичні властивості водню. |
||||
|
|
Теплові явища при розчиненні |
||||
|
VIII‑ III |
Грам-атом і грам-молекула. Об'єм г^-молячи газу при нормальних умовах Закон Авогадро. Тепловий ефект хімічної реакції |
||||
|
IX‑ III |
5Основні види палива. Способи спалювання твердого рідкого й газоподібного палива. Роль хімії в енергетику |
||||
|
X‑ I |
II. Основи молекулярно-кінетичної теорії. Будова газоподібне, рідке й твердих тел. Основне рівняння молекулярно-кінетичної теорії газів. Температура - міра середньої кінетичної енергії молекул. Броуновское рух. Взаємодія атомів і молекул у речовині. |
|
|||
|
VIII‑ I |
Молекули й атоми. Атомно-молекулярне навчання. Роль М. В. Ломоносова й Д. Дальтона в створенні основ, атомно-молекулярного навчання. Молекулярна маса. |
||||
|
VIII‑ II |
Іонний зв'язок. Ковалентний зв'язок. Полярний і неполярний ковалентний зв'язок. Значення періодичного закону Д. И. Менделєєва для науково – матеріалістичного світогляду й розвитку науки й техніки. |
||||
|
X‑ I |
Теорія хімічної будови. |
||||
|
X‑ I |
III. Взаємні перетворення рідин і газів Сили взаємодії молекул. Випар рідин. Кипіння. Залежність температури кипіння від тиску. Вологість. |
|
|||
|
VIII‑ II |
Іонний зв'язок, механізм її утворення. Ковалентний зв'язок, механізм її утворення. Полярний і неполярний ковалентний зв'язок. |
||||
|
VIII‑ II |
Вода і її властивості. |
||||
|
IX‑ III |
Адсорбція й абсорбція. |
||||
|
X‑ I |
IV. Властивості рідин і твердих тіл Особливості рідкого стану. Поверхневий натяг. Капілярні явища. Змочування. Кристали. Анізотропія кристалів. Полікристали. Аморфні речовини і їхні властивості |
|
|||
|
VIII‑ II |
Іонний зв'язок. Ковалентний зв'язок. Полярний і неполярний ковалентний зв'язок. Значення періодичного закону Д. И. Менделєєва для науково – матеріалістичного світогляду й розвитку науки й техніки. |
||||
|
VIII‑ III |
Вода і її властивості. |
||||
|
VIII‑ IV |
Види хімічного зв'язку. Іонні, атомні й молекулярні кристали. |
||||
|
IX‑ III |
Вуглець. Аллотропия вуглецю. Вугілля. Адсорбція. |
||||
|
IX‑ III |
Металевий зв'язок. Кристалічна будова металів. Сплави |
||||
|
IX‑ IV |
Алюміній і залізо, їхні сплави й застосування. |
||||
|
X‑ I |
Теорія хімічної будови речовини |
||||
Варто помітити, що такого роду план не в змозі повністю задовольнити вимоги реалізації межпредметного зв'язку у викладанні фізики й хімії, тому що він не відбиває особливостей викладів взаємозалежних тим у підручниках й інших навчальних посібниках, не включає питань комплексного характеру, зовсім обходить питання межпредметного зв'язку при рішенні завдань у суміжних курсах.
Аналіз нині діючих задачників по фізиці й хімії показав, що є цілий ряд завдань і вправ, що розвивають у подання, що вчиться, однаково коштовні як для молекулярної фізики, так і для хімії, і що здійснення межпредметного зв'язку при рішенні дозволить у значній мірі доповнить, і поглибити взаємозалежні розділи суміжний курсів.
Попереднє знайомство вчителя фізики зі змістом використовуваних завдань суміжного курсу дає в одних випадках багатий ілюстративний матеріал для роз'яснення сутності фізико-хімічних процесів, а в інші - дозволяє при викладі певної теми повністю базуватися на цьому матеріалі.
Перш ніж приступитися до вивчення молекулярної фізики, варто мати на увазі, що цій темі передує ряд розділів фізики й хімії, що описують різні сторони будови речовини й достатню теоретичну й експериментальну основу для викладу молекулярно-кінетичної теорії на більше високому рівні.
З огляду на розкиданість пропедевтичного матеріалу молекулярної фізики суміжних курсах за часом вивчення в VIII‑ X класах, варто уважно продумати методику його повторення й систематизації для того, щоб учителі, що вчаться в момент посилання, на відомі факти могли швидко відтворити їх у пам'яті й установити взаємозв'язок з досліджуваною темою.
Перед вивченням основних положень кінетичної теорій газів ми готовили учнів до сприйняття цієї теми. Всьому класу пропонувалося повторити ті розділи суміжних курсів, які могли бути використані при викладі дійсної теми.
Так, по фізиці потрібно було повторити наступні питання: початкові відомості про будову речовини, хаотичне (теплове) рух молекул і внутрішня енергія (з розділу «Теплові явища»), вага повітря й атмосферний тиск, будова атома; з хімії: молекули й атоми, атомно-молекулярне навчання, роль М.В. Ломоносова й Д. Дальтона в створенні основ атомно^-молекулярного навчанні атомна й молекулярна вага; кисень і водень, їхня фізична властивості; сполука повітря; грам-атом, грам-молекула й закон Авогадро.
Практика показала, що не можна обмежуватися одним тільки повторенням, необхідно узагальнювати й систематизувати накопичені відомості про атомно-молекулярну структуру речовини й характері руху часток у різних агрегатних станах.
Для цього деяким (більше підготовленим) учням було запропоновано підготувати 7‑ 12 хвилинні повідомлення по окремих темах суміжних курсів, а інша група учнів готовила експериментальне обґрунтування вивчені теоретичним питанням. Нами були дані завдання зробити повідомлення по наступних розділах:
а) роль М.В. Ломоносова й Д. Дальтона в створенні основ атомно-молекулярного навчання;
б) досвідчене обґрунтування будови речовини з атомів і молекул;
в) факти, що підтверджують безперервність руху й взаємодія часток, з яких складається речовина в різних агрегатних станах;
г) повітря, його сполука й фізичні властивості;
д) сталість сполуки складних речовин і встановлення атомарної сполуки молекул;
е) закон Авогадро й способи визначення атомних і молекулярних мас.
Крім цього, класу пропонувалося вибірково вирішити кілька нескладних завдань із хімії, підібраних таким чином, щоб учні могли закріпити отримані по темі знання із суміжних курсів. Рішення одних завдань вимагало знання основних положень молекулярно-кінетичної теорії, інші закріплювали поняття: «атомна маса», «молекулярна маса», «грам-атом», «моль» і методи їхнього знаходження, а треті являли собою завдання на застосування закону Авогадро для визначення маси, об'єму й молекулярної маси газу при нормальних умовах.
Провівши в такий спосіб підготовку учнів до сприйняття газових законів і молекулярно-кінетичної теорії, ми приступилися до вивчення цих питань. Зроблені учнями повідомлення узагальнюючого характеру послужили гарним введенням до досліджуваної теми.
Використання знань учнів з хімії при викладі корінних питань молекулярно-кінетичної теорії дало можливість не тільки зробити доступними сприйняттю багато питань курсу фізики, але й значно доповнити частина з них. Знання будови одного-, двох- і багатоатомних молекул дозволило з'ясувати характер руху цих молекул і внести виправлення, що пояснює залежність фізичні властивості від атомної сполуки його молекул.
Скориставшись методами визначення сполуки повітря й законом Авогадро, можна довести справедливість закону Дальтона. З хімії відомо, що повітря складається із сумішей газів, причому по об'єму основна частка доводиться на азот (78%) і кисень (21%).
Всі гази, що заповнюють певний об'єм, розподілені в ньому рівномірно. Тому загальний тиск газу на стінки, посудини є наслідком ударів молекул газової суміші. Очевидно, послідовне видалення компонентів суміші повинне супроводжуватися зменшенням тиску в посудині. Скориставшись досвідом визначення сполуки повітря методом спалювання червоного фосфору в посудині з'єднаному з манометром, можна визначити, яку частину, об'єму повітря в посудині займав кисень, і який тиск він створював у даній посудині, тобто парціальний тиск кисню.
Давши формулювання закону Дальтона (це зручніше зробити після вивчення закону Авогадро) можна його пояснити на основі молекулярної теорії, взявши за основу закон, Авогадро. Тому що тиск газу при незмінній температурі залежить тільки від числа молекул в одиниці об'єму, то при видаленні частини молекул з даного об'єму тиск газу повинне зменшитися. Але таке ж зменшення тиску може бути отримане за рахунок видалення такого ж числа молекул іншого, газу, що підтверджується законом Авогадро. У цьому, властиво, і укладена суть зв'язку закону Авогадро із законом Дальтона.
Незалежно від способу висновку основного рівняння кінетичної теорії газів і рівняння Менделеева-Клапейрона, учнем необхідно добре знати закон Авогадро, число Авогадро, мати подання про молекулярну масу й методи його визначення, знати співвідношення між об'ємом, масою й молекулярною вагою газу при нормальних умовах. Попереднє повторення цих понять деякою мірою полегшить висновок основних співвідношення молекулярної фізики.
Використання цих даних з хімії й фізики дозволяє розкрити фізичну сутність універсальної газової постійної (R), постійної Больцмана (ДО), значно спростити висновок основного рівняння кінетичної теорія газу, формулу середньої квадратичної швидкості руху молекул газу виведеної з основного рівняння кінетичної теорії газу.
У темі «Основні положення молекулярно-кінетичної теорії» при вивченні методів визначення маси й розмірів молекул потрібно повніше опиратися на знання, отримані учнями в курсі хімії. Це дозволяє скоротити час, передбачений на вивчення цих питань програмою по фізиці й відповідно збільшити час на вивчення принципово нових питань і рішення завдань творчого характеру.
При вивченні в X класі взаємодії атомів і молекул, а також фізичних властивостей твердих тіл і рідин варто приділити особлива увага видам хімічного зв'язку, відомим учнем з курсу хімії VIII класі, тому що цей матеріал надалі використається при вивченні провідників і діелектриків, електричного струму в газах, рідинах і металах при вивченні електричних властивостей напівпровідників й інших питань курсу фізики.
Причому виклад видів хімічного зв'язку на уроках фізики повинне бути не простим повторенням вивченого в хімії, а певним доповненням і поглибленням знань учнів у цій області.
Практика роботи показала, що поняття Ван-дер-Ваальсовой, іонного й металевого зв'язку можна дати учень VIII класу при вивченні взаємодії молекул і на основі отриманих подань про види зв'язку (включаючи й ковалентний зв'язки, відому учнем з курсу хімії) розкрити зміст розділів, що стосується будови й властивостей твердого тіла й рідини. До цього часу учнем уже відома будова атомів елементів малих і більших періодів, електростатична взаємодія однойменних і різнойменних зарядів, тому пояснення видів зв'язку на основі сучасних подань про будову атома не викликає істотних утруднень.
Для уточнення поняття про енергії взаємодії молекул бажано повернутися до питання про іонний зв'язок при вивченні закону Кулона в IX класі. Сила зв'язку може бути визначена по формулі закону Кулона:
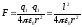
де l – заряд електрона.
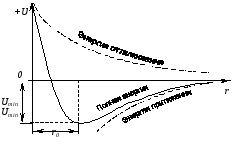
При зменшенні відстані r між іонами сила взаємодії зростає по абсолютній величині, і при цьому повинна також зростати енергія притягання, але при певне значенні r починають діяти сили відштовхування, причина яких полягає в електростатичній взаємодії наступних електронних оболонок атомів. Ці сили швидко зростають, і при деякому значенні r0 установлюється рівноважний стан іонів. Енергія взаємодії в цьому випадку мінімальна, що відповідає стійкому стану молекули, що утворилася. Це легко пояснюється графіком на малюнку.
На основі поняття про іонний зв'язок можна познайомити учнів з будовою іонних кристалів, пояснити їхні фізичні властивості.
Досить глибоке пояснення причин виникнення ковалентного зв'язку є важким завданням, тому що для цього необхідно знання квантової теорії будови атома. Однак, з огляду на важливість цього виду зв'язку, доцільно використати наявні в підручнику хімії VIII класу пояснення ковалентного зв'язку на основі моделей електронних хмар в атомах. Тут же в параграфі «Атомні й молекулярні решітки» викладач фізики знайде коштовний ілюстративний матеріал для пояснення фізичних властивостей речовин з атомними кристалічними решітками. Крім названих видів зв'язку, бажано познайомити учнів, хоча б загалом, з металевим зв'язком.
У металевих тілах існує зв'язок, відмінна від іонної й ковалентної, що одержала назва металевої. Учнем відомо, що валентні електрони в атомах металу пов'язані з ядром відносно слабко. А атоми металу у твердому стані тіла розташовуються настільки близько, що валентні електрони здобувають здатність залишати атом і вільно переміщатися, розподіляючись рівномірно по всьому об'ємі металу. позитивні іони, Що Утворилися, металу стягаються блукаючими між ними електронами.
На закінчення корисно познайомити учнів з таблицею залежності фізичних властивостей речовини від типу кристалічної решітки.
Таблиця 2
|
Тип кристала |
Властивості речовини |
Структурні одиниці |
Тип зв'язку |
Приклади |
|
Молекулярні кристали |
М'які, низька температура плавлення, розчинні в органічних рідинах. |
Молекули |
Ван-дер-Ваальсовы сили |
Йод, лід |
|
Металеві |
Тверді, висока температура плавлення, тягучі, ковкі, висока электротеплопроводность, металевий блиск, розчинні тільки в рідких металах. |
Іони металів |
Металевий зв'язок |
Мідь й інші метали |
|
Іонні кристали |
Тверда й пружні, висока температура плавлення, розчинні в іонізуючих розчинниках типу води або нерозчинні. Розчини або розплави проводять електричний струм |
Позитивні й негативні іони |
Електростатичний іонний зв'язок |
Хлористий натрій |
|
Атомні кристали |
Тверді, висока температура плавленая, нерозчинні практично ні в яких розчинниках |
Атоми |
Ковалентний зв'язок |
Алмаз, карборунд |
Виклад видів хімічного зв'язку на уроках фізики на основі відомостей, відомих учнем з хімії, дозволяє значно розширити знання учнів про внутрішню будову фізичного тіла, пояснити залежність фізична властивостей від його структури.
Крім використання даних хімії на уроках фізики ми також уводимо таку форму межъядерной зв'язку, при якій учитель хімії звертає особливу увагу на ті питання свого курсу, які мають безпосереднє відношення до молекулярної фізики. Завдання полягало в тім, щоб на уроках хімії була відбита фізична сутність ряду передбачених програмою фізико-хімічних процесів. Не говорячи про значення такого взаємозв'язку для курсу хімії вона дозволяє у відомій мері доповнити знання учнів по молекулярній фізиці.
Так, наприклад, проведення різноманітних хіміко-технологічних процесів пов'язане з переходом речовини з одного агрегатного стану в інше. Тому багато розділів хімії можуть сприяти розширенню й поглибленню знань учнів по молекулярній фізиці роз'ясненням механізму агрегатних перетворень, установленням впливу примесных компонентів у сумішах на крапку кипіння, плавлення й температуру кристалізації різних речовин і т.п.
Такі теми, як «Метали», «Теорія хімічної будови органічних сполук», «Будова й властивості високомолекулярних сполук» й ін. сприяють розвитку подань про внутрішню структуру твердого тіла й характеризують його фізичні властивості на основі атомно-молекулярної теорії.
Таким чином, наведені приклади взаємозв'язку фізики й хімії при викладі основ молекулярної фізики переконливо демонструють однобічний зв'язок, застосовуваний для посилення глибини викладу й доказовості окремих розділів молекулярної фізики, і зв'язок, що доповнює, що характеризує можливості розширення кругозору учнів по молекулярній фізиці при вивченні взаємозалежних з нею тим хімії.
