
- •Раздел 1
- •Глава 1
- •1.1. Предмет аналитической химии
- •1.2. Принцип, метод и методика анализа
- •1.3. Виды анализа
- •1.4. Методы аналитической химии
- •Глава 2
- •Первая аналитическая группа катионов
- •Вторая аналитическая группа катионов
- •Систематический анализ смеси Cl-, Br-, I- - ионов
- •Глава 3
- •3.2. Активность и коэффициент активности
- •Активность (a) - такая концентрация вещества в растворе, при использовании которой свойства данного раствора могут быть описаны теми же уравнениями, что и свойства идеального раствора.
- •0,100 Моль/л
- •0,100 Моль/л
- •3.4. Виды констант химического равновесия, используемые в аналитической химии в аналитической химии используются
- •3.5. Общие принципы расчёта состава равновесных систем
- •Уравнение материального баланса основано на том, что число атомов определённого элемента (или групп атомов определённого вида) в изолированной системе остаётся неизменным.
- •Глава 4
- •4.1. Важнейшие теории кислот и оснований
- •4.3. Влияние растворителя на кислотно-основные свойства растворённого вещества
- •4.4. Нивелирующее и дифференцирующее действие растворителя. Сильные и слабые кислоты и основания
- •Растворы амфолитов
- •4.6. Расчёт состава равновесных смесей протолитов при заданном значении рН
- •4.7. Кислотно-основные буферные растворы
- •Глава 5
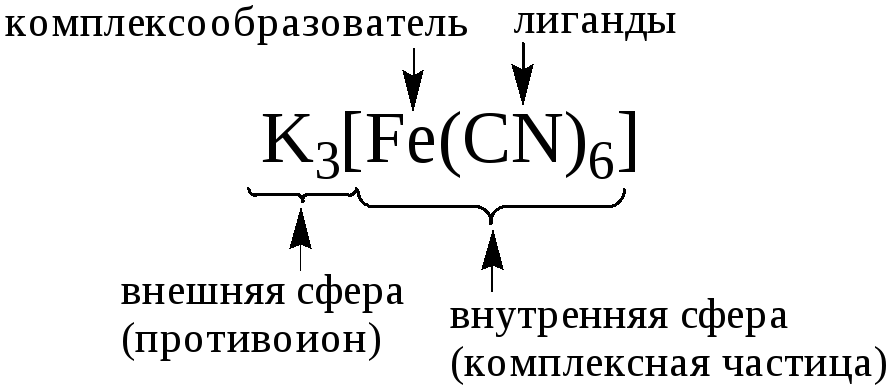
- •5.1. Понятие о комплексном соединении
- •5.2. Классификация комплексных соединений
- •5.3. Равновесия в растворах комплексных соединений
- •Природа комплексообразователя и лигандов
- •Концентрация реагентов
- •Ионная сила
- •Температура
- •Побочные реакции
- •Глава 6
- •6.1. Произведение растворимости малорастворимого электролита
- •6.2. Растворимость
- •7,210-4 Моль/л
- •6.3. Влияние различных факторов на растворимость Природа растворяемого вещества и растворителя
- •Температура
- •Ионная сила
- •Общий (одноименный) ион
- •Побочные реакции
- •6.4. Общие принципы растворения осадков малорастворимых электролитов
- •Глава 7
- •Электродные потенциалы
- •Уравнение Нернста
- •7.3. Влияние различных факторов на протекание окислительно-восстановительных реакций Температура
- •Посторонние ионы
- •Влияние рН
- •Образование малорастворимых соединений
- •7.4. Расчёт различных констант с использованием электродного потенциала
- •Глава 8
- •8.1. Отбор пробы
- •8.2. Разложение пробы
- •Глава 9
- •9.2. Жидкость - жидкостная экстракция
- •9.2.2. Экстракционные системы и экстрагенты
- •9.2.4. Влияние различных факторов на процесс экстракции
- •Слабые основания
- •Амфолиты
- •Присутствие сильных электролитов
- •9.2.5 Способы осуществления экстракции
- •9.2.6. Применение экстракции
- •Глава 10
- •10.1. Приближённые вычисления и значащие цифры
- •Сложение и вычитание
- •Деление и умножение
- •Другие операции
- •10.2. Понятие об аналитическом сигнале
- •10.3. Методы расчёта концентрации вещества по величине аналитического сигнала
- •Метод градуировочного графика
- •Метод стандартов
- •10.4. Неопределённость и погрешности измерений
- •10.5. Некоторые основные положения математической статистики, используемые в аналитической химии
- •10.7. Основные характеристики методики анализа
- •Воспроизводимость
- •Правильность
Глава 5
5.1. Понятие о комплексном соединении
Чаще всего комплексом называют частицу, образованную в результате донорно-акцепторного взаимодействия атома (иона), называемого центральным атомом (ионом), или комплексообразователем, и заряженных или нейтральных частиц (лигандов). Комплексообразователь и лиганды должны быть способны к самостоятельному существованию в среде, где происходит реакция комплексообразования.
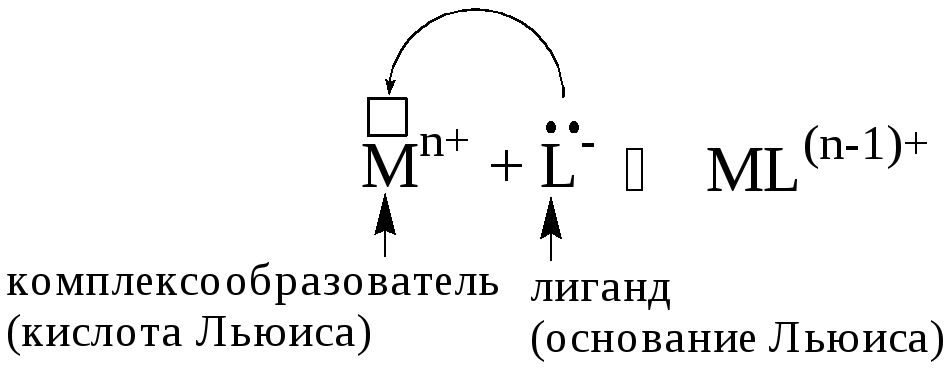
Реакцию комплексообразования можно рассматривать как реакцию взаимодействия кислоты и основания Льюиса.
Количественной характеристикой способности комплексообразователя и лиганда участвовать в донорно-акцепторном взаимодействии при образовании комплексной частицы являются, соответственно, координационное число и дентатность.
Дентатностью лиганда называется число донорных центров (неподелённых электронных пар либо -связей) лиганда, участвующих в донорно-акцепторном взаимодействии при образовании комплексной частицы.
Лиганды бывают:
-
монодентатными (Cl-, H2O, NH3),
-
бидентатными (C2O42-, этилендиамин, 1,10-фенантролин)
-
...
-
полидентатными.
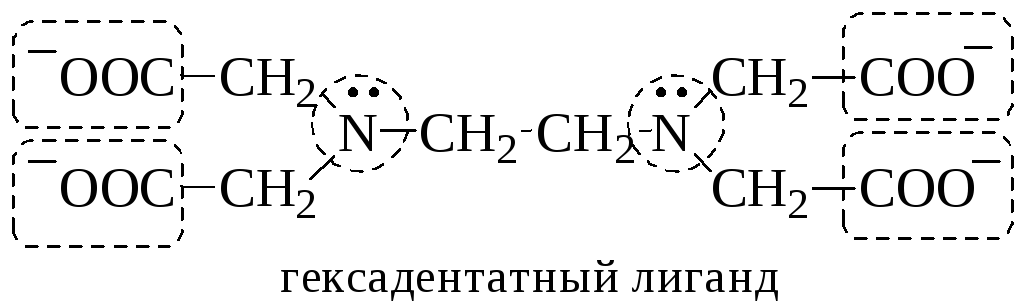
Координационным числом называется число донорных центров лигандов, с которыми взаимодействует данный центральный атом (ион).
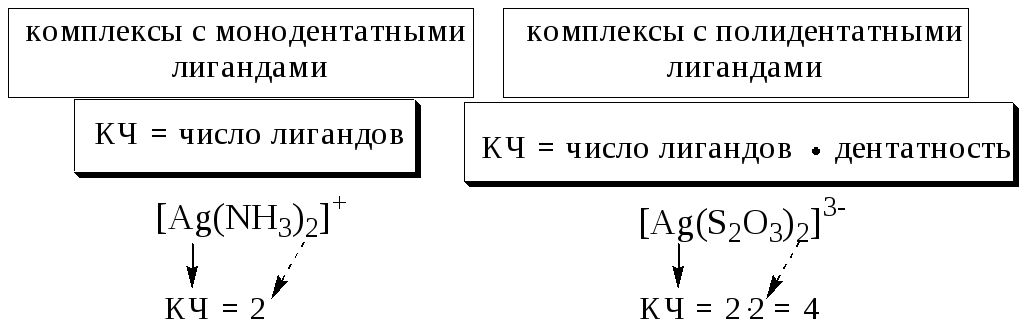
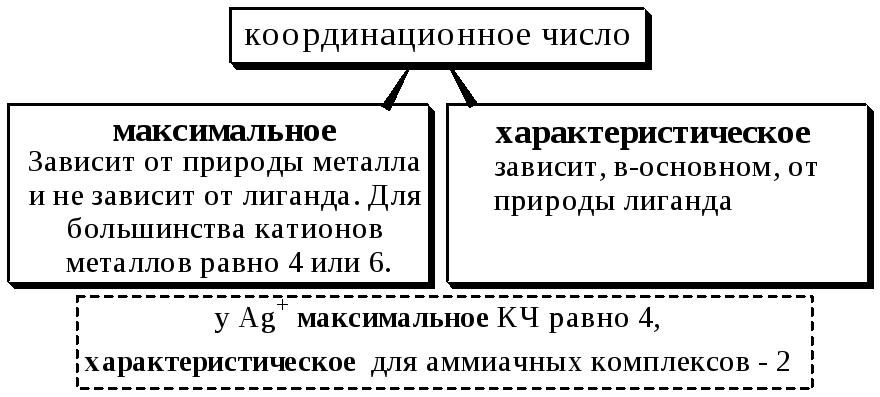
5.2. Классификация комплексных соединений
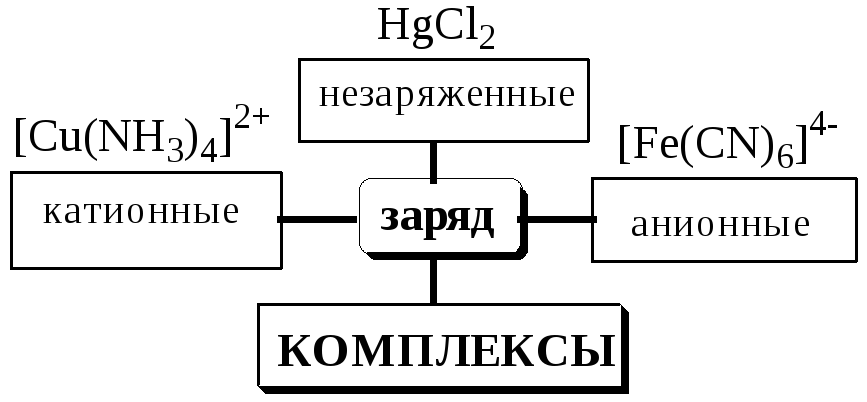
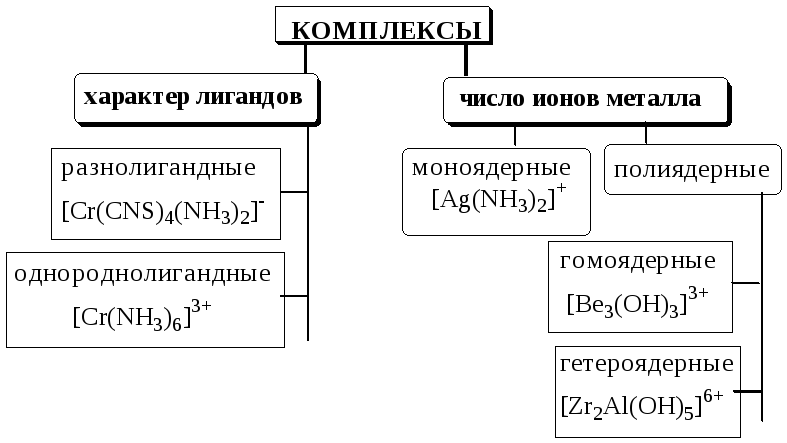
Соединения, образующиеся при взаимодействии насыщенных по координационному числу внутрисферных комплексов и любых частиц, находящихся во внешней сфере, называются внешнесферными комплексами.
Например (внутрисферные комплексные частицы выделены полужирным шрифтом):
[(C4H9)N4]2[Co(SCN)4]; [Ba(OH2)6] RSO3;
[Сd(phen)2](RCOO)2, (phen – фенантролин);
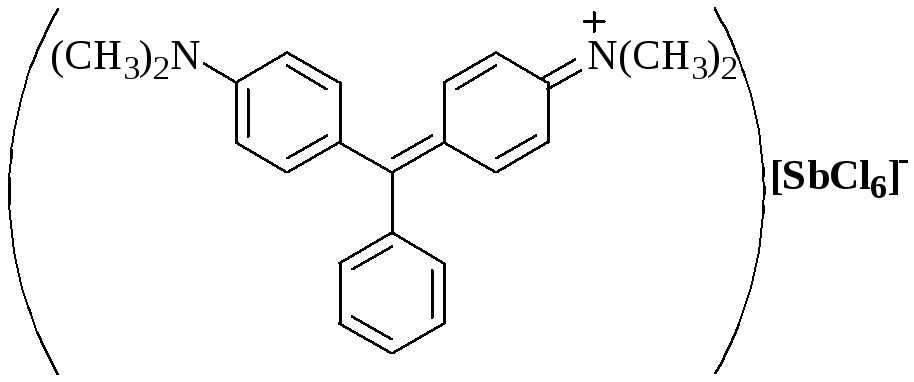
При образовании внешнесферного комплекса центральный ион не образует новой химической связи, взаимодействие происходит между лигандами внутренней сферы и частицами внешней сферы. Внешнесферные комплексы отличаются от обычных ионных пар (ионных ассоциатов) тем, что последние образуются в результате только электростатического взаимодействия полностью или частично сольватированных ионов, в то время как при образовании внешнесферных комплексов происходит образование ковалентной связи, водородной связи, имеет место ион-дипольное, гидрофобное взаимодействие и др.
Циклические комплексные соединения катионов металлов с полидентатными лигандами (обычно органическими), в которых центральный ион металла входит в состав одного или нескольких циклов, называются хелатами.
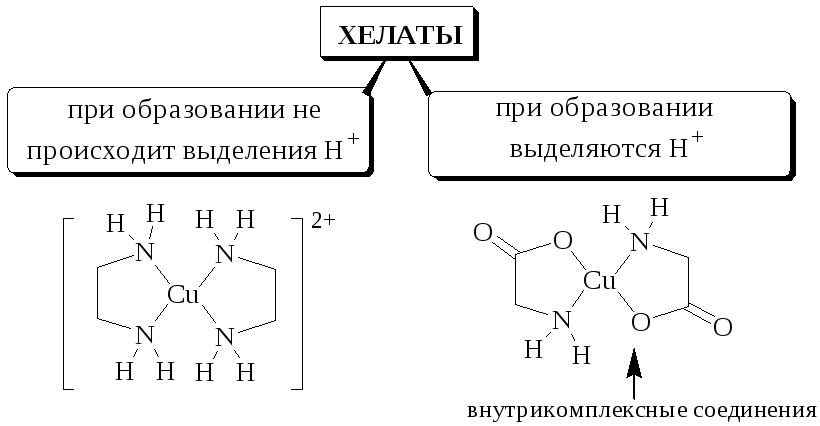
Ковалентные связи, образованные по донорно-акцепторному механизму, часто обозначают стрелкой , показывающей переход электронов от донорного центра лиганда к иону металла. Поскольку такие связи ничем не отличаются от обычных ковалентных связей, то их можно обозначать и простой чёрточкой.
5.3. Равновесия в растворах комплексных соединений
Внутренняя сфера связана с внешней ионной связью, поэтому в растворе соединение, содержащее комплексный ион, ведёт себя как сильный электролит. Например:
[Ag(NH3)2]NO3 [Ag(NH3)2]+ + NO3-
Между центральным ионом и лигандами образуются ковалентные связи по донорно-акцепторному механизму. Процесс комплексообразования происходит обратимо.
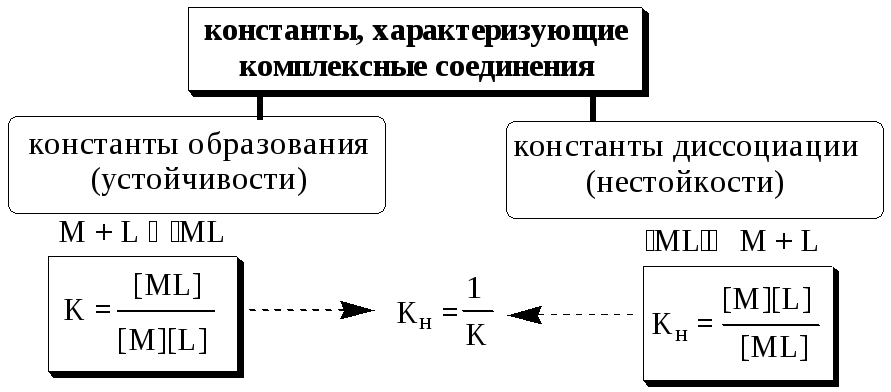
Обычно в состав комплексного соединения входит несколько лигандов, и процессы комплексообразования протекают ступенчато. Константы равновесия, характеризующие отдельную ступень, называются ступенчатыми (K). Произведение ступенчатых констант представляет собой общую константу (n, n – число ступеней), например (табл. 5.1).
Табл. 5.1
Константы образования аммиачных комплексов серебра
|
Комплекс |
Ступенчатая константа образования |
Общая константа образования |
|
[Ag(NH3)]+ |
lgK1 = 3,32 |
|
|
[Ag(NH3)2]+ |
|
lg2 = lg K1 + lgK2 = 7,23 |
Чем больше величина константы образования (для однотипных комплексов!), тем выше устойчивость комплекса.
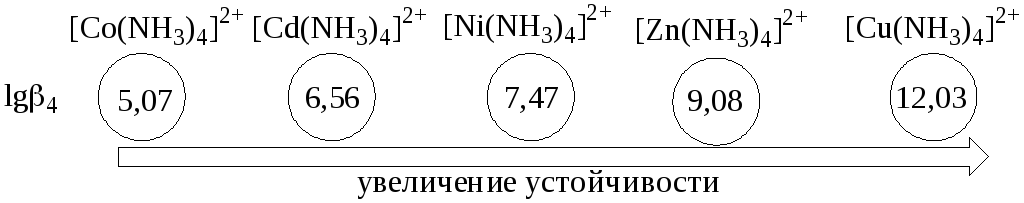
Наоборот, более устойчивому комплексу соответствует меньшая константа диссоциации
Константы, используемые для описания равновесий в растворах комплексных соединений, как и любые константы равновесия, могут быть термодинамическими и концентрационными (реальными и условными). Например, для комплекса MLn
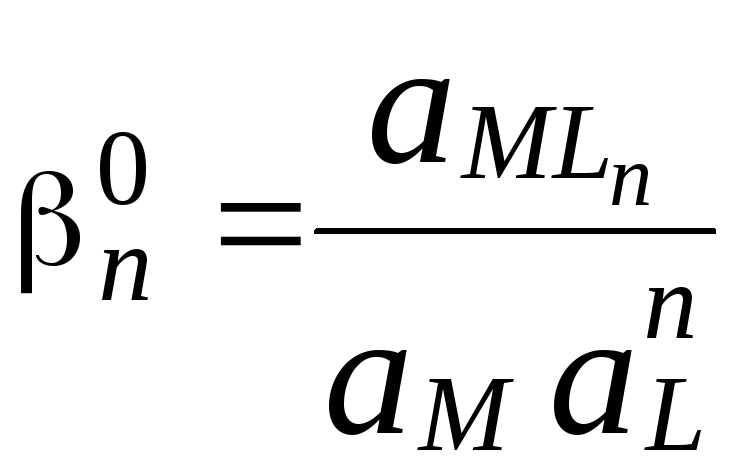
![]()
![]()
Данные константы связаны между собой следующим образом
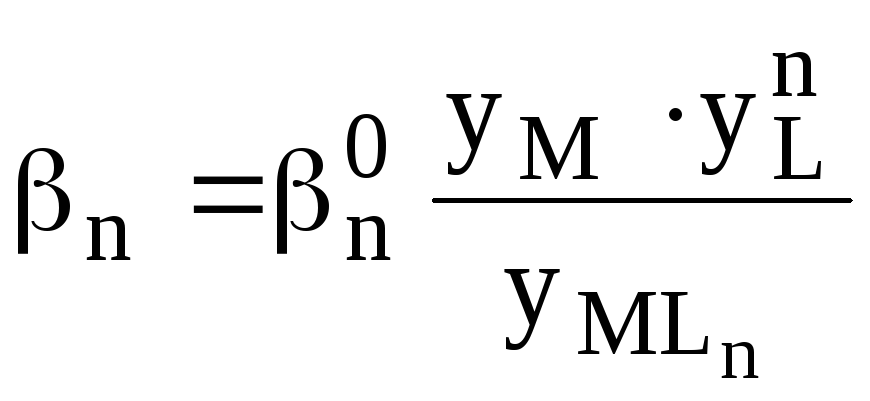
![]()
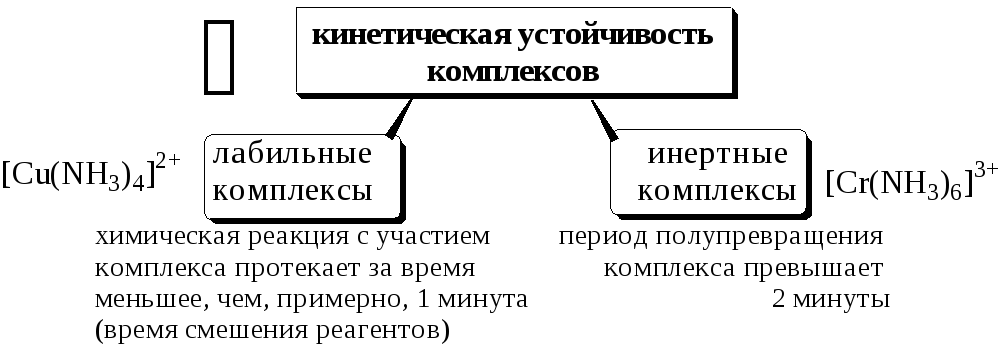
Константы равновесия характеризуют термодинамическую стабильность комплекса - меру возможности образования или диссоциации данного комплекса в равновесных условиях. Существует также понятие «кинетическая устойчивость», характеризующее скорость образования (диссоциации) комплексной частицы. В зависимости от скорости замещения лигандов внутренней сферы на другие лиганды комплексы разделяют на
5.4. Влияние различных факторов на комплексообразование в растворах
На процессы комплексообразования оказывают влияние природа комплексообразователя и лигандов, температура, ионная сила раствора, концентрация реагентов, а также побочные реакции, протекающие в растворе (протонирование лиганда при изменении рН, образование малорастворимых соединений и др.)

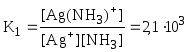
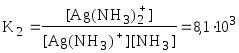 lgK2
= 3,91
lgK2
= 3,91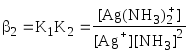 =
=1,7107
=
=1,7107