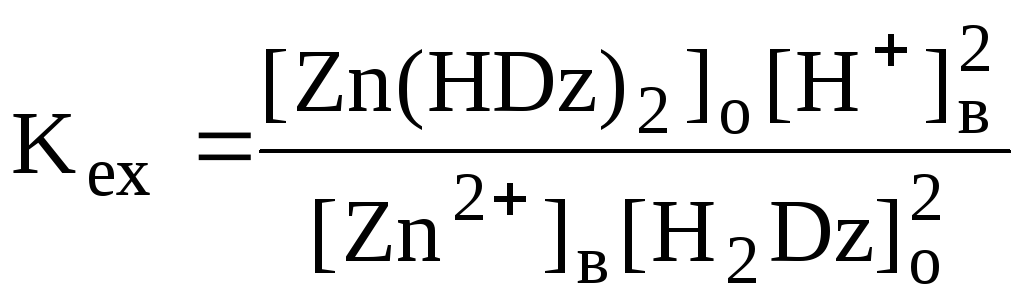- •Раздел 1
- •Глава 1
- •1.1. Предмет аналитической химии
- •1.2. Принцип, метод и методика анализа
- •1.3. Виды анализа
- •1.4. Методы аналитической химии
- •Глава 2
- •Первая аналитическая группа катионов
- •Вторая аналитическая группа катионов
- •Систематический анализ смеси Cl-, Br-, I- - ионов
- •Глава 3
- •3.2. Активность и коэффициент активности
- •Активность (a) - такая концентрация вещества в растворе, при использовании которой свойства данного раствора могут быть описаны теми же уравнениями, что и свойства идеального раствора.
- •0,100 Моль/л
- •0,100 Моль/л
- •3.4. Виды констант химического равновесия, используемые в аналитической химии в аналитической химии используются
- •3.5. Общие принципы расчёта состава равновесных систем
- •Уравнение материального баланса основано на том, что число атомов определённого элемента (или групп атомов определённого вида) в изолированной системе остаётся неизменным.
- •Глава 4
- •4.1. Важнейшие теории кислот и оснований
- •4.3. Влияние растворителя на кислотно-основные свойства растворённого вещества
- •4.4. Нивелирующее и дифференцирующее действие растворителя. Сильные и слабые кислоты и основания
- •Растворы амфолитов
- •4.6. Расчёт состава равновесных смесей протолитов при заданном значении рН
- •4.7. Кислотно-основные буферные растворы
- •Глава 5
- •5.1. Понятие о комплексном соединении
- •5.2. Классификация комплексных соединений
- •5.3. Равновесия в растворах комплексных соединений
- •Природа комплексообразователя и лигандов
- •Концентрация реагентов
- •Ионная сила
- •Температура
- •Побочные реакции
- •Глава 6
- •6.1. Произведение растворимости малорастворимого электролита
- •6.2. Растворимость
- •7,210-4 Моль/л
- •6.3. Влияние различных факторов на растворимость Природа растворяемого вещества и растворителя
- •Температура
- •Ионная сила
- •Общий (одноименный) ион
- •Побочные реакции
- •6.4. Общие принципы растворения осадков малорастворимых электролитов
- •Глава 7
- •Электродные потенциалы
- •Уравнение Нернста
- •7.3. Влияние различных факторов на протекание окислительно-восстановительных реакций Температура
- •Посторонние ионы
- •Влияние рН
- •Образование малорастворимых соединений
- •7.4. Расчёт различных констант с использованием электродного потенциала
- •Глава 8
- •8.1. Отбор пробы
- •8.2. Разложение пробы
- •Глава 9
- •9.2. Жидкость - жидкостная экстракция
- •9.2.2. Экстракционные системы и экстрагенты
- •9.2.4. Влияние различных факторов на процесс экстракции
- •Слабые основания
- •Амфолиты
- •Присутствие сильных электролитов
- •9.2.5 Способы осуществления экстракции
- •9.2.6. Применение экстракции
- •Глава 10
- •10.1. Приближённые вычисления и значащие цифры
- •Сложение и вычитание
- •Деление и умножение
- •Другие операции
- •10.2. Понятие об аналитическом сигнале
- •10.3. Методы расчёта концентрации вещества по величине аналитического сигнала
- •Метод градуировочного графика
- •Метод стандартов
- •10.4. Неопределённость и погрешности измерений
- •10.5. Некоторые основные положения математической статистики, используемые в аналитической химии
- •10.7. Основные характеристики методики анализа
- •Воспроизводимость
- •Правильность
Глава 9

9.1. Общая характеристика и классификация
Всякий раз, когда химик сталкивается с необходимостью анализа сложного объекта, в котором наряду с интересующим его соединением содержится много других веществ, и, кроме того, концентрация этого соединения очень мала, перед ним обязательно встают следующие проблемы. Во-первых, как добиться того, чтобы посторонние вещества не мешали определению? Во-вторых, можно ли повысить концентрацию вещества в исследуемом объекте? Для решения подобных проблем в аналитической химии используют разнообразные методы разделения и концентрирования.
Разделение - любой процесс или операция, в результате которых компоненты, составляющие исходную смесь, отделяются один от другого. Процесс, в котором нужные компоненты выделяют в самостоятельную фазу или часть фазы, называется выделением.
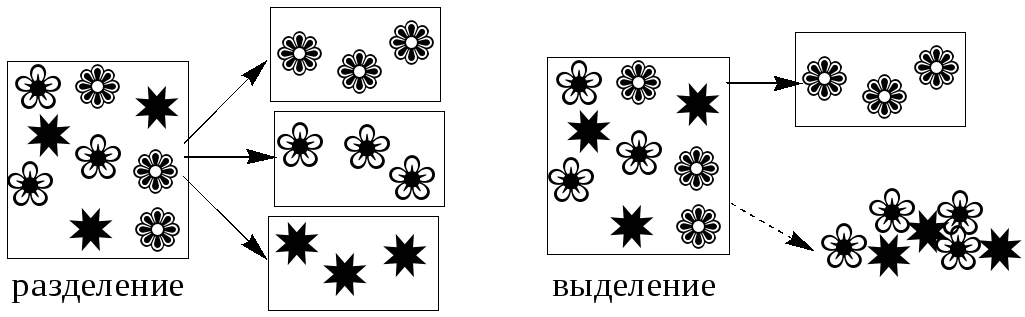
Концентрирование - процесс или операция повышения содержания определяемого вещества по отношению к матрице или матричным компонентам.
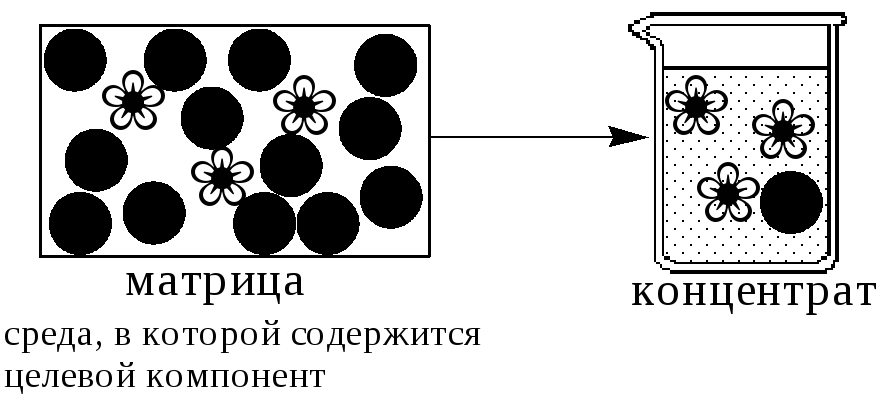
Концентрирование является частным случаем разделения. В основе этих операций лежат, как правило, одни и те же процессы. Различие между ними заключается в целях проведения. Цель разделения - упрощение способов определения интересующего нас вещества, цель концентрирования - снижение предела обнаружения (определения) вещества.
Для количественной характеристики эффективности разделения и концентрирования используют, соответственно, коэффициент разделения и коэффициент концентрирования. Рассмотрим, например, процесс разделения веществ, основанный на их различном распределении между двумя фазами. Отношение общих концентраций вещества в одной и второй фазах называется коэффициентом распределения (D).
-=[[pp[Коэффициент разделения (KA/B) - это отношение коэффициентов распределения двух веществ.
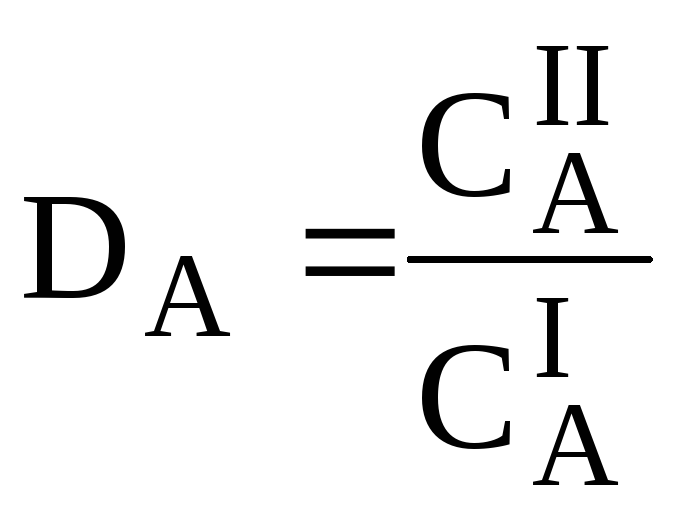
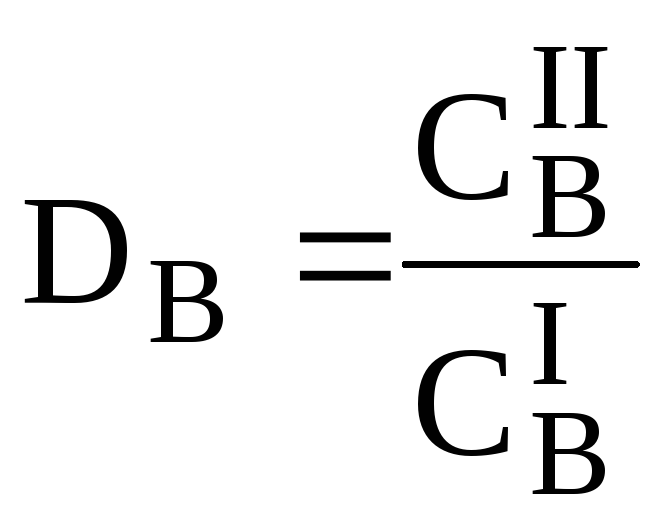
![]()
Разделение считается эффективным, если значение KA/B велико, а произведение DADB близко к 1.
Коэффициент концентрирования – величина, показывающая во сколько раз изменяется отношение абсолютных количеств микро - и макрокомпонента в концентрате по сравнению с исследуемой матрицей.
![]()
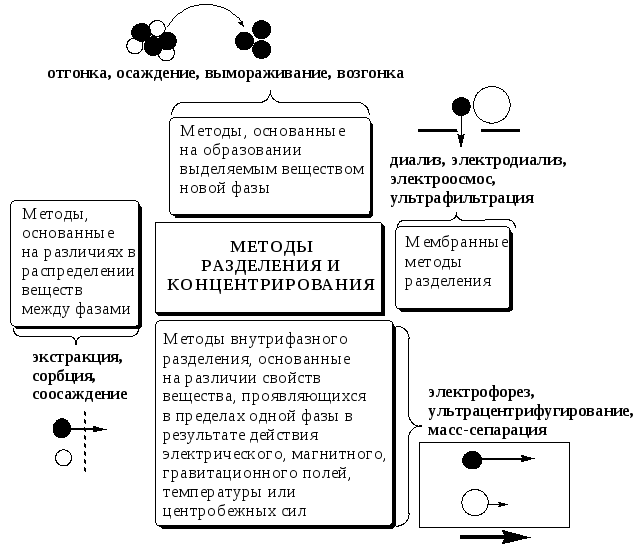
В настоящее время известны десятки различных методов разделения и концентрирования веществ. Единой и общепринятой их классификации нет. Обычно в качестве основного классификационного критерия используют наличие и характер фазовых переходов.
Методы разделения, основанные на различном межфазном распределении веществ, в которых одна из фаз является подвижной, а другая - неподвижной и процесс переноса вещества между ними происходит многократно, называются хроматографическими. Хроматографические процессы могут протекать в системе жидкость-жидкость (жидкость-жидкостная хроматография), жидкость - твёрдое вещество (адсорбционная хроматография, ионообменная хроматография и др.), газ - жидкость (газожидкостная хроматография) и т.д.
9.2. Жидкость - жидкостная экстракция
Жидкость-жидкостная экстракция - метод разделения и концентрирования веществ, основанный на их различном распределении между двумя несмешивающимися жидкими фазами, обычно между водой и несмешивающимся с ней органическим растворителем.
Жидкая фаза (органический растворитель или их смесь), в которую переходит вещество, например, из водной фазы называется экстрагентом. Если экстракция обусловлена образованием новых химических соединений, то экстрагентом обычно называют реагент, при взаимодействии с которым образуется экстрагируемое соединение. Отделённая органическая фаза, содержащая вещество, экстрагированное из водной фазы, называется экстрактом. Процесс обратного извлечения вещества из экстракта в водную фазу называется реэкстракцией. Раствор, используемый для извлечения вещества из экстракта, называется реэкстрагентом. Отделённая водная фаза, которая содержит вещества, извлечённые из экстракта в результате реэкстракции, называется реэкстрактом.

9.2.1. Количественные характеристики экстракционного равновесия
Экстракционное равновесие описывается с помощью закона распределения Нернста.
При постоянной температуре третий компонент, добавленный к системе, состоящей из двух несмешивающихся или ограниченно смешивающихся жидкостей, распределяется между ними в определённом постоянном для данной температуры соотношении.
 K0
- термодинамическая константа экстракции
K0
- термодинамическая константа экстракции
На практике для описания экстракционного равновесия используют:
-
константа распределения (P0),
-
коэффициент распределения (D),
-
степень однократной экстракции (R),
-
константа экстракции (Kex).
Константа распределения - это отношение равновесной концентрации строго определённой формы вещества в органической фазе к равновесной концентрации этой же формы в водной фазе.
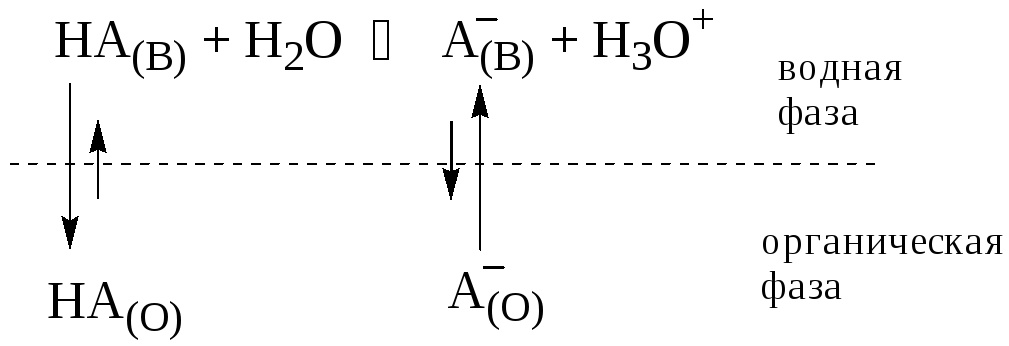
Коэффициент распределения - это отношение общей концентрации всех форм существования экстрагируемого вещества в органической фазе к общей концентрации всех его форм, находящихся в водной фазе.
Например, при экстракции слабой кислоты из водной фазы неполярным органическим растворителем
![]()
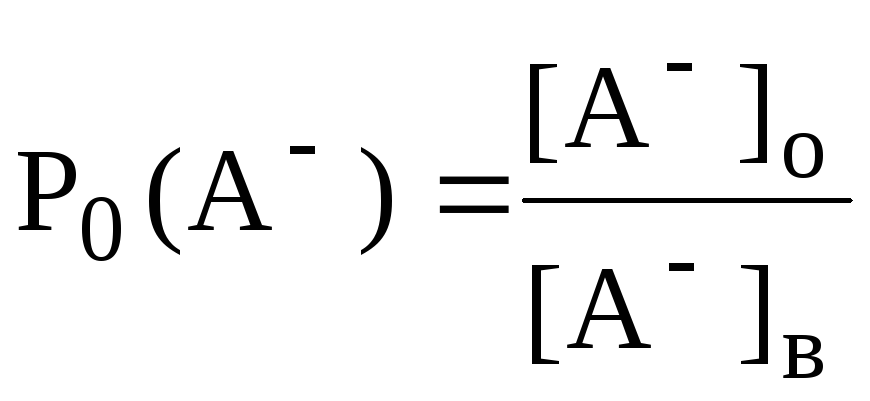
![]()
Степень однократной экстракции - доля вещества от его начального количества, экстрагируемая в фазу органического растворителя за одну экстракцию при данных условиях.
![]()
Если в процессе экстракции протекает химическая реакция, то для характеристики экстракционного равновесия используют константу экстракции. Например
![]()
![]()