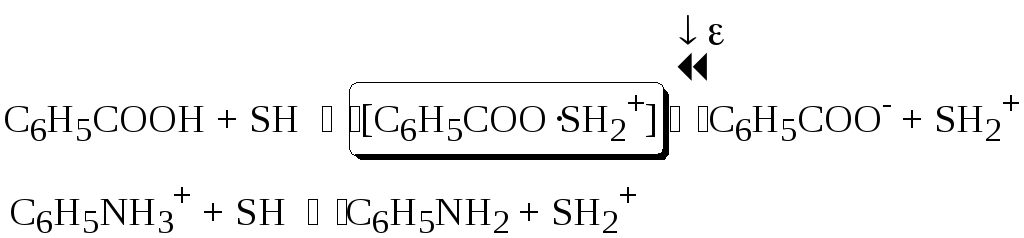- •Раздел 1
- •Глава 1
- •1.1. Предмет аналитической химии
- •1.2. Принцип, метод и методика анализа
- •1.3. Виды анализа
- •1.4. Методы аналитической химии
- •Глава 2
- •Первая аналитическая группа катионов
- •Вторая аналитическая группа катионов
- •Систематический анализ смеси Cl-, Br-, I- - ионов
- •Глава 3
- •3.2. Активность и коэффициент активности
- •Активность (a) - такая концентрация вещества в растворе, при использовании которой свойства данного раствора могут быть описаны теми же уравнениями, что и свойства идеального раствора.
- •0,100 Моль/л
- •0,100 Моль/л
- •3.4. Виды констант химического равновесия, используемые в аналитической химии в аналитической химии используются
- •3.5. Общие принципы расчёта состава равновесных систем
- •Уравнение материального баланса основано на том, что число атомов определённого элемента (или групп атомов определённого вида) в изолированной системе остаётся неизменным.
- •Глава 4
- •4.1. Важнейшие теории кислот и оснований
- •4.3. Влияние растворителя на кислотно-основные свойства растворённого вещества
- •4.4. Нивелирующее и дифференцирующее действие растворителя. Сильные и слабые кислоты и основания
- •Растворы амфолитов
- •4.6. Расчёт состава равновесных смесей протолитов при заданном значении рН
- •4.7. Кислотно-основные буферные растворы
- •Глава 5
- •5.1. Понятие о комплексном соединении
- •5.2. Классификация комплексных соединений
- •5.3. Равновесия в растворах комплексных соединений
- •Природа комплексообразователя и лигандов
- •Концентрация реагентов
- •Ионная сила
- •Температура
- •Побочные реакции
- •Глава 6
- •6.1. Произведение растворимости малорастворимого электролита
- •6.2. Растворимость
- •7,210-4 Моль/л
- •6.3. Влияние различных факторов на растворимость Природа растворяемого вещества и растворителя
- •Температура
- •Ионная сила
- •Общий (одноименный) ион
- •Побочные реакции
- •6.4. Общие принципы растворения осадков малорастворимых электролитов
- •Глава 7
- •Электродные потенциалы
- •Уравнение Нернста
- •7.3. Влияние различных факторов на протекание окислительно-восстановительных реакций Температура
- •Посторонние ионы
- •Влияние рН
- •Образование малорастворимых соединений
- •7.4. Расчёт различных констант с использованием электродного потенциала
- •Глава 8
- •8.1. Отбор пробы
- •8.2. Разложение пробы
- •Глава 9
- •9.2. Жидкость - жидкостная экстракция
- •9.2.2. Экстракционные системы и экстрагенты
- •9.2.4. Влияние различных факторов на процесс экстракции
- •Слабые основания
- •Амфолиты
- •Присутствие сильных электролитов
- •9.2.5 Способы осуществления экстракции
- •9.2.6. Применение экстракции
- •Глава 10
- •10.1. Приближённые вычисления и значащие цифры
- •Сложение и вычитание
- •Деление и умножение
- •Другие операции
- •10.2. Понятие об аналитическом сигнале
- •10.3. Методы расчёта концентрации вещества по величине аналитического сигнала
- •Метод градуировочного графика
- •Метод стандартов
- •10.4. Неопределённость и погрешности измерений
- •10.5. Некоторые основные положения математической статистики, используемые в аналитической химии
- •10.7. Основные характеристики методики анализа
- •Воспроизводимость
- •Правильность
4.3. Влияние растворителя на кислотно-основные свойства растворённого вещества
Кислотно-основные свойства растворителя
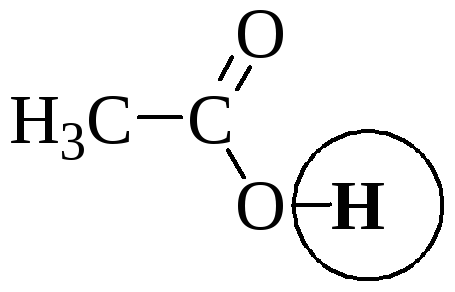
Сила кислоты зависит от природы взаимодействующего с ней основания, а сила основания - от взаимодействующей с ним кислоты. Например, первичный амин в воде является более слабым основанием, чем в уксусной кислоте.


В зависимости от кислотно-основных свойств растворители бывают:
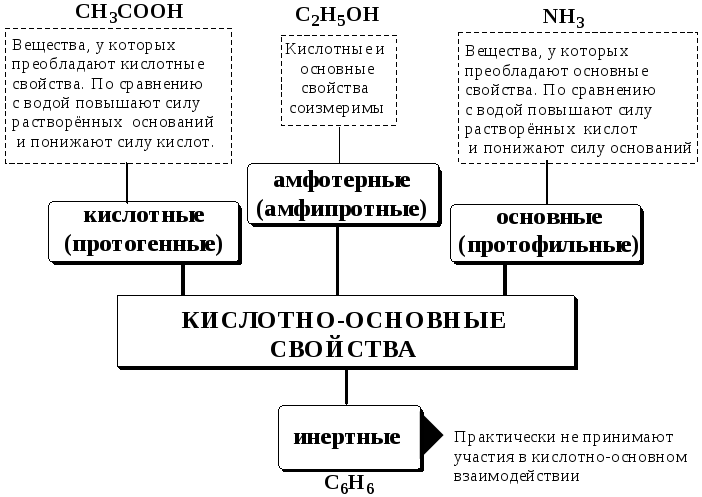
Протонные растворители могут относиться как к кислотным (уксусная кислота), так и к основным (аммиак) или амфотерным растворителям (вода). Одни из представителей полярных апротонных растворителей, например, диметилформамид, обладают основными свойствами, другие (кетоны, ацетонитрил, диметилсульфоксид), а также неполярные апротонные растворители вообще не склонны к реакциям кислотно-основного взаимодействия.
Автопротолиз растворителя. Константа автопротолиза
Автопротолизом называют процесс кислотно-основного взаимодействия между двумя молекулами вещества, при котором одна молекула ведёт себя как кислота, а вторая - как основание.
H2O + H2O H3O+ + OH-
СH3COOH + СH3COOH СH3COO- + СH3COOH2+
C2H5OH + C2H5OH C2H5O- + C2H5OH2+
NH3 + NH3 NH2- + NH4+
Автопротолизу в той или иной степени подвергается большинство растворителей. Однако у одних веществ он идёт более интенсивно, у других - менее интенсивно.
Рассмотрим реакцию кислотно-основного взаимодействия между двумя молекулами растворителя
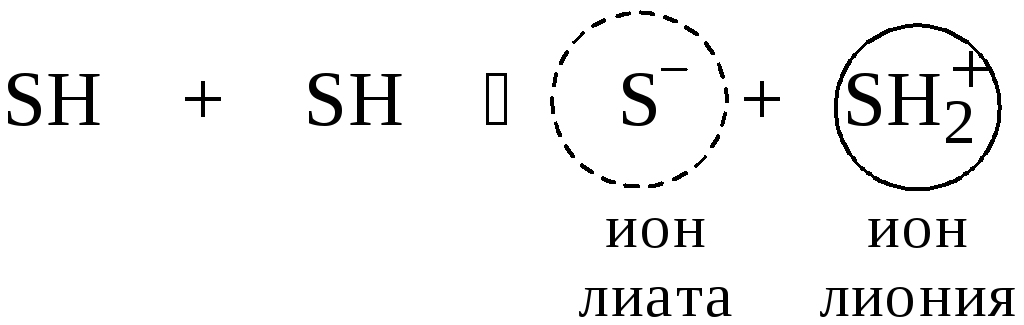
Для
чистого растворителя
![]() ,
поэтому
,
поэтому
![]()
![]()
Полученная константа называется константой автопротолиза (KSH).
![]()
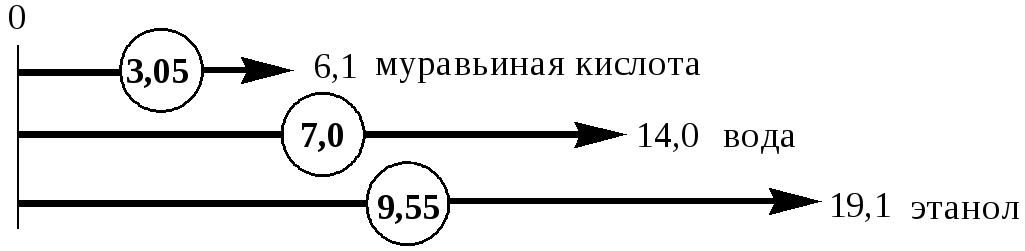
В случае воды выражения для константы автопротолиза (обычно обозначается как KW) выглядит следующим образом:
![]()
![]()
При
25 С
![]() =
1,010-14,
pKW
= 14,0. При увеличении температуры константа
автопротолиза воды увеличивается, а её
показатель, соответственно, уменьшается.
=
1,010-14,
pKW
= 14,0. При увеличении температуры константа
автопротолиза воды увеличивается, а её
показатель, соответственно, уменьшается.
Показатель
константы автопротолиза является мерой
протяжённости шкалы кислотности (от
![]() до
до
![]() )
для данного растворителя. Величина,
равная половине pKSH,
соответствует нейтральной среде для
данного растворителя. В нейтральной
среде
)
для данного растворителя. Величина,
равная половине pKSH,
соответствует нейтральной среде для
данного растворителя. В нейтральной
среде
![]() .
.
Константа автопротолиза растворителя связывает между собой константы кислотности и основности частиц, образующих сопряжённую кислотно-основную пару. Например, для водных растворов:
![]()
![]()
Диэлектрическая проницаемость
Диэлектрической проницаемостью среды () называют безразмерную величину, которая показывает, во сколько раз взаимодействие между двумя точечными электрическими зарядами в данной среде слабее, чем в вакууме.
Чем выше диэлектрическая проницаемость растворителя, тем лучше происходит диссоциация растворённого в нём электролита. Растворители, у которых > 15, называются полярными, а те, у которых < 15 - неполярными.
Диэлектрическая проницаемость влияет на величину константы автопротолиза.
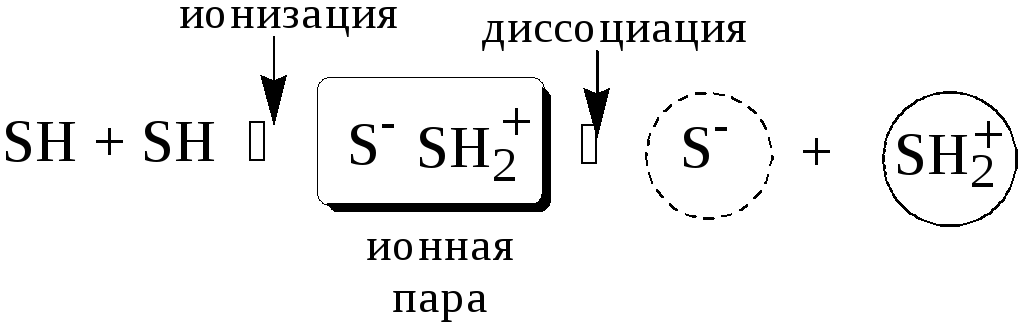
Если растворитель имеет малую диэлектрическую проницаемость, то константа диссоциации ионной пары будет также мала, следовательно, и значение константы автопротолиза будет небольшим.
|
растворитель |
|
pKSH |
|
HCOOH |
57,0 |
6,1 |
|
CH3COOH |
6,2 |
14,4 |
Диэлектрическая проницаемость растворителя оказывает влияние на константу кислотности (или основности) растворённого вещества. При уменьшении величины данных констант уменьшаются. Причём у заряженных частиц они изменяются менее сильно, чем у незаряженных.
|
кислота |
H2O |
CH3OH |
pKa |
|
C6H5COOH |
4,2 |
9,5 |
5,3 |
|
C6H5NH3+ |
4,6 |
6,1 |
1,5 |