
- •1. Строение атома
- •1.1. Энергетическое состояние электронов в атоме
- •1.2. Основные принципы распределения электронов в атомах
- •В соответствии с этим правилом последовательность заполнения подуровней:
- •1.3. Периодический закон и электронные формулы атомов
- •1.4. Примеры решения и оформления заданий
- •1.5. Задания для самостоятельной подготовки
- •2. Классы неорганических веществ
- •2.1. Оксиды
- •Основные оксиды
- •Кислотные оксиды
- •Амфотерные оксиды
- •2.2. Гидроксиды
- •Основания
- •Кислоты
- •Амфотерные гидроксиды
- •2.3. Соли
- •Средние соли
- •Кислые соли
- •Основные соли
- •2.4. Примеры решения заданий
- •2.5. Задания для самостоятельной подготовки
- •3. Основы химической термодинамики
- •3.1. Энтальпия
- •3.2. Энтропия
- •3.3 Энергия Гиббса и ее изменение в ходе химических реакций
- •3.4. Примеры решения заданий
- •3.5. Задания для самостоятельной подготовки
- •4. Химическое равновесие
- •4.1. Константа химического равновесия
- •4.2. Принцип Ле Шателье
- •Влияние концентраций компонентов системы
- •Влияние температуры
- •Влияние общего давления в системе
- •4.3 Примеры решения заданий
- •4.4. Задания для самостоятельной подготовки
- •5. Растворы
- •5.1. Примеры решения заданий
- •5.2. Задания для самостоятельной подготовки
- •5.3. Электролиты
- •Теория электролитической диссоциации Степень диссоциации
- •5.4. Ионные реакции
- •5.5. Примеры решения заданий
- •5.6. Задания для самостоятельной подготовки
- •5.7. Диссоциация воды. Водородный показатель
- •5.8. Гидролиз
- •5.9. Примеры решения заданий
- •5.10 Задания для самостоятельной подготовки
- •6. Окислительно-восстановительные процессы
- •6.1. Степень окисления
- •6.2. Окислительно-восстановительные реакции
- •6.3. Составление уравнений окислительно-восстановительных реакций
- •Правила составления полуреакций в разных средах
- •Овр в кислой среде
- •Овр в щелочной среде
- •Овр в нейтральной среде
- •6.4. Примеры решения заданий
- •6.5. Задания для самостоятельной подготовки
- •6.6 Взаимодействие металлов с кислотами, водой и растворами щелочей
- •6.7. Примеры решения и оформления заданий
- •6.8. Задания для самостоятельной подготовки
- •6.9. Электрохимическая коррозия
- •Описание процесса гальванокоррозии
- •6.10. Примеры решения заданий
- •6.11. Задания для самостоятельной подготовки
- •6.12. Электролиз растворов
- •Катодные процессы
- •Анодные процессы
- •Законы фарадея
- •6.13. Примеры решения и оформления заданий
- •6.14 Задания для самостоятельной подготовки
- •Библиографический список Основная литература
- •Дополнительная литература
- •Стандартные энтальпии образования и энтропии
- •Названия некоторых кислот и их солей
- •Стандартные окислительно-восстановительные потенциалы металлов
- •Окислительно-восстановительные потенциалы водорода, кислорода и металлов в разных средах оглавление
3. Основы химической термодинамики
Химическая термодинамика – раздел химии, изучающий:
-
переход энергии из одной формы в другую, от одной части системы к другой;
-
энергетические эффекты химических реакций;
-
возможность и направление самопроизвольного протекания процессов.
Состояние системы характеризуют параметры – давление, объем, температура, концентрация и др. Термодинамические свойства системы при постоянных давлении и температуре можно выразить с помощью нескольких функций состояния системы: энтальпии, энтропии, энергии Гиббса и др.
Для удобства сопоставления термодинамических констант их относят к стандартному состоянию. В качестве стандартного выбрано устойчивое состояние чистых индивидуальных веществ (для растворов – концентрация растворенного вещества 1 моль/л, для газов – парциальное давление, равное атмосферному) при постоянной температуре и давлении 101кПа (1 атм).
3.1. Энтальпия
Количество выделившейся или поглощенной в ходе реакции энергии называют тепловым эффектом химической реакции.
В термодинамике тепловой эффект или энтальпия химической реакции (HХ.Р) – теплота, которая выделяется или поглощается при ее протекании, если р, Т = const; измеряется в кДж.
Уравнения реакций, в которых указаны тепловые эффекты при постоянных давлении и температуре (HХ.Р), называются термохимическими. В термохимических уравнениях указывают также модификации или агрегатные состояния веществ.
В соответствии со знаком теплового эффекта реакции можно разделить на две группы:
-
экзотермические – идут с выделением тепла (HХ.Р 0);
-
эндотермические – идут с поглощением тепла (HХ.Р 0).
Согласно основному закону термохимии, сформулированному Г. И. Гессом:
-
энтальпия химической реакции не зависит от пути протекания реакции, т. е. не зависит от числа и характера промежуточных стадий, а определяется лишь начальным и конечным состоянием системы.
Следствие из закона Гесса:
-
тепловой эффект химической реакции (
 )
равна разности между суммами энтальпий
образования продуктов реакции (
)
равна разности между суммами энтальпий
образования продуктов реакции ( )
и исходных веществ (
)
и исходных веществ ( )
c учетом стехиометрических
коэффициентов (n,
m). Как правило, для
расчетов используют стандартные
величины.
)
c учетом стехиометрических
коэффициентов (n,
m). Как правило, для
расчетов используют стандартные
величины.
![]()
Стандартная энтальпия (теплота) образования вещества Hобр.0 или Нf0 [кДж/моль] – это теплота образования 1 моль соединения из простых веществ устойчивых при стандартных условиях.
Hобр0 простых веществ (H2, O2, Cl2 и т. д.) равна нулю.
3.2. Энтропия
Энтропия (S) является мерой неупорядоченности системы. Энтропия вещества в стандартном состоянии называется стандартной энтропией S0 и измеряется в Дж/(моль·К).
-
Стандартное изменение энтропии химической реакции (
 )
равно разности
между суммами энтропий продуктов (
)
равно разности
между суммами энтропий продуктов ( )
и исходных веществ (
)
и исходных веществ ( )
с учетом стехиометрических коэффициентов
(n,
m):
)
с учетом стехиометрических коэффициентов
(n,
m):
![]()
S0 простых веществ (H2, O2, Cl2 и т. д.) не равна нулю.
3.3 Энергия Гиббса и ее изменение в ходе химических реакций
С точки зрения термодинамики в химических процессах появляются две тенденции:
-
стремление к образованию связей между частицами, к возникновению более сложных агрегатов, сопровождающееся понижением энергии системы, снижением энтальпии;
-
стремление к беспорядочному расположению частиц, их разъединению, характеризуемое увеличением энтропии.
Каждая их этих противоположных тенденций, количественно выражаемая значениями ΔH и ΔS, зависит от природы веществ и условий протекания процесса (температура, давление, соотношение между реагентами и др.).
В условиях постоянных давления и температуры, функцией, сопоставляющей эти тенденции, является энергия Гиббса или изобарно-изотермический потенциал, измеряется в кДж/моль:
![]() .
.
-
Стандартное изменение энергии Гиббса химической реакции равно разности между суммами изменения энергии Гиббса образования продуктов и исходных веществ с учетом стехиометрических коэффициентов:
![]()
G0 простых веществ равно нулю.
Изменение энергии Гиббса характеризует возможность и направление самопроизвольного протекания процессов:
-
 > 0
– реакция может самопроизвольно
протекать в обратном направлении;
> 0
– реакция может самопроизвольно
протекать в обратном направлении; -
 < 0
– реакция может самопроизвольно
протекать в прямом направлении;
< 0
– реакция может самопроизвольно
протекать в прямом направлении; -
 = 0
– система находится в состоянии
равновесия.
= 0
– система находится в состоянии
равновесия.
Если
пренебречь зависимостями Н
и S
от температуры и считать их постоянными,
можно рассчитать
![]() при нестандартной температуре.
Исходя из этого можно рассчитать
температуру, при которой устанавливается
состояние равновесия:
при нестандартной температуре.
Исходя из этого можно рассчитать
температуру, при которой устанавливается
состояние равновесия:
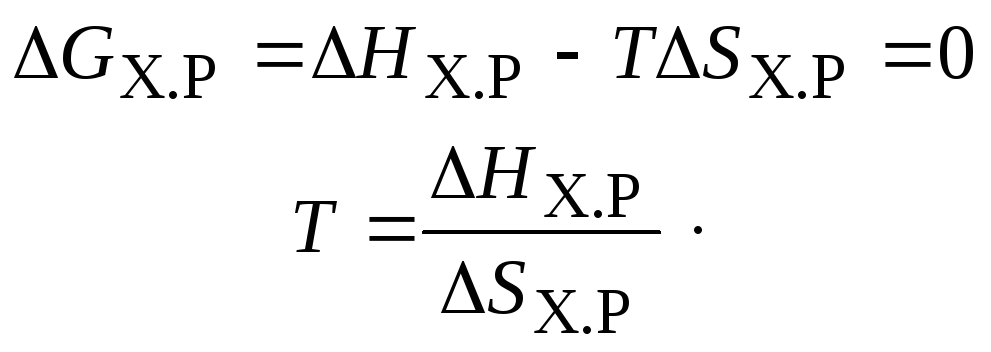
Если в ходе расчетов значение температуры установления состояния равновесия имеет отрицательное значение (по шкале Кельвина), можно сделать вывод, что состояние равновесия в системе недостижимо, реакция во всем температурном интервале может самопроизвольно протекать либо в прямом, либо в обратном направлении.
Проанализируем
зависимость
![]() .
Если пренебречь зависимостями величин
H
и S
от температуры, то
.
Если пренебречь зависимостями величин
H
и S
от температуры, то
![]() является уравнением прямой. Возможны
четыре варианта расположения прямой
по отношению к осям координат в зависимости
от знаков H
и S
(рис. 1).
является уравнением прямой. Возможны
четыре варианта расположения прямой
по отношению к осям координат в зависимости
от знаков H
и S
(рис. 1).

Рис.
1. График зависимости
![]() от температуры
от температуры
-
H < 0, S < 0. Прямые реакции термодинамически возможны (GХ.Р < 0) при температурах до Т/, при температурах свыше Т/ (GХ.Р > 0) возможны обратные реакции.
-
H > 0, S > 0. Прямые реакции термодинамически возможны (GХ.Р < 0) при температурах свыше Т/, при температурах до Т/ возможны обратные реакции.
-
H > 0, S < 0. Во всём диапазоне температур значение GХ.Р > 0, т.е. прямые реакции термодинамически невозможны при любых температурах.
-
H < 0, S > 0. Во всём диапазоне температур значение GХ.Р < 0, т.е. прямые реакции термодинамически возможны при любых температурах.
