
- •Классификация ингибиторов коррозии
- •Основные виды тэ
- •Теплота сама собой не может переходить от более холодного тела к более нагретому
- •Невозможно превратить какое- либо количество теплоты в работу без того , чтобы часть тепла не была растрачена при более низкой температуре :
- •В изолированных системах самопроизвольно идут только те процессы , которые ведут к увеличению неупорядоченности системы ,т.Е к росту энтропии
- •28. Свойства истинных растворов. Способы выражения концентрации: массовая доля, молярная, молярная эквивалента, титр, моляльная, мольная доля, взаимосвязь между концентрациями.
- •29. Растворы электролитов. Механизмы электролитической диссоциации веществ с ионной и ковалентной полярной связью. Ступенчатая диссоциация.
- •30. Растворы слабых электролитов. Степень диссоциации. Константа диссоциации. Закон разбавления Оствальда.
- •32.Кислотно-основные свойства веществ с точки зрения электролитической диссоциации. Ионное произведение воды. Водородный и гидроксидный показатели. Индикаторы.
- •36. Общие закономерности электрохимических процессов. Возникновение электродного потенциала. Шкала стандартных электродных потенциалов. Типы электродов.
46) Коррозией -называется разрушение металлов вследствие химического или электрохимического взаимодействия с окружающей средой. По механизму протекания процесса различают два типа коррозии металлов: химическую и электрохимическую
Виды коррозии:
Газовая коррозия
Атмосферная коррозия
Коррозия по ватерлинии
Подземная коррозия
Коррозия внешним током
Коррозия блуждающим током
Контактная коррозия
Коррозия при трении
Послойная коррозия
Структурная коррозия
Коррозия под напряжением
Условия протекания электорохим-ой К: 1)неоднородность сплавов по составу 2)неоднородность состава электролита.
В результате на поверхности металла возникают анодные и катодные зоны, а при наличии электролита образуются микрогальванический элементы, продуцирующий коррозионный ток.
КИСЛОРОДНАЯ ДЕПОЛЯРИЗАЦИЯ НА КАТОДЕ
Молекулы кислорода больше по размеру - меньшая скорость движения, поэтому концентрационная поляризация имеет большое значение, но природа катодных участков не влияет на скорость деполяризации.
Снизить скорость деполяризации кислорода: 1) уменьшить концентрацию кислорода у поверхности металла
2)снизить парциальное давление кислорода над раствором
3)изолировать металл от окислителя.
47) изменение свойств коррозионной среды. При удалении инициаторов коррозии. Удаление кислорода из воды, путем предварительного нагревания или добавляем восстановители (гидрозил).
Подщелачивание среды
Применение ингибиторов, замедляющих коррозию. Уротропин.
Механизм действия ингибиторов заключается в образовании защитных пленок на поверхности металла, тормозящих коррозионный процесс.
Защитный покрытия:
1)покрытия, изолирующие металл от агрессивной среды:
- неметаллический покрытия - нанесение красок, лаков, эмалей, пластмасс, резины.
2)химические покрытия - оксидирование - получение оксидов железа. Анодирование - процесс образования анода на поверхности алюминиевого изделия при помощи электролиза, фосфатирование - получение нерастворимых пленок гидросульфата.
3)металлические защитные покрытия:
-анодное покрытие - когда защищаемый металл покрывают металлом более отрицательного потенциалa(Zn). В итого возникает микро ГЭ. Такое покрытие является надежным, окисление защищенного металла не произойдет до тех пор, пока не окислится весь цинк, например, на аноде.
-катодные покрытия - выбирают металл с более положительным потенциалом, чем у защищаемого. Катодное покрытие является менее эффективным и защищает только при условии целостности покрытия. При повреждении катодного покрытия образуется микрогальваническая пара и происходит окисление защищаемого металла.
Электрохимическая защита основана на искусственном торможении анодного или катодного процесса.
Рациональное конструктирование - еще один способ борьбы:
избегать контактов двух различных метла
избегать щелей, трещин, где может быть электролит
использование материалов, устойчивых к коррозии .
использование сверхчистых металлов и сплавов
поверхностная обработка металла (полировка и так далее).
Пассивирующие металлы: А1 Ti Va Mn Cr Kd
кобатьт, Ni (Fe и Pb - в особых условиях).

изделие


Fe



ЯтЯт
Zn
изделие
48) Виды электродов:
катодная защита - заключается в подключении защищаемого металла к отрицательному полюсу источника тока, то есть изделие становится катодом, а катод не разрушается, а на его поверхности происходят процессы восстановления окислителей из среды. К положительному источнику тока подключается ненужный лом, следовательно становится анодом, затем разрушается. Все должно быть в токопроводящей среде.
анодная защита - заключается в подключении изделия к положительному полюсу источника тока, следовательно, становится анодом. Такая защита возможно только для тех металлов, которые способны к пассивации, под действием внешнего источника тока, образующая пассивная пленка получается очень хорошего качества и эффективно препятствует коррозии.
протекторная защита - заключается в подсоединении к защищаемому металлу кусочка более активного металла, тогда возникает разность потенциалов и будет разрушаться протектор, т.к. он становится анодным участком. Протекторная защита работает также, как и нарушенное анодное покрытие.
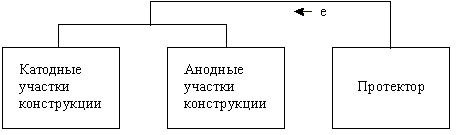 Рис.1.
Схема
протекторной
защиты
Рис.1.
Схема
протекторной
защиты

Рис. 2. Схема катодной защиты (метод внешнего потенциала).
 .
.
Рис. 3. Схема коррозии металла в кислом растворе при нарушении анодного покры-тия: 1 - раствор; 2- покрытие; 3 - основной металл; 4 - пора.
Пассивность металлов и сплавов
Скорость коррозии таких металлов, как железо, алюминий, хром, никель, титан, в растворах сильных окислителей значительно меньше, чем в растворах более слабых окислителей. Явление аномально резкого уменьшения скорости коррозии в растворах сильных окислителей называют пассивацией, а состояние металла - пассивным. Склонность металлов к пассивации различная, например никель пассивируется легче железа. Некоторые металлы: алюминий, титан, магний и др. склонны к пассивации в слабых окислителях, таких, как речная вода.
На кривой зависимости можно выделить три зоны: зона активного состояния (I); зона активно-пассивного состояния (II), зона пассивного состояния (III).
|
Легирование металлов. Это эффективный (хотя и дорогой) метод повышения коррозионной стойкости металлов. При легировании в состав сплава вводят компоненты, вызывающие пассивацию металла: хром, никель, вольфрам и др. Широкое применение нашло легирование для защиты от газовой коррозии.
Объемное легирование осуществляется одновременно с получением того или иного конструкционного материала. Так хром и никель, введенные в сталь, диффундируя к поверхности, образуют оксидный слой, содержащий шпинели состава: NiO· Cr2O3 и FeO· Cr2O3.
Поверхностное легирование представляет собой насыщение поверхности данного сплава металлом, который при высоких температурах окисляется энергичнее, чем железо, и образует при этом плотную защитную пленку оксида. Так осуществляют легирование стали алюминием (алитирование), хромом (хромирование), кремнием (силицирование). Стали, легированные 4-9% хрома, молибденом или кремнием, применяют, например, в парогенераторо- и турбиностроении.
49) Обработка коррозионной среды с целью снижения коррозионной активности.
Примерами такой обработки могут служить: нейтрализация или обескислороживание коррозионных сред, а также применение различного рода ингибиторов коррозии, которые в небольших количествах вводятся в агрессивную среду и создают на поверхности металла адсорбционную пленку, тормозящую электродные процессы и изменяющую электрохимические параметры металлов.
Ингибиторы коррозии – вещества, которые, находясь в коррозионной среде в достаточной концентрации, сильно замедляют либо вообще прекращают коррозионное разрушение металла . Ингибитором коррозии может быть как одно соединение, так и смесь нескольких.
Эффективность действия ингибиторов коррозии можно оценить по двум показателям: степени защиты (Z, %) и коэффициенту торможения коррозии γ (защитный эффект ингибитора).
Формула для определения степени защиты Z:
Z = [(K1– K2)/K1]•100 = [(i1 – i2)/i1]•100,
где K1, K2 – скорость коррозии (растворения) металла в среде без ингибитора и с ним [г/(м2•ч)];
i1, i2 – плотность коррозионного тока в неингибируемой среде и ингибируемой, соответственно [А/см2].
Значение Z равно 100% тогда, когда металл полностью защищен, скорость коррозии сводится к 0.
Защитный эффект ингибитора рассчитывается по формуле:
γ = K1/K2 = i1/i2.
Коэффициент торможения показывает, во сколько раз под действием ингибитора уменьшается скорость коррозии.
Между коэффициентом торможения и степенью защиты существует связь, определяющаяся формулой:
Z = (1 – 1/ γ)•100.
Классификация ингибиторов коррозии
По типу среды ингибиторы коррозии различают:
- ингибиторы нейтральных коррозионных сред;
- атмосферной коррозии;
- ингибиторы кислых сред;
- сероводородной коррозии;
- ингибиторы нефтяных сред.
В разных коррозионных средах один и тот же ингибитор может вести себя совершенно по-разному.
Классификация ингибиторов коррозии по механизму действия:
- пассивирующие ингибиторы;
- адсорбционные ингибиторы.
По характеру защитного действия различают ингибиторы анодные, катодные, смешанные.
По химической природе ингибиторы делятся на: летучие, органические, неорганические.
(((Адсорбционные ингибиторы коррозии адсорбируются на поверхности защищаемого изделия, образуя пленку, и тормозят электрохимические реакции. Иногда достаточно образование тонкой мономолекулярной пленки. Адсорбционными ингибиторами чаще всего являются ПАВ (поверхностно-активные вещества), а также органические соединения. При воздействии на изделие они дополнительно усиливают защитные свойства оксидной пленки. Поэтому можно сделать вывод, что наличие в коррозионной среде кислорода способствует увеличению защитного эффекта адсорбционных ингибиторов коррозии. Если же оксидная пленка неустойчива - затрудняется адсорбция ингибитора на поверхности металла, кислород дополнительного влияния не оказывает.
Пассивирующие ингибиторы коррозии играют важную роль при образовании на поверхности металла защитной пленки, которая пассивирует ее. Пассиваторами чаще всего являются неорганические соединения, обладающие окислительными свойствами (нитриты, молибдаты, хроматы). При обработке поверхности этими веществами коррозионный потенциал сдвигается к положительной стороне. Пассивирующие соединения считаются более эффективными, чем большая часть непассивирующих.
Неорганические ингибиторы коррозии используются чаще всего. К ним относятся некоторые пассиваторы, катодные, анодные, пленкообразующие ингибиторы и т.д. Ингибирующий эффект таких соединений можно объяснить их составом. Некоторые анионы (PO43-, NO2-, CrO42-, SiO32-, Cr2O72-), а также катионы (Ni2+, Са2+, As3+, Sb3+, Zn2+, Bi3+) способствуют уменьшению скорости коррозионного процесса.
К неорганическим ингибиторам коррозии относятся фосфаты, бихроматы, хроматы, нитриты, полифосфаты, силикаты и т.д.
Органические ингибиторы коррозии считаются веществами смешанного действия. Они замедляю катодную и анодную реакции. Очень часто их используют при кислотном травлении. При этом различные загрязнения, ржавчина, окалина удаляются с поверхности, а основной металл не растворяется. Защитный эффект органических ингибиторов зависит от их концентрации, температуры, природы соединений.
Чаще всего в состав органических ингибиторов входит кислород, азот, сера. Они адсорбируются исключительно на поверхности металла. К органическим ингибиторам относятся некоторые летучие, амины, органические кислоты и их соли, меркаптаны (тиолы) и др)))
50) Топливный элемент — электрохимическое устройство, подобное гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне[1] — в отличие от ограниченного количества энергии, запасенного в гальваническом элементе или аккумуляторе.
Топливный элементы осуществляют прямое превращение энергии топлива в электричество минуя малоэффективные, идущие с большими потерями, процессы горения. Это электрохимическое устройство в результате высокоэффективного «холодного» горения топлива непосредственно вырабатывает электроэнергию.
Естественным топливным элементом является митохондрия
