
- •Классификация ингибиторов коррозии
- •Основные виды тэ
- •Теплота сама собой не может переходить от более холодного тела к более нагретому
- •Невозможно превратить какое- либо количество теплоты в работу без того , чтобы часть тепла не была растрачена при более низкой температуре :
- •В изолированных системах самопроизвольно идут только те процессы , которые ведут к увеличению неупорядоченности системы ,т.Е к росту энтропии
- •28. Свойства истинных растворов. Способы выражения концентрации: массовая доля, молярная, молярная эквивалента, титр, моляльная, мольная доля, взаимосвязь между концентрациями.
- •29. Растворы электролитов. Механизмы электролитической диссоциации веществ с ионной и ковалентной полярной связью. Ступенчатая диссоциация.
- •30. Растворы слабых электролитов. Степень диссоциации. Константа диссоциации. Закон разбавления Оствальда.
- •32.Кислотно-основные свойства веществ с точки зрения электролитической диссоциации. Ионное произведение воды. Водородный и гидроксидный показатели. Индикаторы.
- •36. Общие закономерности электрохимических процессов. Возникновение электродного потенциала. Шкала стандартных электродных потенциалов. Типы электродов.
36. Общие закономерности электрохимических процессов. Возникновение электродного потенциала. Шкала стандартных электродных потенциалов. Типы электродов.
Эл хим проц – прямое и обр превращ хим энерг в электрич. Система состоит из 2х эл-дов и ионного проводника между ними. Эл-ды замыкаются мет проводником. Ион пров 2го рода-рас-ры и расплавы эл-тов, тверд эл-ты. Эл-ды – пров, имеющие эл-ю проводимость(пров 1-го рода), находящиеся в контакте с ион проводником., ТД и Кинетика эл-хим проц -общ зак-ти- З-н Фарадея :1. Кол-во в-ва, испытавшего эл-хим превращ на эл-де, прямо пропорц кол-ву прошедш эл-ва. 2. Массы прореаг на эл-дах в-в при пост кол-ве эл-ва относятся друг к другу,как хим эквиваленты. На зак-х Фарад основаны счетчики кол-ва эл-ва. Эл-е потенц – на границе мет-р-р –двойной эл слой – разность потенциалов. Ионы переходят в р-р с пов-ти мет,и обратно.Если мет пласт в р-р своей соли,то быстрее будет равновесие. Потенциал (в усл равновесия электр р-и)-равновесный. Нельзя точно опред абсол знач пот. Для харектеристики эл проц – разность потенциалов берут. Станд эл потенц – равновесн эл пот, возникающий на границе мет-р-р пластинки, погруженной в р-р соли (своей-сил эл-ты) –активностью 1 при н.у. измеренный к водор электроду, потенц к-го принят=0. Если расположить мет в порядке возраст их электродн потенциалов – шкалу станд эл пот. Электроды – газовые с Pt-проводник эл тока.(водородные эл-ды, кислородн,хлорные), металлич., амальгамные эл-ды(мет в ртути)
37.
Уравнение Нернста для газовых электродов.
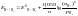
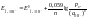
Газовые электроды, состоят из химически инертного металла (обычно Pt), к которому подводится электрохимически активный газ (напр., Н2 или Сl2). Молекулы газа адсорбируются на поверхности металла, распадаясь на адсорбированные атомы, которые непосредственно участвуют в переносе электронов через границу раздела фаз. Водородный электрод. Потенциал газовых электродов зависит как от активности восстановленной, так и окисленной формы вещества. Концентрация газообразного вещества по закону Генри прямо пропорциональна его давлению над раствором. Поэтому в формулу Нернста вместо его концентрации подставляют парциальное давление. Анализируя уравнение электродного потенциала для водородного электрода, можно сделать вывод, что потенциал водородного электрода линейно увеличивается с уменьшением водородного показателя рН (ростом кислотности) среды и уменьшением парциального давления газообразного водорода над раствором. Потенциал кислородного электрода линейно увеличивается с уменьшением рН раствора и увеличением парциального давления газообразного кислорода над ним.
38.
Гальванический элемент. Условия работы гальванического элемента основаны на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока.
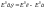 Способы
расчёта ЭДС:
Способы
расчёта ЭДС:
1)

2)
Гальванический элемент Даниэля-Якоби - гальванический элемент составленный их стандартного медного и цинкового электродов, погруженные в растворы своих солей.
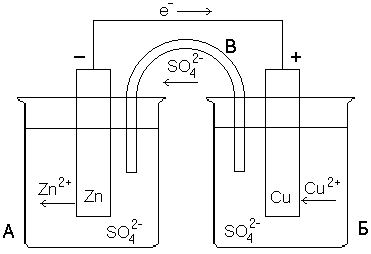
39) Концентрационный гальванический элемент - такой элемент, в котором электроды изготовлены из одного материала (одного металла), но погружены в растворы с разной концентрацией потенциалопределяющих ионов. Тем самым согласно уравнению Нернста равновесные потенциалы этих электродов будут различаться, что делает возможным работу гальванического элемента, хотя ЭДС таких элементов невелика.
Концентрация потенциалопределяющих ионов в анодной зоне гальванического элемента меньше, чем в катодной зоне. В схеме концентрационных ГЭ рекомендуется указывать значение соответствующих концентраций электролита.
ЭДС этих элементов обычно очень мала. Концентрационные элементы используются при определении pH и концентраций труднорастворимых солей.
