- •Классификация ингибиторов коррозии
- •Основные виды тэ
- •Теплота сама собой не может переходить от более холодного тела к более нагретому
- •Невозможно превратить какое- либо количество теплоты в работу без того , чтобы часть тепла не была растрачена при более низкой температуре :
- •В изолированных системах самопроизвольно идут только те процессы , которые ведут к увеличению неупорядоченности системы ,т.Е к росту энтропии
- •28. Свойства истинных растворов. Способы выражения концентрации: массовая доля, молярная, молярная эквивалента, титр, моляльная, мольная доля, взаимосвязь между концентрациями.
- •29. Растворы электролитов. Механизмы электролитической диссоциации веществ с ионной и ковалентной полярной связью. Ступенчатая диссоциация.
- •30. Растворы слабых электролитов. Степень диссоциации. Константа диссоциации. Закон разбавления Оствальда.
- •32.Кислотно-основные свойства веществ с точки зрения электролитической диссоциации. Ионное произведение воды. Водородный и гидроксидный показатели. Индикаторы.
- •36. Общие закономерности электрохимических процессов. Возникновение электродного потенциала. Шкала стандартных электродных потенциалов. Типы электродов.
Основные виды тэ
Есть различные типы ТЭ-топливных элементов. Их обычно классифицируют по используемому топливу, рабочему давлению и температуре, а также по характеру применения.
классификация топливных элементов по типу электролита как среды для внутреннего переноса ионов (протонов). Электролит между электродами определяет операционную температуру и от этой температуры зависит тип катализатора.
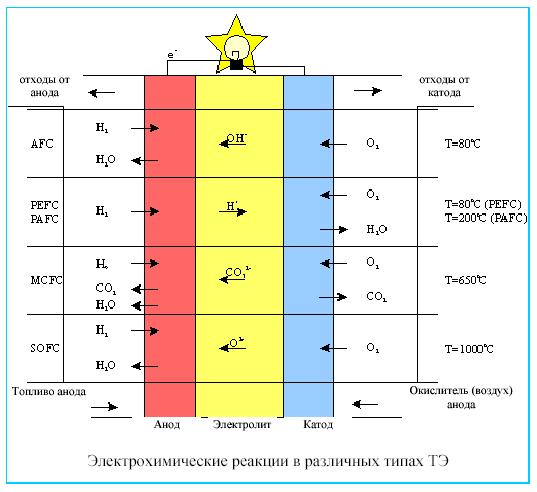
Водород считается основным источником топлива для ТЭ-топливных элементов, однако процесс преобразования топлива позволяет извлекать водород и из других его видов, включая метанол, природный газ, нефть и др.
В отличии от аккумулятора и батареек, ТЭ-топливные элементы не истощается и не требует перезарядки; он работает, пока подается топливо.
Щелочной ТЭ (AFC) |
Электролит состоит из жидкого KOH, который циркулирует в пространстве между электродами. Они использовались с середины 1960-х годов в космических программах, обеспечивая питанием электрические системы космических кораблей "Буран", "Шаттл" и др. Коммерческое применение их ограничено, т.к. они должны работать с чистыми водородом и кислородом (либо с кислородом воздуха, из которого удален углекислый газ). Щелочные ТЭ имеют КПД до 70% |
ТЭ на протонообменной мембране (PEMFC) |
В качестве электролита используется твердая полимерная мембрана (тонкая пластмассовая пленка), которая проводит водородные ионы (протоны) с анода на катод. Они обеспечивают высокую плотность тока, что позволяет уменьшать их вес, стоимость, объем и улучшать качество работы. Неподвижный твердый электролит упрощает герметизацию в процессе производства, уменьшает коррозию, и обеспечивает более долгий срок службы ТЭ. Эти ТЭ работают при низких температурах (ниже 100 С), что ускоряет запуск и реакцию на изменения потребности в электричестве. Они идеально подходят для транспорта и стационарных установок небольшого размера. |
ТЭ на фосфорной кислоте (PAFC) |
Электролитом является бумажная матрица, насыщаемая фосфорной кислотой, также проводящей протоны. Это наиболее разработанные коммерчески развитые ТЭ. Они применяются в стационарных электрогенераторных устройствах в зданиях, гостиницах, больницах, аэропортах и электростанциях. ТЭ на фосфорной кислоте вырабатывают электричество с КПД более 40% или около 85%, если пар, который производит этот ТЭ, используется для совместного производства тепла и электричества (в сравнении с 30% КПД наиболее эффективного двигателя внутреннего сгорания). |
ТЭ на расплаве карбоната (MCFC) |
Использует расплавленную смесь лития/калия (или лития/натрия) для проведения ионов карбоната от катода к аноду. Рабочая температура - приблизительно 650 C, что позволяет использовать топливо напрямую, без какой-либо дополнительной его подготовки, и никель в качестве катализатора. Их конструкция более сложна, чем конструкция ТЭ на фосфорной кислоте, из-за их более высокой рабочей температуры и использования расплава электролита. Им требуется существенное количество времени для того, чтобы они достигли рабочей температуры и смогли реагировать на изменения в потребности в электричестве, и поэтому лучше всего они подходят для условий, где необходима постоянная подача больших количеств электроэнергии. Наибольшее количество подобных установок построено в США и Японии. В США имеется демонстрационная опытная электростанция мощностью 1.8 МВт. |
ТЭ на твердых оксидах (SOFC) |
В качестве электролита используется твердый керамический материал (стабилизированная иттрием окись циркония), которая проводит атомы кислорода от катода к аноду при чрезвычайно высокой температуре - свыше 1000 C. Это позволяет им использовать относительно загрязненные виды топлива, например, получаемые при газификации угля. Энергетический КПД – около 60%. Их относительно простая конструкция (обусловленная использованием твердого электролита и самых разных видов топлива) в сочетании с существенным количеством времени, необходимым для того, чтобы они достигли рабочей температуры и смогли реагировать на изменения в потребности в электричестве, делает их подходящими для больших и очень больших стационарных электрогенераторных установок и электростанций |
Отличием ТЭ от гальванического элемента является то, что восстановитель и окислитель не заложены заранее в элемент, а непрерывно подводятся к электродам в процессе работы. В связи с этим электроды элемента в процессе работы не изменяются, и ТЭ в принципе может работать непрерывно, пока подводятся реагенты и выводятся продукты реакции, в то время как гальванические элементы могут работать ограниченное время, определенное запасом активных реагентов.
Реакция окисления водорода
2H2 + O2 = 2H2O
в ТЭ протекает через электроокисление водорода на аноде
2H2 + 4ОН- 4е =4H2O
и электровосстановление кислорода на катоде
O2 + 2H2O + 4е =4ОН-
СНОВНЫЕ ПРОБЛЕМЫ ТЭ
Как и любой источник тока, ТЭ характеризуются напряжением, мощностью и сроком службы. Напряжение U топливного элемента ниже ЭДС из-за омического сопротивления электролита и электродов R и поляризации катода DЕк и анода DЕа
U = Eэ - IR - (DЕк + DЕа),
где I - сила тока.
Поляризация электродов обусловлена замедленностью процессов, протекающих на электродах, и равна разности потенциалов электрода под током ЕI и при отсутствии тока ЕI = 0
DЕ = EI - ЕI = 0 .
Поляризация электродов возрастает с увеличением плотности тока i, то есть тока, отнесенного к единице площади поверхности электрода S :
При одном и том же токе можно снизить плотность тока и поляризацию, применяя пористые электроды, имеющие высокоразвитую поверхность (до 100 м2/г). В пористом электроде осуществляется контакт газа (реагента), электролита (ионного проводника) и электронного проводника. Процессы в пористых электродах достаточно сложны.
Для ускорения реакций в пористые электроды вводят катализаторы. К катализаторам ТЭ предъявляются требования высокой активности, длительного срока службы и приемлемой стоимости. Выбор катализатора определяется как этими требованиями, так и видами ТЭ и топлива, рабочей температурой и областями применения ТЭ. Наиболее широкое использование нашли платина, палладий, никель и некоторые полупроводниковые материалы. Пористые электроды представляют собой сложную структуру, в которой протекают электрохимические реакции, подводятся и отводятся ионы и электроны, подводятся реагенты, отводятся продукты реакции и тепло. Эти процессы рассматриваются в теории пористых электродов (макрокинетике электродных процессов), которая позволяет оптимизировать их структуру и толщину [6].
В соответствии с уравнением (6) напряжение ТЭ снижается с увеличением тока. Зависимость напряжения ТЭ от тока получила название вольт-амперной характеристики. Напряжение большинства ТЭ лежит в пределах 0,8-0,9 В. Реальный КПД топливного элемента hp ниже теоретического и определяется по уравнению
где np - реальное количество электронов на молекулу реагента.
Величина np ниже n уравнения (5) в связи с неполным использованием реагентов и их расходом на собственные нужды установок с ТЭ. Как видно, все факторы, увеличивающие напряжение (см. уравнение (6)), повышают КПД.
От напряжения также зависит и мощность Р :
Р = UI,
51)Аккумулятор Это устройство, в которых происходит превращение химической энергии в электрическую и наоборот. Под действием внешнего тока в аккумуляторе происходит накопление энергии в виде энергии химических связей - это процесс зарядки аккумулятора, а процесс превращения накопленной хим. энергии - это процесс разряда аккумулятора. При заряде работает как электролизер, а при разряде как ГЭ. Но в обоих случаях на аноде происходит окисление, а на катоде восстановление.
Устройство кислотного (свинцового) аккумулятора.
Аккумулятор состоит: пластмассовый бачок, в котором расположена ряды электродов в идее свинцовых решеток, в который запрессован оксид свинца. Аккумулятор заполнен электролитом, т.е. серной кислотой с концентрацией 30-40%.
Pb+H2S04=PbS04+H20
При заряде аккумулятора происходит след. Процессы:
А(+) РЬ2+-2е=РЬ4+
PbS04-2e+2H20=Pb02+2H++H2S04
К(-) Pb2++2e=Pb° PbS04+2e=Pb°+S04-
При разряде аккумулятора электроды меняются местами: . А(-) РЬ° - 2е=РЬ2+
К(+) РЬ4++2е=РЬ2+
ТОР: 2PbSO4+2H2O=Pb0+PbO2+2H2SO4
Плюсы: простота устройства и дешевизм, высокий КПД=80%, высокая ЭДС.
Минусы: тяжелый, невысокая удельная энергия, при хранении склонны к саморазряду, взрывоопасны, при долгой работе и неправильном эксплуатировании происходит необратимое изменении активной массы (сульфитация электродов), экологический проблемы.
52) Химическими источниками тока (ХИТ) называются устройства, в которых химическая энергия активных веществ превращается в электрическую. В современных средствах связи химические источники тока широко применяются в качестве основных и резервных источников питания.
Пo характеру работы все известные ХИТ делятся па две группы: первичные и вторичные.
Первичные химические источники тока допускают лишь однократное использование заключенных в них активных веществ. К им относятся элементы следующих типов: марганцево-цинковые и медно-магниевые. Кроме того, первичные ХИТ делятся на две труппы по виду электролита: на элементы с жидким электролитом и сухие элементы, содержащие вязкий невыливающийся электролит.
Вторичные химические источники тока - электрические аккумуляторы - допускают многократное использование.
Работоспособность аккумуляторов восстанавливается их зарядом, т.е. пропусканием постоянного тока через аккумулятор в направлении, противоположном направлению тока разряда. Работа аккумулятора состоит из чередующихся между собой зарядов и разрядов. Разрядом называют процесс превращения химической энергии в электрическою. Один заряд и один разряд составляют рабочий цикл
Марганцево-цинковые элементы и батареи имеют сравнительно малую стоимость, сохраняют работоспособность в широком диапазоне температур, просты в эксплуатации и хранении, находят широкое применение в качестве источников питания телефонной, измерительной и различного рода вспомогательной аппаратуры и приборов.
Марганцево-цинковый элемент — это первичный химический источник тока, в котором катодом является двуокись марганца MnO2 (пиролюзит) в смеси с графитом (около 9,5 %), анодом – металлически цинк Zn, электролитом - желеобразный раствор Хлористого Аммония с добавкой различных загустителей для увеличения вязкости.
При работе элемента цинк окисляется:
2Zn-4e- = 2Zn2+.
Часть образующихся ионов цинка связывается молекулами аммиака в комплексный ион:
Zn2++4NH3 = [Zn(NH3)4]2+.
Молекулы аммиака образуются в растворе вследствие гидролиза иона аммония:
4NH4++4H2O = 4HN3+4H3O+.
Электроны, получающиеся при окислении цинка, по внешней цепи переходят к диоксиду марганца, который при этом восстанавливается:
4MnO2+4H3O++4e- = 4MnO(OH)+4H2O.
Если сложить все 4 уравнения, то получится ОВР, идущая в элементе:
2Zn+4MnO2+4NH4+ = =Zn2++[Zn(NH3)4]2++4MnO(OH).
У стройство
марганцово-цинкового сухого элемента:
стройство
марганцово-цинкового сухого элемента:
<!--[endif]-->2
(1) — металлической колпачок, (2) — графитовый стержень, (3) — цинковый корпус, (4) — влажная паста из хлорида аммония, диоксида марганца, и графитовой крошки, (5) — металлический контакт.
53) Электрохимическими преобразователями, или хемотронами, называют приборы и отдельные элементы устройств, принцип действия которых основан на законах электрохимии. Электрехимические системы такого рода выполняют роль диодов, датчиков, интеграторов, запоминающих устройств и соответственно выполняют функции выпрямления, усиления и генерирования электрических сигналов, измерения неэлектрических величин и др. В хемотронах происходят процессы преобразования электрической энергии в химическую, а так же механической энергии в электрическую и др
Счетчик(интегратор) предназначен для определения количества прошедшего электричеств. состоит из платинового анода и катода и раствора электролита меж ними в кач-ве электролита=водный раствор KI+I2


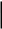
IiII
I2 K++I- I2 K++I-
схема хемотронного интегратора
К(-) I2+2e-=2I-
A
 (+)
2I—2e-=I2
(+)
2I—2e-=I2
1 2 3
Схема счетчика времени
1-катод 2- раствор электролита
3-анод
Предназначен для определения прошедшего количества электричества. также для используются как счетчик времени.

Схема хемотронного диода
Достоинство их заключается в :простоте ,высокой чувствительности ,малом потреблении энергии, малая цена и размеры.
Недостатки невозможность работы хемотронов на токах с высокой частотой, при напряжении выше 1В, а также их инерционность.
54) Высокомолекулярные соединения – химические соединения с молекулярной массой от нескольких тысяч до нескольких миллионов. Подавляющее большинство высокомолекулярных соединений составляют полимеры
ОЛИГОМЕРЫ — полимеры сравнительно небольшой молекулярной массы. К олигомерам относятся многие синтетические смолы феноло формальдегидные, эпоксидные, полиэфирные и др., а также некоторые природные вещества, напр. гормон окситоцин
Полимеры - это своеобразные химические соединения с высокой молекулярной массой (от нескольких тысяч до многих миллионов), молекулы которых (макромолекулы) состоят из большого числа повторяющихся группировок (мономерних звеньев). Атомы, входящие в состав макромолекул, соединены друг с другом силами главных и (или) координационных валентностей
Полимеризация - реакция образования полимеров путем последовательного присоединения молекул низкомолекулярного вещества (мономера). В качестве мономеров используются соединения с кратными связями: С = С, С = О, С = С = С, С = N или с циклическими группами, способными раскрываться. В процессе полимеризации происходит разрыв кратных связей или раскрытие циклов у мономеров и возникновение химических связей между группами с образованием макромолекул.
n CH2 = CH2 + n CH2 = CH2 → (- CH2 - CH2 - CH2 - CH2 -)n этилен полиэтилен
n
CH2
= CH
- C6H5
→
![]() стирол
полистирол
стирол
полистирол
H2C = CH - CH = CH2 → ( - CH2 - CH = CH - CH2 - )n бутадиен бутадиеновый каучук
По числу видов участвующих мономеров различают гомополимеризацию (один вид мономера) и сополимеризацию (два и и более видов мономеров).
nСН2 = СН - СН = СН2 + nСН2 = СН - С6Н5 → ( - СН2 - СН = СН - СН2 - СН2 - СН - С6Н5)n
Поликонденсация - реакция синтеза полимера из соединений, имеющих две и более функциональные группы, сопровождающаяся образованием низкомолекулярных продуктов (Н2О, NH3, HCl, CH2O). Например, поликонденсация фенола с формальдегидом с образованием фенолформальдегидных смол.
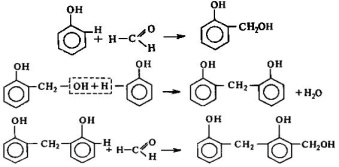
Методом
поликонденсации получают ~1/4 часть
выпускаемых полимеров, например, капрон
(связи - NH
- CO
-), найлон ( - NH
- (CH2)6
- NH
- CO
- (CН2)4
- CO
- )n,
полисилоксаны
![]()
Тип конфигурации |
Строение цепи |
Линейные макромолекулы |
|
Двухтяжевые макромолекулы лестничные спирополимеры |
|
|
|
Разветвленные макромолекулы |
|
статистические |
|
гребнеобразные |
|
звездообразные |
|
Сшитые (сетчатые) |
|
в плоскости (паркетные) |
|
в пространстве |
|
СТЕПЕНЬ ПОЛИМЕРИЗАЦИИ - это величина наряду с молекулярной массой, с возрастанием которых до определенной степени, возрастают механические свойства материала и тем самым улучшаются его эксплуатационные характеристики. Растет температура плавления термопластов и улучшается их химическая стойкость, но при этом понижается текучесть расплавов, имеющая большое значение для процессов переработки. Например, сверхвысокомолекулярный полиэтилен уже не может быть переработан литьем под давлением или экструзией, а только прессованием или спеканием.
19.Скорость химической реакции определяется количеством вещества, прореагировавшего в единицу времени в единице объема.
Выявление механизма реакции — установление элементарных стадий процесса и последовательности их протекания (качественные изменения). Зависимость скорости гомогенных реакций от концентрации (закон действующих масс). Влияние концентрации реагирующих веществ может быть объяснено из представлений, согласно которым химическое взаимодействие является результатом столкновения частиц. Увеличение числа частиц в заданном объеме приводит к более частымих столкновениям, т. е. к увеличению скорости реакции. Количественно зависимость между скоростью реакции и молярными концентрациями реагирующих веществ описывается основным законом химической кинетики — законом действующих масс. Скорость химической реакции при постоянной температуре прямо пропорциональна произведению концентраций реагирующих веществ.
Влияние концентраций веществ на скорость химической реакции
Чтобы вещества прореагировали, необходимо, чтобы их молекулы столкнулись. Очевидно, что вероятность столкновения молекул прямо пропорциональна количеству молекул реагентов в единице объема, т.е. молярным концентрациям реагентов.
В середине XIX в. (1865 г. – Н.Н. Бекетов, 1867 г. – К. Гульдберг, П. Вааге) был сформулирован основной постулат химической кинетики, называемый также законом действующих масс: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных коэффициентам перед формулами веществ в уравнении реакции: υ = k [A]а * [B] b, для реакции aA + bB = cC + dD, где υ – скорость химической реакции; [А] – концентрация вещества А; [В] – концентрация вещества В; k – константа скорости реакции (коэффициент пропорциональности); а и b – коэффициенты в уравнении реакции.
Если [А]= [В]= 1 моль/л, то скорость химической реакции (υ) равна константе (k). Константа скорости реакции зависит от природы реагирующих веществ, температуры, но не зависит от концентрации вещества.
Например, напишем кинетическое уравнение для реакции синтеза аммиака
N2 (г) + 3 H2 (г) ↔ 2 NH3 (г): υ = k [N2] * [H2] 3.
В закон действующих масс не входят концентрации твердых веществ, т. к. реакции с твердыми веществами протекают на их поверхности, где «концентрация» вещества постоянна. Влияние поверхности соприкосновения реагентов на скорость химической реакции.Скорость гетерогенной реакции прямо пропорциональна площади поверхности соприкосновения реагентов. Но в этом определении есть нюансы. Твердые вещества, участвующие в гетерогенной реакции, для увеличения скорости взаимодействия измельчают, чтобы увеличить площадь поверхности частиц. Например, уголь для приготовления пороха растирают в порошок. Жидкость для реакции с газом распыляют в мельчайшие капельки: так, дизельное топливо (смесь углеводородов) впрыскивают в камеру, где оно встречается с воздухом, через специальное устройство, обеспечивающее распыление.
20. Влияние температуры на скорость химической реакции
При повышении температуры скорость химических реакций обычно возрастает. Это объясняется теорией активации: энергия необходимая для активирования молекул, называется энергией активации (Е акт).
С повышением температуры увеличивается число активных молекул, поэтому увеличивается скорость реакции.
Зависимость скорости химической реакции от температуры определяется правилом Вант-Гоффа: при повышении температуры на 10оС скорость большинства химических реакций увеличивается в 2–4 раза. Это правило математически выражается следующей формулой:
![]() .где
γ
– температурный коэффициент, который
показывает, во сколько раз увеличивается
скорость реакции при повышении
температуры на 10оС.
.где
γ
– температурный коэффициент, который
показывает, во сколько раз увеличивается
скорость реакции при повышении
температуры на 10оС.
Энергия,
необходимая для перехода вещества в
состояние активированного комплекса
называется энергией активации.
Возможность образования активированного
комплекса, а соответственно и химического
взаимодействия, определяется энергией
молекул. Молекула, энергия которого
достаточна для образования активированного
комплекса, называется активной. Доля
их в системе зависит от температуры.
Чем выше энергия активации, тем очевидно,
меньше доля частиц, способных к активному
взаимодействию. Экзотермические реакции
протекают с меньшей энергией активации,чем
эндотермические. Высокая энергия
активации, или как инога говорят,высокий
энергетический барьер является причиной
того, что многие хим. Р. При невысоких
темпер. Не протекают, хотя и принципиально
возможны (del
G<0)Так,
в обычных условиях самопроиз. Не
загораются: дерево, ткани,бумага,уголь,хлеб,хотя
энергия Гиббса реак. Окис. Этих веществ
ниже (delG<0).
Уравнение Аррениуса - устанавливает
зависимость константы скорости химической
реакции ![]() от температуры
от температуры ![]()
![]()
где A-предэкспоненциальныи множитель (размерность совпадает с размерностью к), Еа -энергия активации, обычно принимающая положит. значения, Т-абс. т-ра, k-постоянная Больцмана. Принято приводить Еа в расчете не на одну молекулу, а на число частиц NA = 6,02*1023 (постоянная Авогадро) и выражать в кДж/моль; в этих случаях в Аррениуса уравнении величину k заменяют газовой постоянной R. График зависимости 1nк от 1/kT (аррениусов график)-прямая линия, отрицат. наклон к-рой определяется энергией активации Еа и характеризует положит. температурную зависимость к.
Аррениуса уравнение применимо к мн. сложным р-циям; в этих случаях Еа обычно наз. кажущейся энергией активации. Для нек-рых сложных р-ций аррениусов график представляет собой кривую линию; если его используют для определения величин А и Еа, необходимо указывать соответствующие концентрационный и температурный интервалы.
21. КАТАЛИЗ - процесс, заключающийся в изменении скорости
химических реакций в присутствии веществ, называемых катализаторами.Кроме способности ускорять реакции,многие катализаторы обладают селективностью(избирательностью).Под влиянием катализаторов реакции могут протекать избирательно, т. е . с увеличением выхода определённых продуктов. Например, этанол в присутствии оксидов алюминия и тория разлагается на этилен и воду.
Катализаторы - вещества, изменяющие скорость химической реакции, которые могут участвовать в реакции, входить в состав промежуточных продуктов, но не входят в состав конечных продуктов реакции и после окончания реакции остаются неизменными.
Каталитические реакции - реакции, протекающие в присутствии катализаторов.
Положительным называют катализ, при котором скоость реакции возрастает, отрицательным (ингибированием) - при котором она убывает. Примером положительного катализа может служить процесс окисления аммиака на платине при получении азотной кислоты. Примером отрицательного - снижение скорости коррозии при введении в жидкость, в которой эксплуатируется металл, нитрита натрия, хромата и дихромата калия.
Катализаторы, замедляющие химическую реакцию, называются ингибиторами.
В зависимости от того, находится катализатор в той же фазе, что и реагирующие вещества, или образует самостоятельную фазу, говорят о гомогенном или гетерогенном катализе.
Примером гомогенного катализа является разложение пероксида водорода в присутствии ионов йода. Реакция протекает в две стадии:
Н О + I = H O + IO
Н O + IO = Н O + O + I
При гомогенном катализе действие катализатора связано с тем, что он вступает во взаимодействие с реагирующими веществами с образованием промежуточных соединений, это приводит к снижению энергии активации.
При гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела - катализатора, поэтому активность катализатора зависит от величины и свойств его поверхности. На практике катализатор обычно наносят на твердый пористый носитель. Механизм гетерогенного катализа сложнее, чем у гомогенного.
Механизм гетерогенного катализа включает пять стадий, причем все они обратимы.
1. Диффузия реагирующих веществ к поверхности твердого вещества.
2. Физическая адсорбция на активных центрах поверхности твердого вещества реагирующих молекул и затем хемосорбция их.
3. Химическая реакция между реагирующими молекулами.
4. Десорбция продуктов с поверхности катализатора.
5. Диффузия продукта с поверхности катализатора в общий поток.
Примером гетерогенного катализа является окисление SO в SO на катализаторе V O при производстве серной кислоты (контактный метод).
Промоторы (или активаторы) - вещества, повышающие активность катализатора. При этом промоторы могут сами и не обладать каталитическими свойствами.
22.Химическим равновесием называется такое состояние химической системы, при котором количества исходных веществ и продуктов не меняются со временем.
Если на равновесную систему воздействовать извне, изменяя какой-нибудь из факторов, определяющих положение равновесия, то в системе усилится то направление процесса, которое ослабляет это воздействие.
Зависимость константы равновесия реакции от температуры может быть описана уравнением изобары химической реакции (изобары Вант-Гоффа):
![]()
и изохоры химической реакции (изохоры Вант-Гоффа):
![]()
Здесь ΔH и ΔU — тепловой
эффект реакции,
протекающей, соответственно, при
постоянном давлении или при постоянном
объёме. Если ΔH >
0 (тепловой
эффект положителен, реакцияэндотермическая),
то температурный коэффициент константы
равновесия ![]() тоже
положителен, то есть с ростом температуры
константа равновесия эндотермической
реакции увеличивается, равновесие
сдвигается вправо (что вполне согласуется
с принципом
Ле Шателье).
тоже
положителен, то есть с ростом температуры
константа равновесия эндотермической
реакции увеличивается, равновесие
сдвигается вправо (что вполне согласуется
с принципом
Ле Шателье).
Принцип Ле Шателье — Брауна (1884 г.) — если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура,давление, концентрация), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
23. Положение хим.рав. зависит от следующих параметров реакции: температуры, давления, и концентрации. Влияние,которое оказывают эти факторы на хим. Реак.,подчиняются закономерности, которая была высказана в общем виде в 1885 г французским учёным Ле-Шателье.
1)температура: при увеличение темпер. Хим. Равн. Смещается в сторону эндотермической (поглощение)реакции, а при понижении в сторону экзотермической (выделение) реакции. CaCO3=CaO+CO2 –Q t ↑ →, t↓ ← . N2+3H2-2NH3 +Q t↑ ←, t↓→
2)давление: при увеличении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении в сторону большего объёма.
СaCO3=CaO+CO2 P↑←, P↓→ 1моль=1моль+1моль
3)концентрация исходных веществ и продуктов реакции. При увеличении концентрации одного из исходных веществ хим. Равн. Смещается в сторону продуктов реакции,а при уменьш. Конц. Прод. Реак. В сторону исход веществ. S2+2O2=2SO2 [S],[O] ↑→,[SO2] ↑←
Агрегатное состояние составных частей(до образования смеси) |
Гомогенная смесь (гомогенная система) |
Гетерогенная смесь (гетерогенная система) |
Твёрдое-твёрдое |
Тв растворы,сплавы, (напр латунь, бронза) |
Горные породы (напр гранит,минералосодержащ руды и др) |
Тв- жид |
Жид растворы (напр, водные растворы солей) |
Тв в жидком-суспензии или взвеси(напр, частицы глины в воде,коллоидные растворы) Жид в тв- жидкость в пористых телах(напр,почвы,грунты) |
Тв-газообразное |
Хемосорбированный водород в платине,палладии, сталях) |
Тв в газообраз – порошки,аэрозоли,в том числе дым,пыль,смог) Газообраз в тв- пористые материалы (напр,кирпич,пемза) |
Жидкое-твёрдое |
Тв жидкости(стекло-тв,но всё же жидкость) |
Может принемать разную форму и фиксировать её(напр,посуда-разной формы и цвета) |
Жидкое-жидкое |
Жид растворы(уксус-раствор уксусной кислоты в воде) |
Двух- и многослойные жидкие системы, эмульсии(молоко- капли жидкого жира в воде) |
Жид-газообразное |
Жид растворы(раствор диоксида углерода в воде) |
Жидкое в газообразном- аэрозоли жидкости в газе,в том числе туманы |
Газообразное-газобразное |
Газовые растворы( смеси люб. Количеств |
|
24)
Сольватация взаимод. молекул растворенного в-ва (или их ассоциатов) с молекулами р-рителя. Приводит к изменению св-в молекул в р-ре (в сравнении со св-вами газовой фазы), влияет на все физ. и физ.-хим. процессы, протекающие в р-рах, в т. ч. определяет скорость реакций в растворах и положение равновесия, а в ряде случаев и их механизм. С. в водных средах часто наз. гидратацией. Наиб. интенсивна С. ионов врастворах электролитов.С. состоит в том, что молекула растворенного в-ва оказывается окруженной сольватной оболочкой, состоящей из более или менее тесно связанных с ней молекул р-рителя. В результате С. образуются сольваты-мол. образования постоянного или переменного состава. Время жизни соль-ватов определяется характером и интенсивностью межмолекулярных взаимодействий; даже в случае сильного взаимод. время жизни отдельного сольвата мало из-за непрерывного обмена частицами в сольватной оболочке. В соответствии с типами межмол. взаимод. выделяют неспецифическую и специфическую С. Неспецифическая С. обусловлена ван-дер-ваальсовыми взаимод., специфическая С. проявляется гл. обр. вследствие электростатич. взаимод., коор-динац. и водородных связей.Важнейшие термодинамич. характеристики С.-энталь-пия С. DHc и энергия Гиббса С. (своб. энергия С.) DGc, связанные соотношением:DGc= DHc -ТDSc,где DSc -энтропия С., T-абс. т-ра. Энтальпия С. определяет тепловой эффект внедрения молекулы растворенного в-ва в р-ритель; энергия Гиббса С. определяет растворимость в-ва.Наиб. простой способ эксперим. определения энтальпии С. состоит в непосредств. измерении теплового эффекта растворения в-ва А в р-рителе S-энтальпии растворения DH р А/S -и использовании соотношения:
![]() где
где ![]() -энтальпия
парообразования в-ва А. Благодаря
развитию калориметрич. техники
определение энтальпий растворения
возможно практически для всех систем;
осн. проблема состоит в корректном
определении энтальпий парообразования.
В то же время измерения значений
DGc достаточно
трудны, особенно в случаях С. ионов в
неводных р-рах. Нередко вместо
DGc вычисляют
изменение этой величины D(DGc)
относительно ее значения в водной
среде, используя для этого стандартную
молярную энергию DG п переноса
иона X
из воды W
в к.-л. р-ритель S:D(DGc)
= DG п(X,
W:S)=
-энтальпия
парообразования в-ва А. Благодаря
развитию калориметрич. техники
определение энтальпий растворения
возможно практически для всех систем;
осн. проблема состоит в корректном
определении энтальпий парообразования.
В то же время измерения значений
DGc достаточно
трудны, особенно в случаях С. ионов в
неводных р-рах. Нередко вместо
DGc вычисляют
изменение этой величины D(DGc)
относительно ее значения в водной
среде, используя для этого стандартную
молярную энергию DG п переноса
иона X
из воды W
в к.-л. р-ритель S:D(DGc)
= DG п(X,
W:S)=![]() (в
р-рителе S)-
(в
р-рителе S)-![]() (в
воде),где
(в
воде),где ![]() -стандартный
хим. потенциал иона X
(рассматривается бесконечно разб. р-р).
-стандартный
хим. потенциал иона X
(рассматривается бесконечно разб. р-р).
Понятие «гидратация» относится к водным растворам; при других растворителях это явление называют сольватацией. Процесс, обратный гидратации или сольватации, называют соответственно дегидратацией или десольватацией. Гидратация является важным условием растворения веществ и устойчивости их в растворе, в частности стабильности растворов белковых и других биополимеров. Гидратация обусловливает набухание полимеров в водных средах, играет большую роль в проницаемости клеточных мембран, в водно-солевом обмене и так далее.
Особенно склонны к гидратации ионы. Их гидратация обусловлена ориентацией дипольных молекул воды в электрическом поле иона, а гидратация полярных не электролитов — их ориентацией за счет взаимодействия диполей и образования водородных связей.
Упорядоченное расположение молекул растворителя вокруг ионов или полярных групп атомов в молекуле растворенного вещества позволяет говорить об образовании ими гидратных слоев или оболочек. Молекулы воды в гидратном слое остаются химически почти неизменными. Этим гидратация отличается от других химических взаимодействий в растворах, например от гидролиза. Однако в гидратном слое изменяются многие физические свойства воды: давление пара, диэлектрическая проницаемость, сжимаемость, растворяющая способность и другие. Гидратация сопровождается выделением тепла и понижением энтропии растворителя благодаря упорядоченному расположению молекул воды в гидратном слое.
Гидратная оболочка в основном удерживается электростатическими силами притяжения, причем полярные группы могут образовывать с молекулами воды водородные связи. Наиболее прочно связаны с ионами или полярными группами в молекулах растворенного вещества те молекулы воды, которые сосредоточены в первом молекулярном слое; энергия связи у молекул второго слоя значительно ниже; в третьем она уже ничтожно мала.
В результате гидратации ионов часто образуются координационные соединения. Например, гидратация иона Сu2+ в водных растворах происходит так, что четыре молекулы воды распределяются симметрично вокруг Си2+, образуя плоскую фигуру. Гидратированный ион меди Си2+-4Н2О придает раствору характерную голубую окраску. Образование гидратов (сольватов) лежит в основе теории растворов Д. И. Менделеева.
Наиболее прочно связанная гидратная вода может при кристаллизации растворенного вещества из растворов входить в состав его кристаллов (кристаллизационная вода), образуя кристаллогидраты, например CuSО4-5H2О, которые по существу являются комплексными соединениями.
Степень гидратации различных ионов и молекул неодинакова и зависит от размеров частиц и величины их заряда. Чем больше заряд и меньше размеры иона, то есть выше удельная плотность заряда, тем больше степень гидратации. Ион L+ гидратирован больше, так как удельная плотность заряда у него выше, чем у ионов К+. Недиссоциированные молекулы также в той или иной степени гидратированы, их гидратная оболочка возникает только вокруг полярных групп и потому может быть не сплошной.
Гидратация ионов в растворе влияет на их подвижность, причем зависимость обратно пропорциональная.
Раствор- гомогенная (однородная)смесь,образованная не менее чем двумя компонентами,один из которых называется растворителем,а др растворимым веществом,это также система переменного состава,находящаяся в состоянии химического равновесия.
Хим раствор- это смесь одной или нескольких кислот с водой. Раствор – однофазная система перенного состава, состоящая из двух или более компонентов. Растворы –гомогенные (однородные) системы,т е каждый из компонентов распределён в массе другого в виде молекул,атомов или ионов. Растворитель – компонент,агрегатное состояние которого не изменяется при образовании раствора. В случае же раствов,образующихся при смешении газа с газом,жидкости с жидкость,твёрдого вещества с твёрдым,растворителем считается коммпонет,количество которого в растворе преобладает.
25.
Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы или в процентах.
![]() ,
,
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы.
![]() ,
,
где:
νi — количество i-го компонента, моль;
n — число компонентов;
Титр раствора — масса растворённого вещества в 1 мл раствора.
![]() ,
,
где:
m1 — масса растворённого вещества, г;
V — общий объём раствора, мл
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре раствора. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов). Для записи концентрации таких растворов используют сокращения «н» или «N». Например, раствор содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.
![]() ,
,
где:
ν — количество растворённого вещества, моль;
V — общий объём раствора, л;
z — число эквивалентов
Молярная концентрация –это отношение количества растворённого вещества к объёму раствора. Она выражается в моль/л и показывает, сколько молей растворённого вещества содержится в 1 л раствора.
26. Дисперсные системы, гетерогенные системы из двух или большего числа фаз с сильно развитой поверхностъю раздела между ними. Обычно одна из фаз образует непрерывную дисперсионную среду, в объеме которой распределена дисперсная фаза (или несколько дисперсных фаз) в виде мелких кристаллов. твердых аморфных частиц, капель или пузырьков. Дисперсные системы могут иметь и более сложное строение, например, представлять собой двухфазное образование, каждая из фаз которого, будучи непрерывной, проникает в объем другой фазы. К таким системам относятся твердые тела. пронизанные разветвленной системой каналов-пор, заполненных газом илижидкостью. некоторые микрогетерогенные полимерные композиции и др. Нередки случаи, когда дисперсионная среда "вырождается" до тончайших слоев (пленок), разделяющих частицы дисперсной фазы.
тип дисперстной сист |
фазовое состояние |
примеры |
|
||
|
дисперсионнойй среды |
дисперсиооной фазы |
|
|
|
аэрозоль |
газ |
жидкая |
туман,облака |
|
|
аэрозоль |
газ |
твёрдая |
дым,пыль |
|
|
пена |
жидкая |
газ |
мыльная пена,вбит сливки |
||
эмульсия |
жидкая |
жидкая |
молоко ,майонез |
|
|
золь |
жидкая |
твёрдая |
краски |
|
|
твёрдая эмульсия |
твёрдая |
жидкая |
масло |
|
|
гель |
твёрдая |
жидкая |
желе |
|
|
Основные типы дисперсных систем. По дисперсности, то есть размеру частиц дисперсной фазы или отношению общей площади межфазной поверхности к объему (или массе) дисперсной фазы (удельной поверхности), Дисперсные системы условно делят на грубодисперсные и тонко(высоко)дисперсные. Последние, по традиции, называемые коллоидно-дисперсными или просто коллоидными системами.
По агрегатному состоянию дисперсионной среды и дисперсной фазы выделяют следующие основные виды дисперсных систем: 1) аэродисперсные (газодисперсные) системы с газовой дисперсионной средой: аэрозоли (дымы, пыли. туманы), порошки. волокнистые материалы типа войлока. 2) Системы с жидкой дисперсионной средой; дисперсная фаза может быть твердой (грубодисперсные суспензии и пасты, высокодисперсные золи и гели), жидкой (грубодисперсные эмульсии, высокодисперсные микроэмульсии и латексы) или газовой (грубодисперсные газовыеэмульсии и пены). 3) Системы с твердой дисперсионной средой: стеклообразные или кристаллические тела с включениями мелких твердых частиц, капель жидкости или пузырьков газа, например, рубиновые стекла, минералытипа опала, разнообразные микропористые материалы. Отдельные группы дисперсных систем составляют многие металлические сплавы, горные породы, сложные композиционные и другие многофазные системы.
образование дисперсных систем. Возможно двумя путями: диспергационным и конденсационным. Диспергирование макрофаз с образованием лиофильных дисперсных систем происходит самопроизвольно - для этого достаточно энергии теплового движения.
Насыщенный раствор — раствор, в котором растворённое вещество при данных условиях достигло максимальной концентрации и больше не растворяется. Осадок данного вещества находится в равновесном состоянии с веществом в растворе.
[править]
Ненасыщенный раствор — раствор, в котором концентрация растворенного вещества меньше, чем в насыщенном растворе, и в котором при данных условиях можн
Растворы - однородная многокомпонентная система, состоящая из растворителя, растворённых веществ и продуктов их взаимодействия. По агрегатному состоянию растворы могут быть жидкими (морская вода), газообразными (воздух) или твёрдыми (многие сплавы металлов). о растворить еще некоторое его количество. Ненасыщенный раствор - раствор, содержащий меньше вещества, чем в насыщенном.
Перенасыщенный раствор - раствор, содержащий больше вещества, чем в насыщенном.
27. Идеальным раствором называют раствор, для которого выполняется первый закон Рауля.
Идеальными при любых концентрациях являются растворы, компоненты которых близки по физическим и химическим свойствам и образование которых не сопровождается объёмными и тепловыми эффектами. В этом случае силы межмолекулярного взаимодействия между однородными и разнородными частицами примерно одинаковы, и образование раствора обусловлено лишь энтропийным фактором.
Коллигативные свойства растворов —— это те их свойства, которые при данных условиях оказываются равными и независимыми от химической природы растворённого вещества; свойства растворов, которые зависят лишь от количества кинетических единиц и от их теплового движения.
Первый закон Рауля связывает давление насыщенного пара над раствором с его составом; он формулируется следующим образом:
Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причём коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.
![]()
Для бинарного раствора, состоящего из компонентов А и В (компонент А считаем растворителем) удобнее использовать другую формулировку:
Относительное понижение парциального давления пара растворителя над раствором не зависит от природы растворённого вещества и равно его мольной доле в растворе.
![]()
Понижение температуры кристаллизации растворов
Условием кристаллизации является равенство давления насыщенного пара растворителя над раствором давлению пара над твёрдым растворителем. Поскольку давление пара растворителя над раствором всегда ниже, чем над чистым растворителем, это равенство всегда будет достигаться при температуре более низкой, чем температура замерзания растворителя. Так, океанская вода начинает замерзать при температуре около минус 2 °C.
Разность между температурой кристаллизации растворителя T°fr и температурой начала кристаллизации раствора Tfr есть понижение температуры кристаллизации.
Понижение температуры кристаллизации бесконечно разбавленных растворов не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрациираствора.
![]()
Поскольку по мере кристаллизации растворителя из раствора концентрация последнего возрастает, растворы не имеют определённой температуры замерзания и кристаллизуются в некотором интервале температур.
РАУЛЯ ЗАКОН: относит. понижение парциального давления пара растворитсля над разб. бинарным раствором неэлектролита равно молярной доле растворенного вещества xв:
![]()
где рА-парциальное
давление растворителя, ![]() -давление
на-сыщ. пара чистого
растворителя. Соотв. для молярной доли
растворителя xA можно
записать:
-давление
на-сыщ. пара чистого
растворителя. Соотв. для молярной доли
растворителя xA можно
записать:
![]()
Если
пар над раствором нельзя считать идеальным
газом. давления ![]() и рА заменяют
на фугитивности fА и
и рА заменяют
на фугитивности fА и ![]() :
:
![]()
Осмотическое давление. Самопроизвольный переход растворителя через полупроницаемую мембрану,разделяющую раствор и растворитель или два раствора с различной концентрацией растворённого вещества,называется осмосом.
Осмотическое давление, диффузное давление, термодинамический параметр, характеризующий стремление раствора к понижению концентрации при соприкосновении с чистым растворителем вследствие встречной диффузии молекул растворённого вещества и растворителя. Если раствор отделен от чистого растворителя полупроницаемой мембраной, то возможна лишь односторонняя диффузия — осмотическое всасывание растворителя через мембрану в раствор
55) Поливинилхлорид [—СН2—СНС1—]„ — один из самых распространенных полимеров, применяемых в строительстве. Это прозрачный, жесткий и прочный при комнатной температуре полимер, при нагревании до 6О...1ОО°С он размягчается, а при 160...200°С— плавится. При этой же температуре начинается его разложение (термодеструкция), что затрудняет переработку поливинилхлорида в изделия. Для придания изделиям эластичности и для облегчения переработки поливинилхлорида его обычно пластифицируют (например, добавляя диоктилфталат). Из поливинилхлорида получают различные изделия: линолеум, трубы, плинтусы и другие погонажные изделия, отделочные пленки, искусственную кожу и др
Полистирол [—СН2—СНС6Н5—]п — продукт полимеризации стирола (винилбензол). Полистирол прозрачный, довольно прочный, но хрупкий полимер, хорошо окрашивается и легко перерабатывается в изделия. Благодаря наличию бензольного кольца полистирол хорошо растворяется в ароматических углеводородах. В строительстве его применяют для получения теплоизоляционных пенопластов, облицовочных плиток
Полипропилен — это термопластичный синтетический неполярный полимер, который принадлежит к классу полиолефинов. Полипропилен (ПП) [—CH2—CH(CH3)—]n является продуктом полимеризации пропилена C3H6. Его молекулярная структура была определена итальянским химиком Дж.Натта в 1954г., который открыл таким образом важнейший класс стереорегулярных полимеров. При этом метильные боковые группы CH3 в цепях полипропилена могут располагаться как регулярно, так и произвольно. Именно пространственное расположение боковых групп (CH3—) по отношению к главной цепи в молекулах полипропилена имеет для свойств данного полимера решающее значение, обуславливая уникальность его химико-физических свойств.
Полиэтилен (ПЭ) [–СН2-СН2–]n существует в двух модификациях, отличающихся по структуре, а значит, и по свойствам. Обе модификации получаются из этилена СН2=СН2. В одной из форм мономеры связаны в линейные цепи со степенью полимеризации (СП) обычно 5000 и более; в другой – разветвления из 4-6 углеродных атомов присоединены к основной цепи случайным способом. Линейные полиэтилены производятся с использованием особых катализаторов, полимеризация протекает при умеренных ФТОРОПЛАСТ — полимерный материал, получаемый химическим путем. Фторопласт содержит атомы фтора, благодаря чему имеет высокую химическую стойкость. Плохо растворяется или не растворяется во многих органических растворителях, не растворим в воде.
Фторопласт хорошо обрабатывается точением, сверлением, фрезерованием и шлифованием.
Фторопласт поставляется в стержнях и пластинах, в нашей компании возможно изготовление изделий точных размеров по чертежам заказчика (труб, втулок и т.д.). температурах (до 150 0С) и давлениях (до 20 атм.).
ФТОРОПЛАСТ — полимерный материал, получаемый химическим путем. Фторопласт содержит атомы фтора, благодаря чему имеет высокую химическую стойкость. Плохо растворяется или не растворяется во многих органических растворителях, не растворим в воде.
Фторопласт хорошо обрабатывается точением, сверлением, фрезерованием и шлифованием.
Фторопласт поставляется в стержнях и пластинах, в нашей компании возможно изготовление изделий точных размеров по чертежам заказчика (труб, втулок и т.д.). - (CF2 - CF2)n
ФЕНОПЛАСТЫ - это разнообразные пластические массы на основе феноло-
альдегидных смол. Это незаменимые материалы для изготовления деталей
технического назначения, работающих в условиях высоких темпиратур и
повышенной влажности, радиотехнической аппаратуры, водо- и кислотостойких
изделий, футеровочной плитки, изделий, обладающих высокими фрикционными
свойствами (тормозные колодки), химической аппаратуры, в машиностроении
Фенопласты – наиболее ''старые'' из всех пластиков. Первый фенопласт
Фенопласты были первыми промышленными синтетическими реактопластами.
Толчком к их производству послужил как дефицит природного сырья, так и
необходимость замены природных материалов синтетическими.
В настоящее время фенопласты применяют не только как поделочный, но
и как конструкционный материал.
Одной из наиболее перспективных областей применения фенопластов
является судостроение. Уже сейчас из них создают крупногабаритные детали
корпусных конструкций и строят целые корпуса мелких судов, спасательные
плоты, пластмассовые рубки и надстройки металлических судов,
изготавливают переборки и палубные настилы.
Обширное применение пластики находят в судовом машиностроении
(гребные винты, корпусные маслёнки).
Пластики являются одним из основных материалов для
электронавигационного и радиотехнического оборудования судов, средств
судовой автоматики, связи.
Бутадиен, дивинил, органическое соединение CH2 = CH — CH = CH2; бесцветный газ с характерным запахом: tпл —108,9°С, tkип —4,5°С; плотность 0,650 г/см3 при —6°С. Бутадиен плохо растворяется в воде, хорошо — в спирте, керосине; с воздухом в количестве 1,6—10,8% бутадиен образует взрывоопасные смеси; tвсn —40°С; предельно допустимая концентрация в воздухе 0,1 г/м3. Бутадиен присоединяет водород, галогены, галогеноводороды и др. электрофильные реагенты, главным образом в положение 1,4:
![]()
а также малеиновый ангидрид с образованием ангидрида тетрагидрофталевой кислоты (реакция количественного определения бутадиена).
Бутадиен легко полимеризуется и сополимеризуется с образованием ценных каучуков (см. Бутадиеновые каучуки, Бутадиеннитрильные каучуки, Бутадиенстирольные каучуки, Винилпиридиновые каучуки).
Наиболее перспективный промышленный способ получения бутадиена — каталитическое дегидрирование нормальных бутана и бутиленов, содержащихся в газах нефтепереработки и попутных газах; процесс осуществляют в одну или две стадии. Разрабатываются методы окислительного дегидрирования нормальных бутана и бутиленов. Это позволит существенно повысить выход бутадиена. Получают бутадиен также пропусканием паров этилового спирта над смешанным дегидратирующе-дегидрирующим катализатором (способ С. В. Лебедева). Бутадиен — побочный продукт производства этилена и др. олефинов из газов, образующихся при пиролизе
55)
ИЗОПРЕНОВЫЕ
КАУЧУКИ СИНТЕТИЧЕСКИЕ
(полиизопрены, ПИ, СКИ-3, америпол,
европрен, карифлекс, каром, курапрен,
натсин, нипол), полимеры изопрена. Наиб.
практич. ценность представляют
стереорегулярные изопреновые
каучуки
(И. к.) - аналоги каучука
натурального, синтезируемые
полимеризацией изопрена в р-ре в присут.
катализаторов Циглера - Натты (комплексов
соед. Ti
с алюминийорг. соед.), а также лития или
литийалкилов.
Структура
и свойства каучуков.
Звенья изопрена в макромолекуле И. к.
могут иметь конфигурации 1,4-циc
(I),
1,4-транс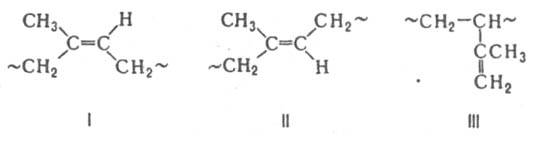 Капрон
— синтетическое полиамидное
волокно,
получаемое
из капролактама.
Из капрона изготовляют канаты, рыболовные
сети и др., а также штапельные ткани,
чулки
и другие бытовые товары. Кнунянц впервые
(в 1942 году) показал возможность
полимеризации ε-капролактама
в линейный полимер, осуществил (в 1947
году) серию работ по синтезу
волокнообразующих полиамидов, в ходе
которых изучил условия бекмановской
перегруппировки
оксимов циклогексана в капролактам,
определил оптимальные условия
полимеризации лактамов и очистки
полиамида от мономера.
С5Н11COOH
Капрон
— синтетическое полиамидное
волокно,
получаемое
из капролактама.
Из капрона изготовляют канаты, рыболовные
сети и др., а также штапельные ткани,
чулки
и другие бытовые товары. Кнунянц впервые
(в 1942 году) показал возможность
полимеризации ε-капролактама
в линейный полимер, осуществил (в 1947
году) серию работ по синтезу
волокнообразующих полиамидов, в ходе
которых изучил условия бекмановской
перегруппировки
оксимов циклогексана в капролактам,
определил оптимальные условия
полимеризации лактамов и очистки
полиамида от мономера.
С5Н11COOH
9) ковалентная связь - химическая связь которая возникает за счет одной или нескольких общих электронных пар между ядрами взаимодействующих атомов . свойства ковалентной связи:
- энергия связи от 100 до 1000 кдж/моль
-насыщенность обусловлена антипараллельной ориентацией спинов связующей электронной пары и проявляющаяся в способности атомов образовывать ограниченное число ковалентных связей .
- кратность число общих электронных пар между взаимодействующими атомами связь может быть одинарной . двойной . тройной
- направленность которая предопределена тем. Что молекулы имеют определенное пространственное строение . потому что локализованные молекулярные орбитали должны располагаться по принципу наименьшего взаимного отталкивания . это подчеркнуто реализуется в концепции гибридных орбиталей , имеющих строго определенное направление в пространстве
- полярность - обусловлена смещением электронной плотности химической связи к более электроотрицательному атому. Различают неполярную и полярной ковалентную связь . в первом случае разность электроотрицательностей ( дельта ЭО ) равна нулю ( МОЛЕКУЛЫ H2, N2 ) а во втором она больше нуля ( H2O ,HCl) дипольный момент является количественный характеристикой полярности связи . он представляет собой произведение велечины заряда на расстояние между точечными зарядами б измеряется в Дебалях . Векторная сумма дипольных моментов всех связей определяет полярность молекулы в целом .
Поляризуемость- способность свзяи увеличивать свой дипольный момент под действием внешних электрических сил , иными словами , она выражается в усилении смещения общей электронной пары к одному из атомов увелечинии степени полярности связи
10 . Ионная связь — электростатическое притяжение между ионами, образованными путем полного смещения электронной пары к одному из атомов.Этот тип связи образуется, если разность электроотрицательностей атомов велика (>1,7 по шкале Полинга). Ионная связь — предельный случай полярной ковалентной связи. Механизм образования ионной связи можно рассмотреть на примере реакции между натрием и хлором. Атом щелочного металла легко теряет электрон, а атом галогена - приобретает. В результате этого возникает катион натрия и хлорид-ион. Они образуют соединение за счет электростатического притяжения между ними.
Вещества с ионным видом связи имеют ионные кристаллические решетки . такие вещества представляют собой твердые , прочные , нелетучие вещества с высокими температурами плавления . при чем при обычных условиях кристаллы таких вещества электрического тока не проводят , а растворы и расплавы большинства ионных соединений – прекрасные электролиты.
Металлической связью называют связь в кристаллах металлов и сплавов , которая обусловлена наличием валентных электронов , обладающих большой свободной движения в кристаллической решетке , образуемой положительными ионами металлов .общие свойства металлов :
Пластичность – способность деформироваться под действиями механической нагрузки . объясняется тем , что под внешним воздействием одни слои ионов в кристаллах легко смещаются , как бы скользят друг относительно друга без разрыва связи между ними
Электропроводимость – обусловлена наличием в них совокупности подвижных электронов которые под действием электрического поля приобретают направленное движение .
теплопроводность – объясняется подвижностью электронов , которые , сталкиваясь с колеблющимися в узлах решетки атом – ионами металлов , обмениваются в узлах решетки атом-ионами металлов обмениваются с ними энергией .с повышением температуры эти колебания ионов с помощью электронов передаются другим ионам , и температура металла быстро выравнивается.
Металлический блеск – способность металла отражать световые лучи
11
Межмолекулярное взаимодействие — взаимодействие между электрически нейтральными молекулами или атомами. Впервые были учтены Я. Д. Ван-дер-Ваальсом в 1873 году. Учёт межмолекулярных сил необходим для объяснения свойств реальных газов и жидкостей.
Ван-дер-ваальсовы силы — силы межмолекулярного взаимодействия с энергией 0,8 — 8,16 кДж/моль. Этим термином первоначально обозначались все такие силы, в современной науке он обычно применяется к силам, возникающим приполяризации молекул и образовании диполей. Открыты Я. Д. ван дер Ваальсом в 1869 году.
К ван-дер-ваальсовым силам относятся взаимодействия между диполями (постоянными и индуцированными). Название связано с тем фактом, что эти силы являются причиной поправки на внутреннее давление в уравнении состояния реального газа Ван-дер-Ваальса. Эти взаимодействия в основном определяют силы, ответственные за формирование пространственной структуры биологических макромолекул.
Ван-дер-ваальсовы силы также возникают между частицей (макроскопической частицей или наночастицей) и молекулой и между двумя частицами.
Ван-дер-ваальсовое взаимодействие состоит из трех типов слабых взаимодействий:
Ориентационные силы, диполь-дипольное притяжение. Осуществляется между молекулами, являющимися постоянными диполями. Примером может служить HCl в жидком и твердом состоянии. Энергия такого взаимодействия обратно пропорциональна кубу расстояния между диполями.
Дисперсионное притяжение (лондоновские силы). Взаимодействием между мгновенным и наведенным диполем. Энергия такого взаимодействия обратно пропорциональна шестой степени расстояния между диполями.
Индукционное притяжение. Взаимодействие между постоянным диполем и наведенным (индуцированным). Энергия такого взаимодействия обратно пропорциональна шестой степени расстояния между диполями.
Водородной связью называют химическую связь между атомами водорода одной молекулы ( или ее части) и атомами наиболее электроотрицательных элементов ( фтор , кислород , азот) другой молекулы ( или ее части ) .
Энергия водородной связи значительно меньше энергии обычной ковалентной связи (не превышает 40 кДж/моль). Однако этой энергии достаточно, чтобы вызвать ассоциацию молекул, то есть их объединение в димеры или полимеры. Именно ассоциация молекул служит причиной аномально высоких температур плавления и кипения таких веществ, как фтороводород, вода,аммиак.
Связь этого типа, хотя и слабее ионной и ковалентной связей, тем не менее играет очень важную роль во внутри- и межмолекулярных взаимодействиях. Водородные связи во многом обусловливают физические свойства воды и многих органических жидкостей (спирты, карбоновые кислоты, амиды карбоновых кислот, сложные эфиры).
Прочность водородной связи (энтальпия образования комплекса) зависит от полярности комплекса и колеблется от ~ 6 кДж/моль для комплексов молекул галогеноводородов с инертными газами до 160 кДж/моль для ион-молекулярных комплексов(AHB)±; так, для комплекса (H2O•H•OH2)+ образованного H2O и H3O+ — 132 кДж/моль в газовой фазе.
12 комплексное соединение – это молекулярные соединения , образующие комплексные ионные , в которых имеется хотя бы одна связь , образованная по донорно –акцепторному механизму ,и способные к существованию как в растворе , так и в кристалле. В комплексных соединениях различаются внутреннюю и внешнюю сферы ,например :
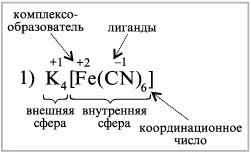
Между внутренней и внешней сферой реализуется ионная связь , а во внутренней сфере –ковалентная . Внутренняя сфера от внешней отделена при написании квадратными скобками .
Комплексообразователь – центральный атом или ион во внутренней сфере комплексного соединения . обычно в качестве комплексного- образователя выступают ионы d и f элементов (переходных металлов) Fe , Ag, Au, Cu ,Zn, Co , Ni , и др .Комплексообразователь располагают в центре схемы комплексного соединения .
Координациионное число комплексообразователя- число монодентатных лигандов , распложенных около центрального атома . 95 % всех комплексных соединений имеют КЧ 4 и 6 . Интересно отметить что в природе чаще встречаются координационные соединения с нечетными КЧ . В зависимости от КЧ молекулы комплексов имеют определенную геометрическую конфигурацию – линейную , плоскую , тетраэдрическую , октаэдрическаю и др .
Кратность связи – это число электронных пар, которые осуществляют связь между атомами . чем выше кратность , тем прочнее связь
Лиганды (L)- нейтральные молекулы или ионы , которые координированы вокруг комплексообразователя , например: а) нейтральные молекулы – NH3 . H2O . CO
б ) ионы :Cl ̄ , Br ̄ , I ̄ , CN ̄ , SO4 ̄
Лигандами могут быть:
а) полярные молекулы – NH3, Н2О, CO, NO; б) простые ионы – F–, Cl–, Br–, I–, H–, H+; в) сложные ионы – CN–, SCN–, NO2–, OH–
характеристика лигандов является дентатность – количество связей , которыми лиганд связан с комплексообразователем . Существует моно – и мультидентатные лиганды .
константа нестойкости - константа диссоциации комплексного иона . комплексные ионы являются слабыми электролитами и диссоциируют ступенчато , для каждой ступени можно записать выражение константы диссоциации ,
1 ступень (Cu(NH3)4)+2 --- ( Cu(NH3)3)+2 +NH3
2 СТУПЕНЬ (Cu(NH3)3)2+ ---(Cu(NH3)2)2+ + NH3
3 ступень (Cu(NH3)2)2+ ---(Cu(NH3)2+ + NH3
4 ступень (Cu(NH3)2+ ---Cu2+ + NH3
K= H3)4)2+)
* (NH3)
/ (Cu(NH3)4)+2
и так для каждой ступени)
H3)4)2+)
* (NH3)
/ (Cu(NH3)4)+2
и так для каждой ступени)
13
Гибридизация атомных орбиталей – перераспределение электронных плотностей близких по энергии орбиталей . которое приводит к их равноценности . из разных по форме и энергии атомных орбиталей образуется гибридные . эти орбитали с неравномерно распределенной электронной плотностью ,одинаковы по форме и энергии , причем их ориентация в пространстве отличаются от ориентации исходных . они имеют форму , близкую к неправильной объемной восьмерке


тип гибридизации |
Геометрическая форма |
Угол между связями |
Примеры |
sp |
линейная |
180o |
BeCl2 |
sp2 |
треугольная |
120o |
BCl3 |
sp3 |
тетраэдрическая |
109,5o |
CH4 |
sp3d |
тригонально-бипирамидальная |
90o; 120o |
PCl5 |
sp3d2 |
октаэдрическая |
90o |
SF6 |
Главное преимущество гибридных орбиталей – более глубокое перекрывание с орбиталями соединяющих атомов ,образование более прочных связей , что проводит к более выгодному низкому энергетическому состоянию образовавшейся молекулы . гибридизация требует затрат энергии , компенсировать которую может только химическая реакция
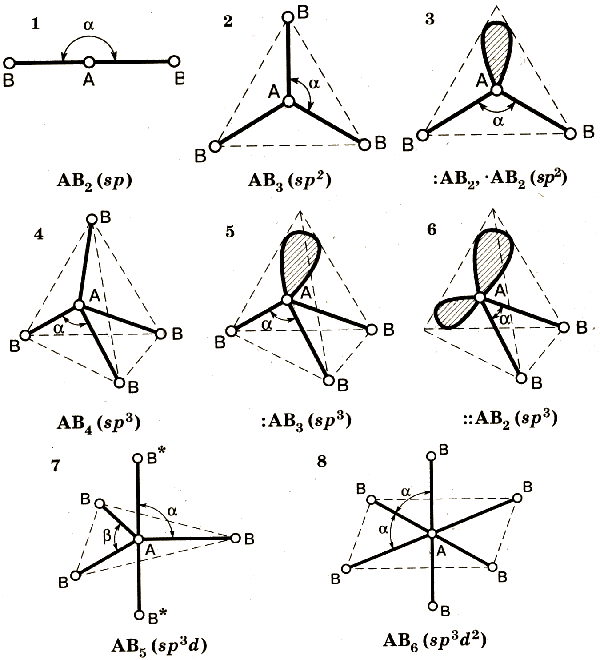
14 фазовое равновесие - гетерогенное равновесие ,которое устанавливается в физических процессах перехода из одной фазы в другую без изменения химического состава . длительно существует при p ,T =const . справедливы все закономерности обычного химического равновесия . (переход веществ из одного агрегатного состояния в другую )
Твердого-жидкость –пар – обратно)
Химическое равновесие состояние системы ,подчиняющее следующим закономерностям: 1) динамический характер Uпрям реакции = U обратной реакции
2) подвижность – самопроизвольное восстановление после прекращения внешнего воздействия ( согласно принципу ЛЕ-Шателье )
3) энергия Гиббса G=0 ,энергия Гельмгольца F= 0система не совершает полезной работы .
Фаза – однородная часть гетерогенной системы , обладающая определенными физическими и химическими свойствами , отделенная от других частей поверхностью раздела .при переходе через которую свойства меняются . по числу фаз система может быть :
А) Однофазной (ф=1) любая гомогенная система может быть только однофазной . например , сосуд ,заполненный газами , стакан с полностью смешивающими жидкостями . В этих случаях вещества не имеют границы раздела
Б) двухфазной ( ф=2) пример – : - кипящая вода в сосуде : : один компонент( вода) образует жидкую и газообразную фазу : смесь кристаллов CuSO4 и KCl- две твердые фазы ,отличающиеся по свойствам и разделенные граничной поверхностью :
В) трех – и более фазной ( ф >3 ) так неустойчивая смесь кристаллов Na2SO4 , Na2SO4 *H2O -Трехфазная система каждое вещество отличается от остальных по содержанию воды и имеет определенную кристаллическую решетку отличаясь по физическим и химическим свойствам .
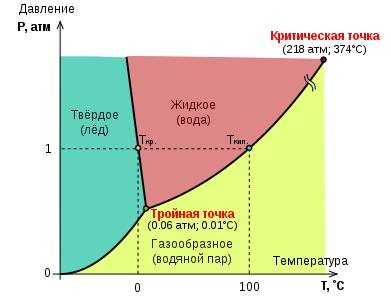
Фазовая диаграмма состояния – графическое изображение кривых , отражающих зависимость фазового равновесия от давления и температуры . простейший пример – фазовая диаграмма чистой воды – однокомпонентноя трехфазовой системы , на которую влияют температура и давление
По правилу фаз число степеней свободы данной в этом случае равно С =1+2-Ф=3-Ф = 0 тоесть система нонвариантна .
15 . Термодинамика – это раздел физики, в котором с наиболее общих позиций (без обращения к молекулярным представлениям) рассматриваются процессы обмена энергией между изучаемым объектом и окружающей средой. Термодинамика – это учение о связи и взаимопревращениях различных видов энергии, теплоты и работы.
Первый закон термодинамики : изменение системы равно количеству теплоты , сообщенной системе , за вычетом работы ,совершенной системой
dU =Q-A
дельта U-изменение внутренней энергии , Q-теплота ,A- работа
процесс адиабатный – процесс , протеканий в системе , не обменивающейся с окружающей средой теплотой (Q=0) ,изменение внутренней энергии происходит лишь за счет совершения системой (или над ней ) работы . пример – расширение или сжатие газов в теплоизолированном сосуде . для адиабатного процесса
dU= -A
Процесс изобарный –процесс ,потекающий при постоянной температуре (p=const)
Процесс изотермический – процесс , протекающий при постоянной температуре ( T=const)
Процесс изохорный - процесс ,протекающий при постоянном объёме (v=const)
Процесс необратимый - такой процесс после проведения которого в системе или окружающей среде остаются какие –либо изменения
Процесс обратимый – процесс , который можно реализовать таким образом , что система и окружающая среда возвратятся в исходное состояние .
Энтальпия – ( дельта Н) теплосодержание- функции состояния , определяющая тепловой эффект процесса в изобарно- изотермических системах .
Внутренняя энергия – ( U)- это полная энергия системы ,включающая в себя все виды потенциальной и кинетической энергии всех ее частиц , тоесть энергию движения частиц , энергию химических связей и межмолекулярных взаимодействий , внутриатомную и ядерную энергию и т,п. В понятие внутренней энергии не входит кинетическая и потенциальная энергия системы как единого целого .Абсолютную величину внутренней энергии не измеряют , в таблицах указано значении U0298
16
Термохимическое уравнение - уравнение , в котором указан тепловой эффект реакции и агрегатное состояние участников реакции (Q)
Тепловой эффект реакции - теплота поглощаемая или выделяемая в ходе реакции и отнесенная к одному молу веществ , при условии , что температура начальных и конечных продуктов одинакова и единственной работой является работа расширения . Единица измерения –Дж, кДж . Любая химическая реакция сводится к разрыву связей в реагирующих веществах и образованию новых в продуктах реакции , поэтому знак теплового эффекта будет определяться соотношением величин энергии , необходимой на разрыв (Е св1) и выделяющейся при образовании связи (Есв2) . При эндотермической реакции ( с поглощением теплоты ) Есв1 >Есв2 ,при экзотермической ( с выделением теплоты ) Есв1 <E св2.
Закон Гесса - установлен экспериментально Г.Гессе ( 1836) : тепловой эффект реакции , протекающей при p,T=const .или V,T=const не зависит от пути реакции иее механизмов , а лишь от начального и конечного состояния реагирующей системы .
Следствие из закона Гесса :
А) изменение энтальпии химической реакции не зависит от числа и вида промежуточных стадий
Например углекислый газ можно получить прямым взаимодействием либо через промежуточную реакцию . Образование каждого продуктов ( основного и промежуточного) сопровождается изменением энтальпии :
Б) эльтампия прямой химической реакции равна взятой с противоположным знаком энтальпии обраной реакции :
Дельта Н пр = - дельта Н обрт
Например : CaCO3(к)=CaO(к) + CO2(Г) дельта Н298= +178
CaO(к) + CO2(Г) = CaCO3(к) Н = - 178
В) энтальпия химической реакции равна сумме энтальпии образования продуктов реакции минус сумма энтальпий образования исходных веществ
Так как в термохимических таблицах приведены велечины образования 1 мол веществ а в химическом взаимодействии количества веществ нередко больше , то при расчетах учитывают стехиометрические коэффициенты :
???????????????????????????????????????????????????????????????????????????????????
17
Энтропия (S)- функция состояния , характеризующая степень неупорядоченности системы,ее молекулярного беспорядка из-за броуновского движения частиц . Изменение энтропии связано с переходом из одного агрегатного состояния в другое , по мере повышения температуры системы растет скорость движения частиц , растет число микросостояний , увеличивается термодинамическая вероятность ,а , значит и энтропия .
Второй закон термодинамики позволяет ответить на вопросы , возможен ли тот или иной процесс , в каком направлении он существует , до какого предела протекает .Установлен экспериментально .
Закон имеет несколько формулировок :