
- •1.Химия как наука и ее место в ряду геологических дисциплин. Понятие об атоме и молекуле, Атомная и молекулярная массы. Моль.
- •2.Понятие о химических реакциях. Признаки и классификация химических реакций. Способы написания химических реакций.
- •3.Основные законы химии. Следствия из закона Авогадро.
- •4.Строение ядра. Изотопы. Изотоны. Изобары. Планетарная модель атома Резерфорда. Линейчатый спектр атома.
- •5.Модель атома по Бору. Нормальное и возбужденное состояние атома. Правило квантования. Недостатки теории Бора.
- •6.Квантово механическая модель атома. Волновая функция. Квантовые числа, их значения и интерпретация. Условная запись строения атома.
- •7.Квантово механическая модель атома водорода и многоэлектронных атомов. Порядок заполнения электронов по уровням и подуровням. Правила Гунда и Клечковского. Запрет Паули.
- •9.Химическая связь и валентность элементов. Характеристика химической связи (электроотрицательность, энергия, кратность и полярность связи)
- •10. Механизм образования валентной связи. Гибридные связи. Пространственная конфигурация молекул. Примеры.
- •11.Металическая связь. Межмолекулярные взаимодействия. Водородная связь. Энергетическая оценка различных типов связи.
- •12.Межмолекулярное взаимодействие. Аморфное и кристаллическое состояние вещества.
- •13.Энергитические эффекты химических реакций. Типы систем. Внутренняя энергия и энтальпия. Первый закон термодинамики. Закон Гесса.
- •14.Втрой закон термодинамики. Энтропия. Энтальпийный и Энтропийный факторы протекания химической реакции. Энергия Гиббса.
- •15.Гомогенные и гетерогенные химические реакции. Скорость химических реакций. Зависимость скорости химической реакции от изменения параметров системы.
- •16.Скорость химической реакции. Энергия активации. Адсорбционные процессы. Гомогенный и гетерогенный катализ.
- •17.Химическое равновесие в гомогенных и гетерогенных системах. Константа равновесия. Закон действующих масс.
- •18.Закон действующих масс Константа равновесия. Смещение химического равновесия. Основное карбонатное равновесие в природе.
- •19.Понятие полярности и поляризуемости химической связи. Электролитическая диссоциация. Сильные и слабые электролиты. Количественные характеристики силы электролитов.
- •20.Раствоы сильных и слабых электролитов. Степень диссоциации и константа диссоциации слабых электролитов в растворе. Закон разбавления Оствальда.
- •21.Вода структура воды. Растворы сильных электролитов. Явление гидратации (сольватации) в растворах. Понятие об активности и ионной силе электролитов растворе.
- •22.Ионно обменные реакции в растворах электролитов. Кислоты, основания и соли с точки зрения теории электролитической диссоциации.
- •23.Направление протекания ионно-обменных химических реакций. Смещение ионных равновесий в растворах электролитов. Геохимическое карбонатное равновесие в природе.
- •24. Основные теории кислот и оснований. (Аррениуса, Бренстеда-Лоури, Льюиса). Их достоинства и недостатки.
- •25.Вода. Ионное произведение воды. Водородный показатель. Методы определения pH.
- •26.Водородный показатель. Методы определения pH. Кислотно-основные индикаторы.
- •27.Гидролиз солей. Смещение равновесия в растворах гидролизирующихся солей. Роль гидролиза в геохимических процессах. Примеры.
- •28.Растворы, растворимость. Насыщенные, ненасыщенные и перенасыщенные растворы. Их термодинамическая характеристика. Произведение растворимости.
- •29.Насыщенные растворы малорастворимых электролитов. Произведение растворимости. Условия образования и растворения осадков малорастворимых электролитов.
- •30.Условие образования и растворения осадков малорастворимых электролитов Влияния различных фактов на растворимость осадков. Химические предпосылки миграции осадочных пород.
- •31.Произведение растворимости. Влияние одноименных и посторонних ионов на растворимость. Порядок выпадения в осадок малорастворимых электролитов. Парагенезис минералов.
- •32.Окислительно-востановительные реакции. Окислительно-восстановительные свойства элементов и соединений. Классификация окислительно-восстановительных реакций.
- •33.Гальванические элементы. Образование двойного электрического слоя. Стандартные электродные потенциалы.
- •34.Окислительно-восстановительные потенциалы. Электроды сравнения. Уравнение Нернста.
- •35.Направление протекания окислительно-восстановительных реакций.
- •36.Химические гальванические элементы. Концентрационные элементы. Значение потенциалометрии в геологических процессах.
- •37.Соединения высшего прядка. Электрохимическая диссоциация комплексных соединений. Константа нестойкости комплексных соединений. Заряд комплексообразователя и комплексного иона.
- •38.Теория координационной связи. Координационные числа. Заряд комплексного иона и комплексообразователя. Номенклатура комплексных соединений.
- •[Ag(nh3)2]Cl – хлориддиаминосеребра.
- •K[Ag(cn)2] – дицианоаргентаткалия.
- •39.Классификация комплексных соединений. Диссоциация комплексных соединений. Устойчивость комплексов. Роль комплексообразования в геохимических процессах миграции.
- •40. Концентрационные элементы. Диффузионные потенциалы.
- •41. Явление поляризации. Концентрационная и активационная поляризации. Механизм и способы их устранения.
- •42. Обзор химических свойств элементов в периодической системе д.И. Менделеева. Металлы и неметаллы. Основные породообразующие элементы.
7.Квантово механическая модель атома водорода и многоэлектронных атомов. Порядок заполнения электронов по уровням и подуровням. Правила Гунда и Клечковского. Запрет Паули.
Квантово механическую модель атома водорода описывает уравнение Шрейдингера:
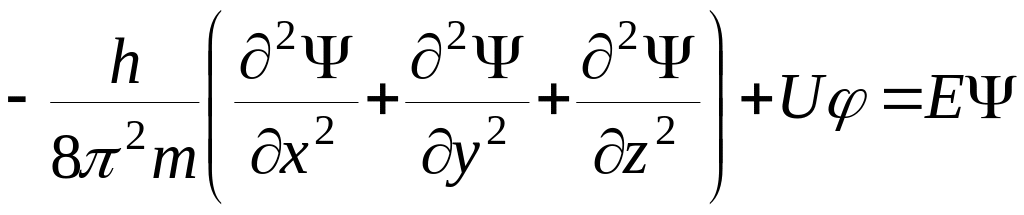
Уравнение Шрейдингера постулат. Ни одно из следствий этого уравнения не противоречит экспериментальным данным. Это уравнение точно решатся только для системы электрон ядро (атом водорода H 1s1). И имеет примерное решение для более сложных систем. Для таких систем учитывается взаимодействие электронов между собой, т.к. внешние электроны притягиваются к ядру, но при этом отталкиваются другими электронами. Таким образом внешние электроны как бы экранизируют ядро, делая его заряд экранизированным. Экранировка внутренних электронов сильно сказывается на d уровне, в меньшей степени на p и практически не сказывается на S уровне.
Существует 3 правила, позволяющие записать электроны по уровням и подуровням:
Правило Клечковского: Последовательность размещения электронов по атомным орбиталям в невозбужденном состоянии атома должна отвечать наибольшей связи их с ядром, то есть электрон должен обладать минимальной энергией.
1)т.к энергия электрона определяется значениями n и l, то сначала заполняется те подуровни и уровни, для которых сумма n+l минимальна.
4s=(n+l) = 4+0=4
3d=(n+l)=3+2=5 следовательно сперва будет заполняться s орбиталь.
2)Если для 2-х орбиталей значение n+l равны, то сначала заполняется орбиталь с меньшим n.
Правило Гунда: В пределах подуровня электроны заполняют максимальное число орбиталей. т.е. суммарный спин максимален.
Запрет Паули: В атоме или молекуле не может быть 2-х электронов с одинаковыми значениями всех 4-х квантовых чисел, то есть хотя бы спиновое квантовое число должно отличаться(спин он как бы показывает в какую сторону движется электрон по орбитали ↑ или ↓).
8.Переодический закон Д.И.Менделеева в свете современных представлений о строении атома. S P D элементы. Металлические и неметаллические свойства. Сравнить кислотно-основные и окислительно-востановительные свойства элементов 1 и 5 групп.
Периодический закон Д.И.Менделеева: Менделеев сформулировал периодический закон в виде следующих основных положений:
Элементы расположенные по величине атомного веса, представляют явственную периодичность свойств.
Должно ожидать открытия еще много неизвестных простых тел, сходных с Al и Si элементов, с атомным весом весом 65 – 75 а.е.м.
Величина атомного веса элемента иногда может быть исправлена, зная его аналоги.
Некоторые аналоги элементов открываются по величине веса их атомов.
Металлические свойства атома: способность атома отдавать электроны и приобретать + заряд.
Неметаллические свойства атома: характеризуются энергией, выделяющейся при присоединении электрона к нейтральному атому.
9.Химическая связь и валентность элементов. Характеристика химической связи (электроотрицательность, энергия, кратность и полярность связи)
Химическая связь: особый вид электромагнитного взаимодействия, характеризуемое повышением электронной плотности между ядрами. Движущей силой химического взаимодействия является их стремление к устойчивй электронной конфигурации, т.е к конфигурации оболочек инертного газа
Валентность элемента: мера способности его атомов соединяться с другими атомами в определенных соотношениях. Ее можно выразить числом атомов водорода, которые способен присоединить к себе данный атом.
Электроотрицательность: характеризует какие свойства атомов ярче выражены, металлические или неметаллические.
Энергия химической связи: работа, которую надо затратить на разрыв этой связи. Она характеризует прочность и устойчивость. Так же она объясняется длиной этой связи(расстояние между ядрами связанных атомов).
Кратность связи: Число электронных пар, связывающих 2 атома в молекуле. С увеличением кратности связи увеличивается энергия связи но не пропорционально.
Полярность связи: связь элементов с разностью электронной отрицательности <1.7, в этом случае связь будет смещена в сторону наиболее активного атома - ковалентная полярная связь. Если химическая связь образована 2-мя элементами с разностью электроотрицательности = 0, то связь ковалентная неполярная. Если разность электронной отрицательности элементов >1.7, то такая связь называется ионной.
