
- •Сафу им. М.В.Ломоносова, иИиКт
- •10 Июня 2011 г.
- •Вопрос 1. Механическое движение. Система отсчёта. Путь, перемещение, траектория. Расчёт пути при равноускоренном движении.
- •Вопрос 2. Кинематика поступательного движения. Скорость мгновенная, средняя. Модуль скорости. Ускорение и его составляющие.
- •Вопрос 3. Кинематика вращательного движения. Элементарный угол поворота, угловая скорость, угловое ускорение. Связь линейных и угловых величин. Псевдовекторы.
- •Вопрос 4. Масса, свойство массы. Сила. Инерция. Первый закон Ньютона.
- •Вопрос 5. Сила. Импульс тела. Второй закон Ньютона. Принцип независимости сил. Третий закон Ньютона.
- •Вопрос 6. Импульс механической системы. Внешние силы. Замкнутая система. Закон сохранения импульса. Центр масс.
- •Вопрос 7. Работа силы в механике. Работа силы тяжести, работа силы упругости.
- •Вопрос 8. Кинетическая энергия – функция состояния системы. Теорема о кинетической энергии.
- •Вопрос 9. Силовое поле. Консервативные силы и диссипативные силы. Работа консервативных сил. Потенциальная энергия. Связь потенциальной энергии и консервативной силы.
- •Вопрос 10. Силовое поле. Потенциальное поле. Полная механическая энергия. Закон сохранения энергии.
- •Вопрос 11. Момент инерции материальной точки, твёрдого тела. Теорема Штейнера. Кинетическая энергия вращающегося тела.
- •Вопрос 12. Момент силы материальной точки относительно точки, момент силы материальной точки относительно оси. Основное уравнение динамики вращательного движения.
- •Вопрос 13. Момент импульса материальной точки относительно точки, момент импульса материальной точки относительно оси.
- •Вопрос 14. Момент импульса твердого тела. Закон сохранения момента импульса.
- •Вопрос 15. Параметры состояния. Термодинамическое равновесие. Модель идеального газа. Уравнение состояния идеального газа. Изопроцессы идеального газа.
- •Вопрос 16. Основное уравнение молекулярно-кинетической теории идеальных газов. Молекулярно-кинетическое толкование температуры. Средняя квадратичная скорость.
- •Вопрос 17. Закон Максвелла для распределения молекул идеального газа по скоростям. Анализ функции распределения.
- •Вопрос 18. Закон Максвелла для распределения молекул идеального газа по скоростям. Наиболее вероятная скорость.
- •Вопрос 19. Барометрическая формула. Распределение Больцмана.
- •Вопрос 20. Степени свободы молекул. Закон равномерного распределения энергии по степеням свободы. Внутренняя энергия газа – функция состояния.
- •Вопрос 21. Первое начало термодинамики. Работа газа в адиабатном и изопроцессах.
- •Вопрос 22. Молекулярно-кинетическая теория теплоемкости идеальных газов. Недостатки классической теории теплоемкости идеальных газов.
- •Вопрос 23. Адиабатный и политропный процессы. Уравнение Пуассона.
- •Вопрос 24. Обратимые и необратимые процессы. Круговой процесс (цикл). Термический кпд цикла. Цикл Карно. Кпд цикла Карно.
- •Вопрос 25. Энтропия, её статистическое толкование и связь с термодинамической вероятностью. Расчет энтропии в процессах идеального газа.
- •Вопрос 26. Второе начало термодинамики. Второе начало термодинамики для необратимых процессов. Теорема Нернста.
- •Вопрос 27. Реальные газы. Уравнение Ван-дер-Ваальса и его анализ. Внутренняя энергия реального газа.
- •Вопрос 28. Постулаты Эйнштейна. Релятивистский импульс. Закон взаимосвязи массы и энергии.
- •Основные формулы.
- •1. Кинематика поступательного движения.
- •2. Кинематика поступательного и вращательного движения.
- •3. Динамика. Работа, энергия. Законы сохранения.
- •4. Динамика вращательного движения.
- •5. Динамика вращательного движения. Работа, энергия.
- •6. Теория относительности.
- •Молекулярная физика. Термодинамика Молекулярно-кинетическая теория
- •2. Распределение газовых молекул по скоростям
- •3. Элементы физической кинетики
- •4. Первое начало термодинамики. Внутренняя энергии. Работа и теплота
- •6. Второе начало термодинамики
Вопрос 26. Второе начало термодинамики. Второе начало термодинамики для необратимых процессов. Теорема Нернста.
Первое начало термодинамики как закон сохранения энергии не отвечает на вопрос «возможно ли осуществить какой-либо процесс». Поэтому второе начало термодинамики определяет направление протекания термодинамического процесса и накладывает ограничение на возможность осуществления какого-либо процесса.
Например, первое начало допускает построение двигателя, который совершает работу за счет охлаждения одного источника, то есть без холодильника.
Формулировка второго начала:
Кельвина: невозможен круговой процесс, единственным результатом которого является превращение теплоты, полученной от нагревателя в эквивалентную ей работу.
Клаузиуса – невозможен круговой процесс, единственным результатом которого является передача количества темлопты от менее нагретого тела к более нагретому.
Ко
второму началу термодинамики можно
отнести и теорему Карно, которая говорит
о том, что мах.
 тепловой машины может быть только в
цикле Карно. Для получения работы
необходимо не только получить теплоту
от нагревателя, но и отдать часть этой
теплоты холодильнику. А поток тепла в
замкнутой системе направлен всегда от
более горячего тела к более холодному.
Поведение системы при температурах
близких к абсолютному нулю описывается
теоремой Нернста, поэтому её иногда
называют третьим началом термодинамики.
тепловой машины может быть только в
цикле Карно. Для получения работы
необходимо не только получить теплоту
от нагревателя, но и отдать часть этой
теплоты холодильнику. А поток тепла в
замкнутой системе направлен всегда от
более горячего тела к более холодному.
Поведение системы при температурах
близких к абсолютному нулю описывается
теоремой Нернста, поэтому её иногда
называют третьим началом термодинамики.
 - теорема Нернста
- теорема Нернста
Предел энтропии стремится к 0, при термодинамической температуре, стремящейся к 0.
Теорема Нернста применима только к телам, для которых состояние при T = 0является состоянием полного внутреннего равновесия.
Из этой теоремы следует два вывода:
- невозможно достигнуть абсолютного нуля.
-
теплоёмкости
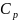 и
и
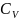 при абсолютном нуле равны 0, а это
противоречит классической теории
теплоёмкости.
при абсолютном нуле равны 0, а это
противоречит классической теории
теплоёмкости.
Вопрос 27. Реальные газы. Уравнение Ван-дер-Ваальса и его анализ. Внутренняя энергия реального газа.
Реальный газ – газ, между молекулами которого действуют силы межмолекулярного взаимодействия и молекулы имеют собственный объем. Поэтому в уравнение состояния идеального газа надо внести поправки:
1.
Учитываем собственный объем одной
молекулы. Будем считать, что она имеет
форму шар, т.е.
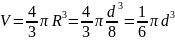
Для
1 моль газа уравнение Менделеева –
Клаперона будет иметь вид
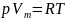
Учтем
собственный объем молекул путем замены
объема сосуда
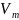 на объем, занимаемый молем газа, свободный
от молекул (
на объем, занимаемый молем газа, свободный
от молекул (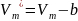 )
b – поправка, зависящая
от собственного объема молекулы.
Рассчитаем эту поправку. При соударении
молекулы не могут приблизиться на
расстояние меньшее чем расстояние d,
расстояние между центрами двух молекул,
следовательно, для центров обеих молекул
недоступен объем сферы радиуса d.
)
b – поправка, зависящая
от собственного объема молекулы.
Рассчитаем эту поправку. При соударении
молекулы не могут приблизиться на
расстояние меньшее чем расстояние d,
расстояние между центрами двух молекул,
следовательно, для центров обеих молекул
недоступен объем сферы радиуса d.
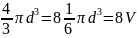 - 8 объемов одной молекулы. В расчете на
одну молекулу недоступный объем будет
равен
- 8 объемов одной молекулы. В расчете на
одну молекулу недоступный объем будет
равен
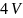 .
.
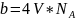 – для 1 моль....
– для 1 моль....
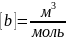 , т.е. поправка на недоступный объем в
4 раза больше собственного объема всех
молекул в 1 моль газа.
, т.е. поправка на недоступный объем в
4 раза больше собственного объема всех
молекул в 1 моль газа.
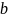 зависит от эффективного диаметра
молекулы.
зависит от эффективного диаметра
молекулы.
2.
Учет сил притяжения. Силы притяжения
между молекулами уменьшают давление
газа на стенки сосуда, т.е. давление
реального газа
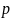 равно:
равно:
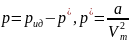 ,
,
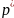 - давление, обусловленное действием сил
взаимного притяжения. Газ как бы сам
себя сжимает. Это давление обратно
пропорционально объему в квадрате,
- давление, обусловленное действием сил
взаимного притяжения. Газ как бы сам
себя сжимает. Это давление обратно
пропорционально объему в квадрате,
 - коэффициент также как и
,
называется поправкой Ван – дер –
Ваальса.
- коэффициент также как и
,
называется поправкой Ван – дер –
Ваальса.
Уравнение Ван – дер – Ваальса (для одного моля газа)
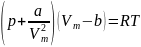
Для произвольный массы газа:
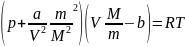
p – давление реального газа, V – объем реального газа.
Поскольку
в реальном газе учитываются силы
взаимодействия между молекулами, то
внутренняя энергия реального газа
включает в себя кинетическую энергию
и потенциальную энергию их взаимодействия.
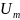 – внутренняя энергия одного моль.
– внутренняя энергия одного моль.
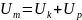 .
.
 – внутреннее давление,
– внутреннее давление,
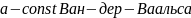 .
.
Работа,
затраченная на преодоление сил притяжения,
идет на увеличение
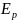 .
.
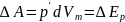 ;
;
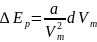 ;
;
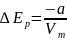 (c=0);
(c=0);
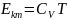 ;
;
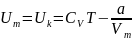
Внутренняя энергия реального газа, так же как и у идеального газа, растет с повышением температуры.
