
- •Влияние температуры
- •Влияние концентрации
- •Ядро атома
- •Изотопы
- •Характерные кристаллические решётки
- •15. Растворы
- •Значение понятия
- •Понижение температуры кристаллизации растворов
- •[Править]Повышение температуры кипения растворов
- •19. Гидролиз
- •Степень гидролиза
- •20. Гидролиз солей многоосновных кислот и оснований
- •22. Понятие о протолизе
- •Вывод значения ионного произведения воды
- •Реакция ионного обмена — одна из видов химической реакции, характеризующаяся выделением в продукты реакции воды, газа илиосадка. Изображение реакций ионного обмена
- •Правила написания реакций двойного обмена
- •2. Если в результате реакции выделяется нерастворимое в воде вещество.
- •3. Если в результате реакции выделяется газообразное вещество.
- •Реакция нейтрализации
- •24. Виды окислительно-восстановительных реакций
- •[Править]Вывод уравнения Нернста
- •Первый закон Фарадея
- •Вывод закона Фарадея
- •Второй закон Фарадея
[Править]Вывод уравнения Нернста
![]() ,
,
где
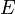 —
электродный
потенциал, E0 —
стандартный электродный потенциал,
измеряется в вольтах;
—
электродный
потенциал, E0 —
стандартный электродный потенциал,
измеряется в вольтах;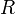 — универсальная
газовая постоянная,
равная 8.31 Дж/(моль·K);
— универсальная
газовая постоянная,
равная 8.31 Дж/(моль·K);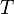 —
абсолютная
температура;
—
абсолютная
температура;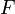 — число
Фарадея,
равное 96485,35 Кл/моль;
— число
Фарадея,
равное 96485,35 Кл/моль;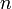 —
число моль электронов,
участвующих в процессе;
—
число моль электронов,
участвующих в процессе;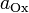 и
и 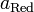 — активности соответственно окисленной и восстановленной форм
вещества, участвующего в полуреакции.
— активности соответственно окисленной и восстановленной форм
вещества, участвующего в полуреакции.
Если в формулу Нернста подставить числовые значения констант R и F и перейти от натуральных логарифмов к десятичным, то при T = 298K получим
![]()
28. . Гальванический элемент Гальванический элемент - химический источник электрического тока, названный в честь Луиджи Гальвани. Принцип действия гальванического элемента основан на взаимодействии двух металлов черезэлектролит, приводящем к возникновению в замкнутой цепи электрического тока. ЭДС гальванического элемента зависит от материала электродов и состава электролита. Это первичные ХИТ, которые из-за необратимости протекающих в них реакций, невозможно перезарядить. Гальванические элементы являются источниками электрической энергии одноразового действия. Реагенты (окислитель и восстановитель) входят непосредственно в состав гальванического элемента и расходуются в процессе его работы. Гальванический элемент характеризуется ЭДС, напряжением, мощностью, емкостью и энергией, отдаваемой во внешнюю цепь, а также сохраняемостью и экологической безопасностью. ЭДС определяется природой протекающих в гальваническом элементе процессов. Напряжение гальванического элемента U всегда меньше его ЭДС в силу поляризации электродов и потерь сопротивления: U = Eэ – I(r1–r2) – ΔE, где Еэ – ЭДС элемента; I – сила тока в режиме работы элемента; r1 и r2 – сопротивление проводников I и II рода внутри гальванического элемента; ΔЕ – поляризация гальванического элемента, складывающаяся из поляризаций его электродов (анода и катода). Поляризация возрастает с увеличением плотности тока (i), определяемой по формуле i = I/S, где S – площадь поперечного сечения электрода, и ростом сопротивления системы.
Схема гальванического элемента в котором медь катод: (-) Zn0 | Zn2+ || Cu2+ | Cu0 (+) Электронные уравнения: А: Zn0 - 2e → Zn2+ K: Cu2+ + 2e → Cu0 Схема гальванического элемента в котором медь анод: (-) Cu0 | Cu2+ || Ag+ | Ag0 (+) Электронные уравнения: А: Cu0 - 2e → Cu2+ К: Ag+ + e → Ag0
32. Электро́лиз — физико-химический процесс, состоящий в выделении на электродахсоставных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического токачерез раствор либо расплав электролита.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создается электродами — проводниками, соединёнными с полюсами источника электрической энергии. Анодом при электролизе называется положительный электрод,катодом — отрицательный[1]. Положительные ионы — катионы — (ионы металлов,водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательные ионы —анионы — (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
