
- •Влияние температуры
- •Влияние концентрации
- •Ядро атома
- •Изотопы
- •Характерные кристаллические решётки
- •15. Растворы
- •Значение понятия
- •Понижение температуры кристаллизации растворов
- •[Править]Повышение температуры кипения растворов
- •19. Гидролиз
- •Степень гидролиза
- •20. Гидролиз солей многоосновных кислот и оснований
- •22. Понятие о протолизе
- •Вывод значения ионного произведения воды
- •Реакция ионного обмена — одна из видов химической реакции, характеризующаяся выделением в продукты реакции воды, газа илиосадка. Изображение реакций ионного обмена
- •Правила написания реакций двойного обмена
- •2. Если в результате реакции выделяется нерастворимое в воде вещество.
- •3. Если в результате реакции выделяется газообразное вещество.
- •Реакция нейтрализации
- •24. Виды окислительно-восстановительных реакций
- •[Править]Вывод уравнения Нернста
- •Первый закон Фарадея
- •Вывод закона Фарадея
- •Второй закон Фарадея
Реакция нейтрализации
Реакцию между кислотами и основаниями называют реакцией нейтрализации:
Основание + Кислота = Соль + Вода
(реакция обмена, реакция нейтрализации)
Сущность реакции нейтрализации сильного основания сильной кислотой сводится к взаимодействию между гидроксид-ионами OH – и ионами водорода H+.
Например: NaOH + HCl = NaCl + H2O
Na+ + OH – + H+ + Cl– = Na+ + Cl– + H2O
OH – + H+ = H2O
При нейтрализации нерастворимого основания сильной кислотой образуются не только молекулы воды, но и катионы металла.
Пример реакции нейтрализации нерастворимого основания:
Fe(OH)2 + 2HCl = FeCl2 + 2H2O
Fe(OH)2 + 2H+ + 2Cl– = Fe2+ + 2Cl– + 2H2O
Fe(OH)2 + 2H+ = Fe2+ + 2H2O
24. Виды окислительно-восстановительных реакций
Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
Н2S + Cl2 → S + 2HCl
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
2H2O → 2H2 + O2
Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
Cl2 + H2O → HClO + HCl
Репропорционирование (конпропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления, например:
NH4NO3 → N2O + 2H2O
ОВР – реакции, протекающие с изменением степеней окисления атомов элементов веществ, участвующих в реакции.
Вещества, атомы элементов которых отдают электроны, называются восстановителем.
Вещества, атомы элементов которых принимают электроны – окислители.
Сте́пень окисле́ния (окислительное число, формальный заряд) — вспомогательная условная величина для записи процессов окисления,восстановления и окислительно-восстановительных реакций, численная величина электрического заряда, приписываемого атому вмолекуле в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов.
Электронное уравнение
MnSO4+PbO2+HNO3 -> HMnO4+Pb(NO3)2+PbSO4+H2O Mn(2+) - 5e- -> Mn(7+) Mn(2+) восстановитель,окисляется Pb(4+) + 2e- -> Pb(2+) Pb(4+) окислитель,восстанавливается 2x5=10 2Mn(2+) - 10e- -> 2Mn(7+) 5Pb(4+) + 10e- -> 5Pb(2+) 2MnSO4 + 5PbO2 + 6HNO3 -> 2HMnO4+3Pb(NO3)2+2PbSO4+2H2O
26. Мицеллы (уменьшительное от лат. mica — частица, крупинка) — частицы вколлоидных системах, состоят из нерастворимого в данной среде ядра очень малого размера, окруженного стабилизирующей оболочкойадсорбированных ионов и молекул растворителя. Например, мицелласульфида мышьяка имеет строение:
{(As2S3)m•nHS−•(n-x)H+}x-•хН+
Средний размер мицелл от 10−5 до 10−7см.
Строение коллоидной мицеллы
Лиофобные коллоиды обладают очень высокой поверхностной энергией и являются поэтому термодинамически неустойчивыми; это делает возможным самопроизвольный процесс уменьшения степени дисперсности дисперсной фазы (т.е. объединение частиц в более крупные агрегаты) – коагуляцию золей. Тем не менее золям присуща способность сохранять степень дисперсности – агрегативная устойчивость, которая обусловлена, во-первых, снижением поверхностной энергии системы благодаря наличию на поверхности частиц дисперсной фазы двойного электрического слоя и, во-вторых, наличием кинетических препятствий для коагуляции в виде электростатического отталкивания частиц дисперсной фазы, имеющих одноименный электрический заряд.
Строение структурной единицы лиофобных коллоидов – мицеллы – может быть показано лишь схематически, поскольку мицелла не имеет определенного состава. Рассмотрим строение коллоидной мицеллы на примере гидрозоля иодида серебра, получаемого взаимодействием разбавленных растворов нитрата серебра и иодида калия:
AgNO3 + KI ––> AgI + KNO3
Коллоидная мицелла золя иодида серебра (см. рис. 4.9) образована микрокристаллом иодида серебра, который способен к избирательной адсорбции из окружающей среды катионов Ag+ или иодид-ионов. Если реакция проводится в избытке иодида калия, то кристалл будет адсорбировать иодид-ионы; при избытке нитрата серебра микрокристалл адсорбирует ионы Ag+. В результате этого микрокристалл приобретает отрицательный либо положительный заряд; ионы, сообщающие ему этот заряд, называются потенциалопределяющими, а сам заряженный кристалл – ядром мицеллы. Заряженное ядро притягивает из раствора ионы с противоположным зарядом – противоионы; на поверхности раздела фаз образуется двойной электрический слой. Некоторая часть противоионов адсорбируется на поверхности ядра, образуя т.н. адсорбционный слой противоионов; ядро вместе с адсорбированными на нем противоионами называют коллоидной частицей или гранулой. Остальные противоионы, число которых определяется, исходя из правила электронейтральности мицеллы, составляютдиффузный слой противоионов; противоионы адсорбционного и диффузного слоев находятся в состоянии динамического равновесия адсорбции – десорбции.
Схематически мицелла золя иодида серебра, полученного в избытке иодида калия (потенциалопределяющие ионы – анионы I–, противоионы – ионы К+) может быть изображена следующим образом:
{[AgI]m · nI– · (n-x)K+}x– · x K+
При получении золя иодида серебра в избытке нитрата серебра коллоидные частицы будут иметь положительный заряд:
{[AgI]m · nAg+ · (n-x)NO3–}x+ · x NO3–
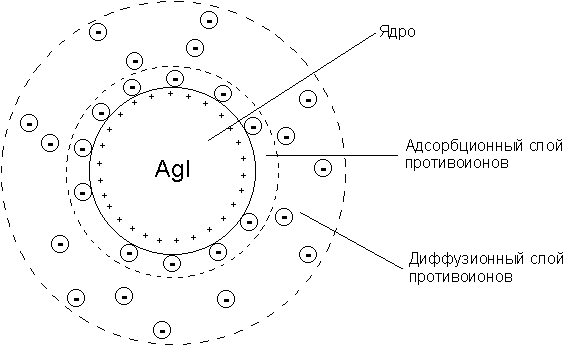
Рис. 4.9. Строение коллоидной мицеллы
27. Стандартный водоро́дный электро́д — электрод, использующийся в качестве электрода сравнения при различных электрохимических измерениях и в гальванических элементах. Водородный электрод (ВЭ) представляет собой пластинку или проволоку из металла, хорошо поглощающего газообразный водород (обычно используют платину или палладий), насыщенную водородом (при атмосферном давлении) и погруженную в водный раствор, содержащий ионы водорода. Потенциал пластины зависит[уточнить] от концентрации ионов Н+ в растворе. Электрод является эталоном, относительно которого ведется отсчет электродного потенциала определяемой химической реакции. При давлении водорода 1 атм., концентрации протонов в растворе 1 моль/л и температуре 298 К потенциал ВЭ принимают равным 0 В. При сборке гальванического элемента из ВЭ и определяемого электрода, на поверхности платины обратимо протекает реакция:
2Н+ + 2e− = H2
то есть, происходит либо восстановление водорода, либо его окисление — это зависит от потенциала реакции, протекающей на определяемом электроде. Измеряя ЭДС гальванического электрода при стандартных условиях (см. выше) определяют стандартный электродный потенциал определяемой химической реакции.
ВЭ применяют для измерения стандартного электродного потенциала электрохимической реакции, для измерения концентрации(активности) водородных ионов, а также любых других ионов. Применяют ВЭ так же для определения произведения растворимости, для определения констант скорости некоторых электрохимических реакций.
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
