
- •Предисловие
- •Часть 1. Молекулярные основы наследственности
- •Введение в молекулярную биологию.
- •1.2. Макромолекулы как обьекты изучения молекулярной биологии
- •1.2.1. Белки.
- •1.2.2. Строение, функции и свойства днк.
- •Молекулярная организация генов.
- •Рнк и её роль в сохранении и реализации наследственной информации.
- •Лекарственные средства, влияющие на синтез нуклеиновых кислот и белков.
- •1.3. Экспрессия генов и её регуляция
- •1.4. Организация геномов неклеточных и клеточных организмов
- •Геном бактерий
- •Организация генома эукариот.
- •Часть 2. Молекулярные основы наследственных заболеваний
- •2.1. Молекулярные механизмы генных, хромосомных и геномных мутаций
- •2.2. Регуляция клеточного цикла. Апоптоз. Онкогенетика.
- •Часть 3. Современные вопросы генных технологий
- •3.1 Исследование нуклеиновых кислот. Методы днк-диагностики
- •3.2 Методы генной инженерии
- •3.3 Клонирование организмов и клеток.
- •Приложения контрольно-обучающие вопросы
- •Ответы на контрольно – обучающие вопросы
- •Терминологический словарь
- •Литература
- •Содержание
- •Часть 1. Молекулярные основы наследственности 4
- •Часть 2. Молекулярные основы наследственных заболеваний 120
- •Часть 3. Современные вопросы генных технологий 167
Геном бактерий
Генетическая система бактерий имеет, по крайней мере, четыре особенности, присущие только этим организмам.
1. Хромосомы бактерий (и, соответственно, плазмид) располагаются свободно в цитоплазме, не отграничены от нее никакими мембранами, но связаны с определенными рецепторами на цитоплазматической мембране. Поскольку длина хромосомы (у Е.соli около 1мм) во много раз превышает длину бактериальной клетки (1,5—3,0 мкм в среднем), хромосома особым компактным образом в ней упакована; молекула хромосомной ДНК находится в суперспирализованной форме и свернута в виде петель, число которых составляет 12—80 на хромосому. Петли в центре нуклеоида объединяются за счет связывания ДНК с сердцевинной структурой, представленной молекулами особого класса РНК — 4,5S РНК. Такая упорядоченная упаковка обеспечивает постоянную транскрипцию отдельных оперонов хромосомы и не препятствует ее репликации. Возможно, что петли упакованной хромосомы способствуют компартментализации рибосом.
2. Хотя бактерии являются гаплоидными организмами, т. е. имеют один набор генов, содержание ДНК у них непостоянно, оно может при благоприятных условиях достигать значений, эквивалентных по массе 2, 4, 6 и даже 8 хромосомам. У всех прочих живых существ содержание ДНК постоянное, и оно удваивается (кроме вирусов и плазмид) перед делением.
3. У бактерий в естественных условиях передача генетической информации происходит не только по вертикали, т. е. от родительской клетки дочерним, но и по горизонтали с помощью различных механизмов: конъюгации, сексдукции, трансдукции, трансформации.
4. У бактерий очень часто помимо хромосомного генома имеется дополнительный плазмидный геном, наделяющий их важными биологическими свойствами, нередко — специфическим (приобретенным) иммунитетом к различным антибиотикам и другим химиопрепаратам.
Содержание ДНК у бактерий зависит от условий их роста: при благоприятных условиях оно возрастает до величин, соответствующих массе нескольких хромосом. Это уникальное свойство бактериального генома. Биологическое значение его состоит в том, что, регулируя содержание копий своих генов (а оно будет определяться количеством копий синтезируемых хромосом), бактерии одновременно приспосабливают скорость своего размножения применительно к условиям роста. Наряду с увеличением содержания ДНК у бактерий в этом случае существенно возрастает и количество рибосом.
Благодаря этому создаются необходимые условия для транскрипции и трансляции (а у бактерий они происходят одновременно) нескольких копий генов одновременно, возрастает суммарная скорость биосинтеза всех субклеточных и клеточных структур и, соответственно, скорость размножения бактерий. Время клеточного цикла бактерий сокращается от нескольких часов до 20-30 мин. Скорость размножения определяет возможность накопления в окружающей среде большого запаса клеток данного вида. Это и является причиной того, что бактерии существуют в природе многие миллионы лет. Возможность регулировать скорость собственного размножения — одно из главных условий, обеспечивающих выживание бактерий в окружающей среде, а, следовательно, и сохранение вида в природе.
Наименьшая свободноживущая клетка – Mycoplasma, состоит из цитоплазмы, окруженной элементарной мембраной, толщиной 75 А. Клетка содержит менее 109 атомов (не считая воды), геном (ДНК длиной 2,28мм), 400 рибосом. Масса белка около 5,10-15гр., что эквивалентно 60 000 белковых молекул с молекулярным весом 50 000 каждая.
Табл.5. Минимальный (256) набор генов, необходимый живой клетке
-
Функция белков
Число белков
Преобразование энергии
28
Транспорт и метаболизм аминокислот
11
Транспорт и метаболизм нуклеотидов
20
Транспорт и метаболизм углеводов
5
Метаболизм липидов
6
Метаболизм кофакторов
8
Биогенез рибосом и трансляция
94
Репликация, рекомбинация, репарация, транскрипция
35
Структурная функция
7
Секреция и адгезия
5
Шапероны
13
Транспорт неорганических ионов
4
Предсказана гипотетическая функция
15
Функция неизвестна
4
Сравнение наборов генов M. genitalium и H. Influenzae позволило установить минимальный набор генов, необходимый живой клетке (табл. 5).
Все, что бактерия умеет делать кодируется ее генетическим аппаратом. То есть восприятие сигналов из внешней среды зависит от того, какие рецепторы находятся на мембране клетки, а рецепторы кодируются бактериальной ДНК. На примере кишечной палочки рассмотрим, как устроен геном бактерии. У кишечной палочки двуцепочечная ДНК замкнута в кольцо. Это кольцевая молекула состоящих из 4,6 млн. пар нуклеотидов, что соответствует молекулярной массе 3 х 106 Да. Длина молекулы составляет порядка 1.5 мм. Время репликации этой молекулы 20 мин. Есть бактерии, которые размножаются медленнее, чем кишечная палочка.
Структура бактериальной ДНК как кольцевой была предложена в 1956 году Жакобом и Вольманом. Это было революционное предположение, так как до этого считалась, что ДНК линейная. Но революция во взглядах произошла еще раз, когда выяснилось, что геном бактерии может быть представлен как кольцевой, так и линейной молекулой ДНК (табл.6). Кроме основной молекулы ДНК у нее могут встречаться (а могут и отсутствовать) плазмиды – небольшие (3-5 тысяч нуклеотидов) кольцевые или линейные ДНК, часто несущие гены устойчивости к антибиотикам и другие необязательные системы. Именно из-за наличия плазмид (а они способны передаваться горизонтально от клетки к клетке, даже между бактериями разных видов), распространение устойчивости к антибиотикам происходит очень быстро между всеми бактериями, живущими в одном месте.
Таким образом, в состав генома бактерий могут входить как кольцевые, так и линейные молекулы ДНК. И геном может состоять из одной или из нескольких молекул ДНК, называемых хромосомами или плазмидами. Если гены, которые содержаться на дополнительной молекуле, необходимы клетке, то эта молекула называется минихромосомой, а если без них клетка может обойтись – то плазмидой.
Размеры молекул ДНК указывают в парах оснований, п.н. или bp (base pairs). Для больших фрагментов используют т.п.н. или kb (kilo base)=103 bp и Mb (mega base)= 106 bp. Геномы бактерий - от 0.58 Mb у Micoplasma genitalium до 9.5 Mb у Myxococcus xanthus

Табл.6. Геномы некоторых бактерий
Метод определения последовательности нуклеотидов, или секвенирование, был разработан в 70-х годах. Две группы ученых независимо друг от друга разрабатывали эти методы. Один из них был разработан Сэнгером, второй – Максамом и Гилбертом, и все они получили в 1980 году Нобелевскую премию. До сих пор созданные ими принципы используются при секвенировании, сейчас уже проводимом не вручную, а автоматами.
В 1995 году был прочтен первый относительно небольшой геном бактерии Haemophilus influenzae. Это было огромным достижением, очень большой сенсацией. До этого удавалось определить полностью только геномы вирусов, которые на порядок меньше геномов бактерий. На настоящий момент полностью прочитаны геномы более 100 видов бактерий, среди которых представители таких родов патогенных бактерий, как Streptococcus, Staphylococcus, Corynebacterium, Yersinia и др. В табл.7 приведены некоторые примеры расшифрованных геномов бактерий.
Как показали геномные исследования, патогенные бактерии весьма разнообразны по комбинаторике генов, определяющих патогенность. У них имеются специфические гены, контролирующие синтез факторов вирулентности (адгезины, инвазины, порины, токсины, гемолизины). Большинство таких генов собрано в кластеры («островки патогенности»). Они могут быть локализованы в хромосоме бактерии или в плазмидах.
«Островки патогенности» участвуют в геномных перестройках, что и определяет приспособляемость и широкую внутривидовую вариабельность бактерий. Поскольку геномы бактерий небольшие (от 100 000 до 4 млн пар нуклеотидов), многое удалось уже сделать в области функциональной геномики. И структурные, и функциональные исследования геномов патогенных бактерий
Табл.7. Некоторые патогенные бактерии, геномы которых секвенированы
Бактерия (штамм) |
Болезнь |
Размер генома п.н. |
Mycoplasma pneumoniae |
Пневмония |
816 |
Mycobacterium tuberculosis |
Туберкулёз |
4411 |
Neisseria meningitidis |
Менингит |
2272 |
Vibrio cholerae (El-Tor) |
Холера |
4033 |
Helicobacter pylori |
Гастрит, язвенная болезнь |
1667 |
Treponema pallidum |
Сифилис |
1138 |
Chlamidia trachomatis |
Трахома |
106 |
Hemophilus influenzae |
Отиты, ОРЗ |
1830 |
показывают их высокую пластичность. Эти представления имеют непосредственное практическое значение, во-первых, для разработки экспресс-методов типирования бактерий и оценки риска бактериальной контаминации; во-вторых, для создания лекарств, нацеленных на специфические мишени, блокирующие работу генов патогенности; в-третьих, для более целенаправленного создания вакцин.
Сейчас можно очень многое узнать о неизвестной бактерии, если прочесть ее геном. По тому, какие гены входят в состав генома, можно определить, какой образ жизни ведет бактерия. Это важно для возбудителей различных заболеваний – по составу их генов можно установить, к каким веществам они чувствительны, и точно подобрать лекарство или создать новый эффективный препарат для лечения. К примеру, размер генома паразитической бактерии микоплазмы (Mycoplasma genitalium) – 580000 пар нуклеотидов. 90% ее генома кодирует белки, 10% содержат регуляторные последовательности белков, т.е. белки не кодирует. У нее 468 генов (это можно с точностью определить по нуклеотидной последовательности генома) и самый высокий процент кодирующих последовательностей. Она живет в постоянных условиях внутри клетки, ей мало, что нужно регулировать. У других бактерий большую долю занимают кодирующие белки, а у человека, по сравнению с бактериями, кодирующие белки занимают намного меньшую часть генома (2%). В принципе, это соответствует развитию общества: все меньшую часть занимает производство, и все большую часть занимает сервис и информационные технологии. Разное количество генов отвечает за разные клеточные фукнции (рис.28).
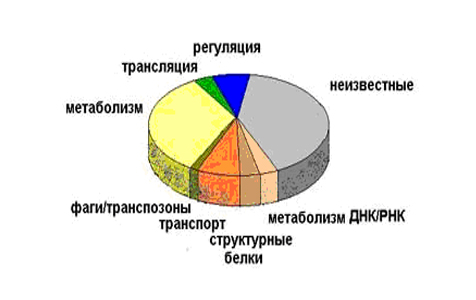
Рис.28. Распределение функций генов Е.cоli, выявленное по полной нуклеотидной последовательности генома
Что означают различия в количестве кластеров рибосомной РНК? Кишечная палочка делится раз в двадцать минут, туберкулезная микобактерия делится раз в сутки. Кстати, это представляет трудности в диагностики туберкулеза (для того, чтобы выделить из мокроты больного эту бактерию, необходимо ее выращивать неделями, чтобы там что-то можно было проанализировать). Из-за того, что она так медленно растет, ей не нужно активно синтезировать рибосомы, поэтому у нее меньше генов, нужных для синтеза рибосом (в 10 раз меньше, чем у свободно живущей и активно растущей Bacillius subtilis).
В геноме бактерий могут присутствовать гены, похожие по нуклеотидной последовательности. Такие гены называются гомологичными (гомо - одинаковый). Гомологичные гены могут появиться в геноме в результате удвоения (дупликации) одного гена. В этом случае их называют паралоги. При наличии в геноме нескольких гомологичных генов они могут приобрести разные функции.
Некоторые гены, сходные по строению, но немного отличающиеся по функциям, имеют большую копийность в геноме. Копийность генов связана с образом жизни бактерий. Это можно сравнить, к примеру, с языком. Так, у народов, занимающихся скотоводством, лошадь имеет множество названий (не как у нас: лошадь, жеребенок, мерин, а множество названий для лошадей разного назначения и разного возраста); у эскимосов много слов, обозначающих снег. Также, в геноме бактерий многокопийны те гены, которые важны для жизни бактерий. Говорят, это те гены, которые обуславливают экологическую специфичность.
Каким же образом, геномы бактерий меняются в процессе эволюции? Все изменения можно классифицировать на пять групп: точечные замены (замены одной «буквы» на другую), дупликации и амплификации (копирование участков генома), делеции (выпадение участков генома), инверсии и транслокации (перестановка участка гена в другую часть генома или изменение его ориентации в геноме), горизонтальный перенос генов (фрагмент ДНК переносится из одной бактерии в другую).
Плазмиды. Впервые обнаруженные у E.coli генетические элементы, которые передавались у нее по наследству во внехромосомном состоянии, получили название просто генетических факторов. Раньше всего были обнаружены Со1-фактор (фактор, контролирующий у E.coli синтез бактерицидных белков, А. Грациа, 1925) и F-фактор (фактор, контролирующий примитивный половой процесс у бактерий — конъюгацию, У. Хэйс, 1953). Интерес к этим факторам сильно возрос после того, как в 1963г. японский ученый Т. Ватанабе сообщил, что передача множественной лекарственной устойчивости у дизентерийных бактерий происходит также при участии независимых от хромосомы генетических элементов, названных R-факторами (от англ. resistanсе — устойчивость). В 1976г. всем подобного рода генетическим элементам было дано название плазмид и следующее определение: «Плазмида (экстрахромосомный генетический элемент) представляет собой репликон, который стабильно наследуется в экстрахромосомном состоянии».
Особенности плазмид.
Геном плазмид представлен только двунитевой ДНК.
Размножение плазмид происходит путем саморепликации их ДНК и не требует синтеза структурных белков и процессов самосборки.
Средой обитания плазмид являются только бактерии.
Плазмиды обладают системами генов, которые наделяют их способностью к самопереносу или к мобилизации на перенос из клетки в клетку.
Плазмиды проникая в бактериальную клетку, не размножаются в ней бесконтрольно и не подавляют функции бактериальной хромосомы, а сосуществуют с ней и сами контролируют образование числа возможных своих копий на хромосому клетки. В отличие от вирусов, плазмиды не только не вызывают гибели клеток, которые являются для них естественной средой обитания, а, наоборот, очень часто наделяют их важными дополнительными (селективными) свойствами. Это основное принципиально важное биологическое различие между плазмидами и вирусами. Плазмиды своим присутствием обеспечивают размножение бактерий в неблагоприятных для них условиях (например, в присутствии химиопрепаратов) и, спасая от гибели бактерии, обеспечивают собственное существование.
В соответствии с теми свойствами, которыми плазмиды наделяют своих носителей, их подразделяют на различные категории (табл.8):
У бактерий очень часто обнаруживают криптические плазмиды, т. е. плазмиды, функции которых еще не установлены. Поэтому классификация их, несомненно, будет уточняться. Уже сейчас известны плазмиды, контролирующие различные факторы патогенности бактерий (факторы адгезии, инвазии и т. п.).
Таблица.8. Классификация плазмид по свойствам, которыми они наделяют своих носителей
-
Категории
Свойства
F - плазмиды
Донорные функции
R - плазмиды
Устойчивость к лекарственным препаратам
Сol - плазмиды
Синтез колицинов
Ent - плазмиды
Синтез энтеротоксинов
Hly - плазмиды
Синтез гемолизинов
Биодеградативные плазмиды
Разрушение различных органических и неорганических соединений, в том числе содержащих тяжелые металлы
Криптические плазмиды
Не известны
Плазмиды распространяются среди бактерий двумя способами: путем передачи от родительской клетки дочерним клеткам в процессе клеточного деления, т. е. по вертикали, и путем переноса между клетками в популяции бактерий независимо от клеточного деления, т.е. по горизонтали. Существует несколько генетических механизмов переноса плазмид между бактериальными клетками:
а) путем трансформации;
б) с помощью трансдуцирующих фагов;
в) путем мобилизации на перенос с помощью конъюгативных плазмид.
Медицинское и общебиологическое значение плазмид. Значение плазмид для медицины состоит в том, что они контролируют синтез различных факторов патогенности у многих видов бактерий, в том числе у возбудителей чумы, сибирской язвы, иерсиниозов. дизентерии, эшерихиозов и др. Не вызывает сомнения, что возникновение диареегенных кишечных палочек (энтеротоксигенных, энтеропатогенных, энтероинвазивных и др.) является следствием приобретения ими плазмид, которые наделяют их факторами адгезии, инвазии и способностью синтезировать термолабильные и термостабильные энтеротоксины. Наличие в природе таких плазмид (особенно с широким кругом хозяев) может стать реальной причиной образования новых вариантов патогенных бактерий.
Не менее важную роль играют R-плазмиды. В условиях широкого применения антибиотиков и других химиопрепаратов происходит естественный отбор тех штаммов патогенных бактерий, которые являются носителями R-плазмид. Среди них формируются новые эпидемические клоны патогенных бактерий. В настоящее время они играют ведущую роль в эпидемиологии инфекционных болезней, и от их распространения во многом зависит эффективность антибиотикo- и химиотерапии, а в итоге — здоровье и жизнь людей.
Общебиологическое значение плазмид заключается в том, что они выполняют, по крайней мере, три важнейшие функции для бактерий, обеспечивая одновременно существование, как бактерий, так и собственное. Во-первых, они контролируют у бактерий обмен генетическим материалом. Во-вторых, контролируя синтез факторов патогенности, они обусловливают благоприятные возможности для размножения патогенных бактерий в естественных для них условиях (в организме животного и человека), а, следовательно, для сохранения этих видов в природе. В-третьих, плазмиды являются уникальным биологическим средством самозащиты бактерий, так как они обеспечивают их приобретенным и наследуемым специфическим иммунитетом против различных химических (лекарственных и иных веществ) и других агентов.
Таким образом, плазмиды сохраняются в природе благодаря взаимовыгодным отношениям, сложившимся между ними и бактериями. Бактерии для них — естественная среда обитания, а они для бактерий — дополнительные свободно циркулирующие между ними геномы с наборами таких генов, которые благоприятствуют сохранению бактерий в природе.
У бактерий обнаружены три типа генов, осуществляющих контроль синтеза факторов патогенности: гены собственной хромосомы; гены, привнесенные плазмидами; гены, привнесенные умеренными конвертирующими фагами. Например, синтез холерогена у Vibrio cholerae осуществляется генами tох-оперона собственной хромосомы. Синтез экзотоксинов и факторов адгезии у энтеротоксигенных штаммов Esherichia coli осуществляется генами, привнесенными Еnt-плазмидами. Синтез эксфолиативного токсина типа А у стафилококков контролируется хромосомным геном, а типа В — плазмидным геном; синтез экзотоксина у Corynebacterium diphtheriae — привнесенными tох-генами коринефага.
Наличие в мире микробов дополнительных источников генов патогенности, носителями которых оказались вирусы и плазмиды, несомненно, явилось одним из факторов возникновения бактерий патогенных для человека и животных.
Лекарственная устойчивость бактерий. Существуют два типа лекарственной устойчивости бактерий: естественная, или природная, и приобретенная.
Естественная лекарственная устойчивость является видовым признаком. Она присуща всем представителям данного вида и не зависит от первичного контакта (контактов) с данным антибиотиком, в ее основе нет никаких специфических механизмов. Чаще всего эта резистентность связана с недоступностью мишеней для данного антибиотика, обусловленной очень слабой проницаемостью клеточной стенки и цитоплазматической мембраны, или какими-либо другими причинами. Если низкая проницаемость существует к нескольким антибиотикам, то она будет обусловливать полирезистентность таких бактерий. Приобретенная лекарственная устойчивость возникает у отдельных представителей данного вида бактерий только в результате изменения ее генома. Возможны два варианта генетических изменений. Один из них связан с мутациями в тех или иных генах бактериальной хромосомы, вследствие которых продукт атакуемого гена перестает быть мишенью для данного антибиотика. Это происходит либо вследствие изменения структуры белка, либо потому, что он становится недоступным для антибиотика.
В другом случае бактерии становятся устойчивыми к антибиотику или даже сразу к нескольким антибиотикам благодаря приобретению дополнительных генов, носителями которых являются R-плазмиды. Никаких других механизмов приобретенной лекарственной устойчивости не существует. Однако, приобретая устойчивость к антибиотику, а тем более сразу к нескольким антибиотикам, такие бактерии получают наивыгоднейшие преимущества: благодаря селективному давлению антибиотиков происходит вытеснение чувствительных к ним штаммов данного вида, а антибиотикоустойчивые варианты выживают и начинают играть главную роль в эпидемиологии данного заболевания. Именно они и становятся источниками формирования тех клонов бактерий, которые обеспечивают эпидемическое распространение возбудителя. Решающую роль в распространении лекарственной устойчивости, в том числе множественной, играют R-плазмиды благодаря способности их к самопереносу.
Биохимические основы антибиотикорезистентности. Можно выделить следующие пять биохимических механизмов формирования резистентности.
Разрушение молекулы антибиотика. Такой механизм лежит, главным образом, в основе формирования устойчивости к бета-лактамным антибиотикам.
Модификация структуры молекулы антибиотика, в результате которой утрачивается ее биологическая активность. Гены, содержащиеся в R-плазмидах, кодируют белки, которые вызывают различные модификации молекул антибиотика путем их ацетилирования, фосфорилирования или аденилирования. Именно таким путем инактивируются аминогликозиды, макролиды, хлорамфеникол, клиндамицин и другие антибиотики.
Изменение структуры чувствительных к действию антибиотиков мишеней. Изменение структуры белков рибосом 70S лежит в основе устойчивости к стрептомицину, аминогликозидам, макролидам, тетрациклинам и другим антибиотикам. Изменение структуры бактериальных гираз в результате мутации приводит к формированию устойчивости к хинолонам; РНК-полимераз — к рифампицину; пенициллинсвязывающих белков (транспептидаз) — к бета-лактамам и т. п.
Образование бактериями «обходного» пути метаболизма для биосинтеза белка-мишени, который оказывается нечувствительным к данному химиопрепарату — механизм, который лежит в основе резистентности к сульфаниламидным препаратам.
Формирование механизма активного выведения из клетки антибиотика, в результате чего он не успевает достичь своей мишени (один из вариантов устойчивости к тетрациклинам).
Необычный механизм устойчивости к изониазиду обнаружен у M.tuberculosis. Действие изониазида на туберкулезную палочку зависит от наличия у последней плазмиды, в составе которой имеется особый ген. Продукт этого гена превращает неактивный изониазид в активную форму, которая разрушает бактериальную клетку. Утрата этого гена обусловливает устойчивость M.tuberculosis к изониазиду.
В некоторых случаях инактивацию антибиотиков, которая лежит в основе резистентности к ним, бактерии могут осуществлять разными механизмами. Так, например, существует три механизма, ответственных за формирование устойчивости к бета-лактамным антибиотикам: слабая проницаемость наружной мембраны клеточной стенки грамотрицательных бактерий, обеспечивающая природную устойчивость; изменение структуры пенициллинсвязывающих белков в результате мутаций, которое приводит к утрате их сродства к антибиотику; продукция бета-лактамаз, разрушающих антибиотик.
Существует три типа устойчивости и к тетрациклинам: 1) устойчивость, определяемая выносом тетрациклина из клетки белком цитоплазматической мембраны; 2) устойчивость, определяемая изменением структуры белка-мишени рибосом; 3) устойчивость, определяемая модификацией тетрациклина в неактивную форму.
Возможно, у бактерий существуют и другие механизмы формирования устойчивости к лекарственным препаратам.
Таким образом, в ответ на мощный натиск, который предпринял человек на бактерии с помощью антибиотиков, они ответили уникальными биологическими реакциями, сила которых не уступает силе атаки. На каждый новый антибиотик бактерии давали адекватный ответ: появлялись резистентные к нему штаммы, которые и сводили на нет биологическую активность этого препарата. Так было и так будет всегда. С этим нельзя не считаться и этого нельзя не учитывать. Поэтому следует предвидеть пути постоянного преодоления этого препятствия, ибо пока существуют инфекционные болезни, их надо уметь эффективно лечить.
Возникает вопрос: каковы возможности и пути образования лекарственной устойчивости у бактерий? Поскольку они опосредуются только на генетическом уровне, то возникает и другой вопрос: откуда появляются новые гены лекарственной устойчивости? Устойчивость, возникающая как следствие мутации, объяснима и понятна, но не она играет основную роль. Основная роль принадлежит генам, которые содержатся в R-плазмидах. Они ведь не могут возникать сразу, de novo, это исключено. Следовательно, в природе должен существовать своеобразный фонд генов лекарственной устойчивости, откуда бактерии могут постоянно «захватывать» те гены, которые необходимы для них в данной ситуации. Наиболее вероятно, что такой генофонд образуется за счет генов, имеющихся у продуцентов антибиотиков. Каждый из них защищен от синтезируемого им антибиотика. Эта самозащита контролируется соответствующим геном. Следовательно, сколько бы ни было в природе антибиотиков, против каждого из них должен быть и ген самозащиты, ген устойчивости к этому антибиотику. В природе, особенно в почве, а также в кишечнике человека и животных микроорганизмы сосуществуют в столь тесных взаимоотношениях, что это обеспечивает им постоянную возможность обмена генетическим материалом с помощью различных механизмов, в том числе с помощью конъюгации. Так как многие гены лекарственной устойчивости несут в себе транспонируемые элементы, то это обеспечивает им возможность к большой мобильности. Они могут перемещаться внутри хромосомы, переходить из хромосом в плазмиды, формировать новые варианты плазмид и подвергаться другим превращениям.
Таким образом, обмен генами лекарственной устойчивости между микроорганизмами в естественных условиях, очевидно, вполне возможен. Решающую роль в их распространении среди возбудителей инфекционных заболеваний человека и животных начинает играть уже сам антибиотик. Жизнь показала, что раньше всего гены лекарственной устойчивости к каждому новому антибиотику появляются у клинических штаммов, а затем начинается их дальнейшая циркуляция в природе. Обладая определенной мобильностью, эти гены сами подвергаются модификации, мутациям, а в результате образуют группы, семейства генов, определяющих устойчивость к различным вариантам модифицированного антибиотика. Хотя многое еще придется изучить в этом плане, но общая тенденция и масштабы развития у бактерий лекарственной устойчивости уже вполне объяснимы.
