
- •Предисловие
- •Часть 1. Молекулярные основы наследственности
- •Введение в молекулярную биологию.
- •1.2. Макромолекулы как обьекты изучения молекулярной биологии
- •1.2.1. Белки.
- •1.2.2. Строение, функции и свойства днк.
- •Молекулярная организация генов.
- •Рнк и её роль в сохранении и реализации наследственной информации.
- •Лекарственные средства, влияющие на синтез нуклеиновых кислот и белков.
- •1.3. Экспрессия генов и её регуляция
- •1.4. Организация геномов неклеточных и клеточных организмов
- •Геном бактерий
- •Организация генома эукариот.
- •Часть 2. Молекулярные основы наследственных заболеваний
- •2.1. Молекулярные механизмы генных, хромосомных и геномных мутаций
- •2.2. Регуляция клеточного цикла. Апоптоз. Онкогенетика.
- •Часть 3. Современные вопросы генных технологий
- •3.1 Исследование нуклеиновых кислот. Методы днк-диагностики
- •3.2 Методы генной инженерии
- •3.3 Клонирование организмов и клеток.
- •Приложения контрольно-обучающие вопросы
- •Ответы на контрольно – обучающие вопросы
- •Терминологический словарь
- •Литература
- •Содержание
- •Часть 1. Молекулярные основы наследственности 4
- •Часть 2. Молекулярные основы наследственных заболеваний 120
- •Часть 3. Современные вопросы генных технологий 167
Часть 3. Современные вопросы генных технологий
3.1 Исследование нуклеиновых кислот. Методы днк-диагностики
Методы исследования нуклеиновых кислот. Методы выделения ДНК из растительных и животных тканей и её очищение. Ферменты, используемые для генно-инженерных исследований. Рестриктазы. ДНК-зонды. Электрофорез ДНК. Идентификация фрагментов ДНК и РНК методами гибридизации. Саузерн-, Норзерн-, Вестерн-блоттинг. Клонирование фрагментов нуклеиновых кислот in vitro. Полимеразная цепная реакция. Секвенирование ДНК.
Методы ДНК-диагностики. Показания к ДНК-диагностике. Прямые и непрямые методы. ДНК-чипы. Молекулярно-генетические методы исследования в судебной медицине.
Методы исследования нуклеиновых кислот. Молекулярно-генетические методы — большая и разнообразная группа методов, в конечном счете, предназначенных для выявления вариаций в структуре исследуемого участка ДНК (аллеля, гена, региона хромосомы) вплоть до расшифровки первичной последовательности оснований. В основе этих методов лежат «манипуляции» с ДНК и РНК. В результате бурного развития молекулярной генетики человека в 70—80-х годах и последующего успешного изучения генома человека молекулярно-генетические методы широко вошли в медико-генетическую практику.
Чтобы познакомить с сутью и терминологией молекулярно-генетических методов, ниже схематично описаны их основные этапы и варианты. Освоение этих методов, как и других методов лабораторной диагностики, требует специальной подготовки в соответствующих лабораториях.
Получение образцов ДНК (или РНК) является исходным этапом всех методов. Этот этап реализуется в двух вариантах: а) выделение всей ДНК (тотальной или геномной) из клеток; б) накопление определённых фрагментов, которые предполагается анализировать, с помощью ПЦР (полимеразная цепная реакция).
Источником геномной ДНК могут быть любые ядросодержащие клетки. Выделенная из клеток ДНК представляет собой весь геном организма, поэтому такие образцы называют геномной ДНК. На практике чаще используют периферическую кровь (лейкоциты), хорион, амниотические клетки, культуры фибробластов. Для одного анализа необходимо иметь (в зависимости от используемого метода) от нескольких нанограммов до нескольких микрограммов ДНК. Для этого требуется действительно небольшое количество биологического материала, например 20—40 мг хориона, 1 мл крови, 5—10 мг культуры клеток. Для осуществления некоторых методов достаточно иметь 1 каплю крови, соскоб эпителия со щеки или несколько волосяных луковиц. Возможность проведения молекулярно-генетического анализа с небольшим количеством легкодоступного биологического материала является методическим преимуществом методов названной группы. К этому ещё можно добавить, что выделенная ДНК одинаково пригодна для проведения различных вариантов методов и может долго сохраняться в замороженном виде.
Для выделения ДНК используют различные методики в зависимости от поставленных задач. Их суть заключается в экстракции (извлечении) ДНК из биопрепарата и удалении или нейтрализации посторонних примесей для получения препарата ДНК с чистотой, пригодной для постановки ПЦР.
Иногда бывает достаточно прокипятить образец в течение 5-10 мин., однако в большинстве случаев требуются более сложные методы.
Стандартной и ставшей уже классической считается методика получения чистого препарата ДНК по Мармуру. Она включает в себя ферментативный протеолиз с последующей депротеинизацией и переосаждением ДНК спиртом. Этот метод позволяет получить чистый препарат ДНК. Однако он довольно трудоемок и предполагает работу с такими агрессивными и имеющими резкий запах веществами, как фенол и хлороформ.
Одним из популярных в настоящее время является метод выделения ДНК, предложенный Boom с соавторами. Этот метод основан на использовании для лизиса клеток сильного хаотропного агента - гуанидина тиоционата (GuSCN), и последующей сорбции ДНК на носителе (стеклянные бусы, диатомовая земля, стеклянное «молоко» и.т.д.). После отмывок в пробе остается ДНК, сорбированная на носителе, с которого она легко снимается с помощью элюирующего буфера. Метод удобен, технологичен и пригоден для подготовки образца к амплификации. Однако возможны потери ДНК вследствие необратимой сорбции на носителе, а также в процессе многочисленных отмывок. Особенно большое значение это имеет при работе с небольшими количествами ДНК в образце. Кроме того, даже следовые количества GuSCN могут ингибировать ПЦР. Поэтому при использовании этого метода очень важен правильный выбор сорбента и тщательное соблюдение технологических нюансов. Следует отметить, что из-за большого количества стадий добавления и удаления растворов при работе с образцом требуется аккуратность, т.к. возможна перекрестная контаминация между пробами образующейся аэрозолью ДНК.
Другая группа методов пробоподготовки основана на использовании ионообменников типа Chilex, которые, в отличие от стекла, сорбируют не ДНК, а наоборот, примеси, мешающие реакции. Как правило, эта технология включает две стадии: кипячение образца и сорбция примесей на ионообменнике. Метод чрезвычайно привлекателен простотой исполнения. В большинстве случаев он пригоден для работы с клиническим материалом. К сожалению, иногда встречаются образцы с такими примесями, которые невозможно удалить с помощью ионообменников. Кроме того, некоторые микроорганизмы не поддаются разрушению простым кипячением. В этих случаях необходимо введение дополнительных стадий обработки образца.
При массовом скрининге, когда важно получить статистические данные, возможно использование простых методов с применением детергентов или обработки биологического материала щелочами с последующей их нейтрализацией. В то же время, использование подобных методов пробоподготовки для клинической диагностики может приводить к ложноотрицательным результатам, вследствие использования в реакционной смеси некачественного препарата ДНК.
Таким образом, к выбору метода пробоподготовки следует относиться с пониманием целей проведения предполагаемых анализов.
Образцы тканей, получаемые при хирургических операциях, обычно фиксируют формалином и заливают в парафин. Такие фиксированные препараты также могут использоваться для проведения ПЦР.
Ферменты, используемые для генно-инженерных исследований. Рестриктазы. Одним из важнейших инструментов генной инженерии являются эндонуклеазы — ферменты, расщепляющие ДНК по специфическим последовательностям нуклеотидов внутри цепи. Эти ферменты получили название рестриктаз. Рестриктазы расщепляют ДНК на относительно небольшие фрагменты в участках строго определенных последовательностей. Этим их воздействие отличается от большинства других ферментативных, химических или физических воздействий, приводящих к случайным разрывам цепей ДНК. Рестриктазы (уже открыто более 200 типов ферментов этого класса) являются частью защитной системы бактерий, охраняющих собственный геном от чужеродной, главным образом вирусной ДНК. Рестриктазы принято именовать по названию бактерий, из которых их выделяют. Так, название EcoRI свидетельствует о том, что этот фермент из Esherichia coli, ВатН1 — из Bacillus amilolquefacientsi. Каждый фермент узнает определенную 4-7-членную последовательность в двухцепочечной ДНК. Разрезание ДНК по этим сайтам приводит к образованию либо «тупых» (например, при действии рестриктаз Hpal), либо «липких», то есть перекрывающихся (например, ВатН1), концов. Для конструирования гибридных молекул особенно удобны липкие концы. Любой фрагмент ДНК обладает характерным расположением сайтов узнавания различных рестриктаз, что позволяет строить так называемые рестриктазные карты. При расщеплении ДНК какой-либо одной рестриктазой получают смесь фрагментов, каждый из которых имеет одни и те же концевые участки. Такие фрагменты можно разделить и идентифицировать методом электрофореза в агарозном или полиакриламидном геле.
Часть ферментов, применяемых для исследования ДНК, представлена в таблице 10.
ДНК-зонды. Информация обо всем многообразии организма заключена в его генетическом материале. Так патогенность бактерий определяется наличием в них специфического гена или набора генов, а наследственное генетическое заболевание возникает в результате повреждения определенного гена. Сегмент ДНК детерминирующий данный биологический признак имеет строго определенную последовательность и может служить диагностическим маркером.
В основе многих быстрых и надежных диагностических методов лежит гибридизация нуклеиновых кислот - спаривание двух комплиментарных сегментов разных молекул ДНК.
Табл.10. Основные ферменты, используемые в генной инженерии
-
Фермент
Реакция
Область приложениия
Рестриктазы
Расщепляют ДНК по специфическим последовательностям нуклеотидов
Получение фрагментов ДНК, создание химерных молекул ДНК
Нуклеаза
Деградация как 5'-, так и 3 '-концов ДНК
Образование концевых делеций в молекулах ДНК
ДНК-лигаза
Катализирует образование связей между молекулами ДНК
«Сшивание» фрагментов ДНК
ДНК-полимераза I
Синтез двухцепочечной ДНК по ДНК-матрице
Синтез двухцепочечной ДНК
ДНКаза1
Вносит одноцепочечные разрывы в ДНК
Картирование участков в ДНК
Экзонуклеаза-Ш
Удаляет нуклеотиды с 3 '-концов ДНК
Секвенирование ДНК
Экзонуклеаза
Удаляет нуклеотиды с 5-концов ДНК.
Секвенирование ДНК
Обратная транскриптаза
Синтезирует ДНК по РНК-матрице
Синтез кДНК по мРНК: картирование ДНК
В диагностических тестах, основанных на гибридизации нуклеиновых кислот, ключевыми являются три компонента: ДНК-зонд, ДНК-мишень и метод детекции гибридизационного сигнала.
Система детекции должна быть в высшей степени специфичной и высокочувствительной.
Чтобы обеспечить адекватность диагностического теста гибридизационные ДНК- и РНК-зонды должны быть высокоспецифичнными. Другими словами необходимо, чтобы зонд гибридизовался только с искомой нуклеотидной последовательностью. Если есть вероятность получения ложноположительного (наличие гибридизационного сигнала в отсутствии последовательности мишени) или ложноотрицательного (отсутствие сигнала при наличии последовательности - мишени) результата, то целесообразность применения теста значительно снижает специфичность зондов, которая может проявляться на разных уровнях: они могут «различать» два и более вида, отдельные штаммы в пределах одного вида или разные гены. В зависимости от ситуации зонды могут быть представлены молекулами ДНК и РНК; они могут быть длинными (более 100 нуклеотидов) или короткими (менее 50 нуклеотидов), представляют собой продукт химического синтеза, клонированные интактнные гены или их фрагменты.
Зонды получают разными способами. Один из них состоит в следующем. ДНК патогенного микроорганизма расщепляют с помощью рестрицирующей эндонуклеазы и клонируют в плазмидном векторе. Затем проводят скрининг рекомбинантных плазмид с использованием геномной ДНК как патогенного, так и непатогенного штаммов. Те плазмиды, которые содержат последовательности, гибридизующиеся только с ДНК патогенного штамма, составляют основу видоспецифических зондов. После этого проводят ряд дополнительных гибридизаций с ДНК, выделенными из различных организмов, чтобы удостовериться, что потенциальные зонды не дают с ними перекрестной гибридизации для определения чувствительности метода каждый из зондов проверяют также на модельных образцах, в том числе и на смешанных культурах. Весьма желательно, чтобы ДНК-диагностику можно было проводить на исходном материале, без дополнительного его культивирования или выделения нуклеиновых кислот, особенно в тех случаях, когда тестируются клинические образцы. Исследователи с успехом проводят гибридизацию с ДНК- мишенями, присутствующими в образцах кала, мочи, крови, смывах из зева и тканях без предварительной их очистки. Если концентрация последовательности мишени в исследуемом образце слишком мала, ее можно амплифициравать с помощью ПЦР.
В качестве примера использования ДНК-зонда для диагностики заболеваний можно привести процедуру обнаружения Plasmodium falciparum. Этот паразит вызывает малярию, заболевание, которое угрожает примерно трети всего населения Земли. Он инфицирует эритроциты и разрушает их, что приводит к развитию лихорадки, а в тяжелых случаях к поражению мозга, почек и других органов. Чтобы выявить источники инфекции, оценить эффективность мер по их ликвидации и обеспечить раннюю диагностику и лечение, необходимо достаточно чувствительные, простые и недорогие методы. В настоящее время малярию диагностируют с помощью микроскопического исследования мазков крови - эффективного, но трудоемкого и занимающего много времени процесса. Иммунологические методы обнаружения Plasmodium, такие как ELISA, достаточно быстрые и их легко автоматизировать, но с их помощью нельзя отличить текущую инфекцию от прошедшей, поскольку при этом определяются только наличие антител к Plasmodium в крови больного. Для избирательной ДНК-диагностики текущей инфекции, т.е. для выявления ДНК-возбудителя, в качестве основы используют высокоповторяющиеся последовательности ДНК Plasmodium falciparum. Сначала с помощью ДНК-зонда проводят скрининг библиотеки геномной ДНК паразита. Затем отбираются клоны дающие наиболее интенсивный гибридизационный сигнал, поскольку именно они предположительно содержат высокоповторяющиеся последовательности. ДНК каждого из отобранных клонов проверяют на способность к гибридизации с ДНК видов Plasmodium, не вызывающих малярию. В качестве специфического зонда выбирается последовательность гибридизующейся ДНК с Plasmodium falciparum, но не с ДНК Plasmodium vivax, Plasmodium cynomolgi или с ДНК человека. С его помощью можно обнаружить всего 10 пг очищенной ДНК Plasmodium falciparum или 1 нг той же ДНК в крови больного.
Получено и охарактеризовано более 100 различных ДНК-зондов, позволяющих обнаруживать патогенные штаммы различных бактерий, вирусов и паразитических простейших. Так имеются зонды для диагностики бактериальных инфекций человека, вызываемых Legionella рheumoniae (респираторные заболевания), Salmonella typhimurium (пищевое отравление), Campylobacter hyointestinalis (racтриты), a также для выявления энтеротоксичного штамма Escherichia coli (гастроэнтериты) однако это лишь «верхушка айсберга»; в принципе с помощью гибридизации можно выявлять практически любые патогенные микроорганизмы.
В большинстве лабораторий для гибридизации используют зонды, меченные каким-либо радиоактивным изотопом, чаще всего 32Р. Такие зонды обладают высокой удельной радиоактивностью и обеспечивают хорошие отношение сигнал / шум. Радиоактивный меченый зонд наносят на фильтр с фиксированной на нем ДНК-мишенью, проводят гибридизацию, отмывают несвязавшуюся ДНК-зонд и детектируют метку с помощью радиоавтографии.
Однако 32Р является короткоживущим изотопом, испускающим высокоэнергетическое излучение; при работе с ним необходимо использовать специальное оборудование и обеспечить безопасную утилизацию отходов. Чтобы обойти эти трудности, были созданы не радиоактивные системы детекции. Для усиления гибридизационного сигнала в этом случае используется ферментативное превращение хромогенного или хемилюминесцентного субстрата: первый из них под действием фермента изменяют окраску, а второй - испускает свет.
Один из недавно разработанных нерадиоактивных методов детекции основан на использовании зонда - «молекулярного маяка».
Такой зонд состоит из 25 нуклеотидов. К 5' концу присоединен флуоресцентный хромофор, а к 3' концу - не флуоресцентный хромофор, на который передается энергия возбуждения флуорофора. В растворе при комнатной температуре маяк имеет такую конфигурацию, при которой флуорофор и тушитель находиться в тесном контакте и флуоресценция флуорофора тушится. Когда 15 средних нуклеотидов зонда гибридизуется с комплементарной последовательностью ДНК- и РНК-мишени, происходит пространственное разделение флуорофора и тушителя и зонд испускает свет. Необходимо также, чтобы все 15 нуклеотидов зонда были комплементарными соответствующей последовательности ДНК- и РНК-мишени.
Электрофорез фрагментов ДНК обеспечивает разделение этих фрагментов при их распределении на поверхности агарозного или полиакриламидного геля. Фрагменты ДНК движутся в геле, помещённом в постоянное электрическое поле, от отрицательного полюса к положительному в зависимости от размеров (чем больше относительная молекулярная масса фрагмента, тем медленнее он движется в электрическом поле). После окончания электрофореза каждый фрагмент ДНК занимает определённое положение в виде дискретной полосы в конкретном месте геля. Длину каждого фрагмента можно определить путём сравнения пройденного фрагментом расстояния с расстоянием, пройденным стандартным образцом ДНК с известными размерами.
Идентификация фрагментов ДНК и РНК методами гибридизации в геле является либо конечным этапом диагностики, либо необходимым элементом дальнейшего анализа. Для идентификации и выделения, интересующих исследователя клонов бактерий с химерной ДНК разработан метод гибридизации в бактериальных колониях. Для этого на многочисленные колонии бактерии, выращенные на твердой среде, сначала накладывают нитроцеллюлозный фильтр. Часть бактерий прилипает к фильтру. После лизиса клеток, денатурации и фиксирования ДНК фильтр инкубируют в растворе с радиоактивно меченым зондом. По окончании гибридизации фильтр отмывают от избытка зонда и выявляют образовавшийся меченый гибридный комплекс путем контакта с рентгеновской пленкой. Сравнивая положение пятна на радиоавтографе с положением колоний на чашке, выбирают ту из них, которая дала положительный сигнал.
Все разновидности методов гибридизации базируются на комплементарных взаимодействиях азотистых оснований разных цепей нуклеиновых кислот. Точное соответствие последовательностей гибридизующихся фрагментов приводит к быстрому образованию прочного устойчивого комплекса.
В целом методы гибридизационного анализа можна разделить на два типа:
методы гибридизационного анализа, проводимые в растворе (гомологичные);
методы гибридизационного анализа, проводимые на твердом носителе (гетерогенные).
Метод гибридизации в растворе. При гибридизации в растворе искомая нуклеиновая кислота и зонд свободно взаимодействуют в водной реакционной смеси, что повышает скорость процесса гибридизации. Детекцию результатов гибридизации в растворе осуществляют путем нуклеазного гидролиза одноцепочечных ДНК и выделения оставшихся двухцепочечных гибридов, содержащих меченый зонд.
Для успешного проведения реакции гибридизации в растворе необходимо применять одноцепочечные зонды, неспособные к самогибридизации. Метод хорош еще и тем, что требует минимальных объемов и количеств биологического и клинического образцов, поэтому может быть использован в диагностических целях. В то же время этот метод имеет один существенный недостаток — на его основе можно создать диагностические тест-системы для выявления специфических фрагментов небольших участков ДНК при условии достаточно высокой концентрации искомых фрагментов или участков в исследуемом образце. Это снижает порог чувствительности до уровня иммуноферментного анализа и даже ниже.
Метод гибридизации на твердом носителе. Принцип метода основан на гибридизации зонда на твердой поверхности. В качестве твердой поверхности чаще всего используют полимерный мембранный фильтр, например, нейлоновую мембрану.
В большинстве случаев процедуру проведения анализа можно разделить на следующие стадии: подготовка образца (в том числе экстракция и выделение ДНК), фиксация пробы на носителе, предгибридизация, собственно гибридизация, отмывание не связавшихся продуктов, детекция.
Для подготовки пробы, может быть, необходимо предварительное «подращивание» исследуемого материала для идентификации отдельных колоний бактерий или увеличение концентрации вирусов в клеточной культуре. Проводится и непосредственный анализ образцов клеток, мочи, уретральных соскобов, форменных элементов крови или цельной крови на присутствие инфекционных агентов. Для освобождения нуклеиновых кислот из состава клеточных структур проводят лизис клеток, а в некоторых случаях очищают препарат ДНК с помощью фенола. Денатурация ДНК, т.е. переход в одноцепочечную форму, происходит при обработке щелочью. Затем образец нуклеиновой кислоты фиксируют на носителе — нитроцеллюлозной или нейлоновой мембране, обычно путем инкубации от 10 мин до 4 ч при 80°С в вакууме. Далее в процессе предгибридизации достигается инактивация свободных мест связывания для уменьшения неспецифического взаимодействия зонда с мембраной. После чего искомые фрагменты ДНК (РНК) комплементарно связываются со специфическим зондом, и тогда данный метод называют ДНК-зондовой диагностикой. Далее осуществляют детекцию одним из возможных методов (авторадиографическим, ферментативно-гибридизационным и т.д.).
Метод «сэндвич»- гибридизации. Метод является одной из разновидностей зондовой технологии (DNA-probe). При его использовании применяются два зонда, гомологичные различным участкам искомой нуклеиновой кислоты. Один зонд фиксируют на мембране для того, чтобы связать искомую нуклеиновую кислоту, присутствующую в исследуемом образце. После осуществления гибридизации мембрану отмывают от исследуемого материала и добавляют раствор, содержащий второй зонд, который имеет определенную метку. Процесс гибридизации проводят повторно, и при этом зонд с меткой взаимодействует с искомым участком ДНК (РНК).
Методы блот-гибридизации. Идентификация конкретных фрагментов в геле среди геномной ДНК является более сложной задачей. Из-за больших размеров генома человека после рестрикции образуется настолько большое число рестриктных фрагментов, что агарозный гель после электрофореза и окраски этидия бромидом при ультрафиолетовом облучении выглядит как более или менее равномерно окрашенная поверхность. Задача генетика — выявить специфические фрагменты ДНК.
ДНК, разделенную гель-электрофорезом, можно перенести с геля на нитроцеллюлозный фильтр. Для этого ее денатурируют в геле щелочью, нейтрализуют гель, и затем прикладывают к нему нитроцеллюлозный фильтр, обеспечивая медленный ток буфера через гель и фильтр. Денатурированная ДНК диффундирует и задерживается на фильтре, после нагревания, которого в вакууме она «запекается» и иммобилизуется, т. е. обездвиживается на фильтре. Ее распределение на плоскости фильтра точно такое же, как и на плоскости геля. Однако в отличие от геля фильтр с ДНК можно использовать для последующей гибридизации с меченой пробой, т. е. с мечеными ДНК и РНК. Для этого инкубируют фильтр с раствором, содержащим меченую пробу, при повышенной температуре, затем тщательно отмывают его и, наконец, подвергают авторадиографии, т. е. выдерживают с рентгеновской фотопленкой. При проявлении последней на ней выявляются полосы, соответствующие полосам ДНК на фильтре, сгибридизовавшимся с радиоактивной пробой.
Процедура переноса ДНК с геля на фильтр обозначается английским термином blotting (промокание). Поэтому для таких фильтров с ДНК используется термин «блот» (blot). По имени автора Э. Саузерна эти блоты называются «блотами Саузерна» (Southern blots).
Вместо ДНК можно перенести на фильтры с геля РНК. Такие фильтры называют Норзерн-фильтрами [игра слов: фамилия Саузерн означает «южный»; фильтры с ДНК по Саузерну — южные блоты; фильтры с РНК шутливо обозначили как северные блоты (Northern); фильтры с белками— как западные (Western)].
Чтобы проводить гибридизацию с Саузерн- и Норзерн- фильтрами, содержащими весьма малые количества индивидуальных ДНК и РНК, были нужны очень высокомеченные пробы. Их научились делать путем энзиматического введения метки в выделенные препараты нуклеиновых кислот. Наиболее распространенный метод — это так называемая ник-трансляция (nick-translation). ДНК инкубируют с двумя ферментами, ДНК-полимеразой I и ДНКазой I (последняя берется в ничтожных количествах вместе с высокомеченными предшественниками ДНК, дезоксирибонуклеозидтрифосфатами). ДНКаза вносит в двухцепочечную ДНК одноцепочечные разрывы. На эти места садится ДНК-полимераза и разрушает одну из цепей ДНК, одновременно заново ее застраивая, но используя при этом меченые предшественники. Таким образом, большая часть ДНК замещается радиоактивной, сохраняя при этом свою нуклеотидную последовательность. Есть и другие методы включения метки в ДНК и РНК.
Рассмотрим блот-гибридизацию по Саузерну (1975). Эта методика состоит из нескольких этапов этапов (рис.49).
После окончания электрофореза гель помещают в раствор основания (щелочи), в котором двухцепочечные фрагменты ДНК теряют связи и становятся одноцепочечными.
Перенос ДНК с геля на нитроцеллюлозный или нейлоновый фильтр производится в буферном растворе. Непосредственно на поверхность геля кладут фильтр и стопку фильтровальной бумаги. Из-за капиллярного эффекта создаётся ток буфера, перпендикулярный плоскости геля. Вымываемая из геля ДНК задерживается фильтром и практически полностью оказывается на его поверхности. После переноса одноцепочечные нити фиксируют на фильтре. Расположение фрагментов на фильтре точно соответствует их расположению в геле.
Для того чтобы визуально выявить нужные фрагменты (фиксированная на фильтре ДНК не видна), проводят гибридизацию со специфическим по нуклеотидной последовательности меченым радионуклидом или флюоресцентной
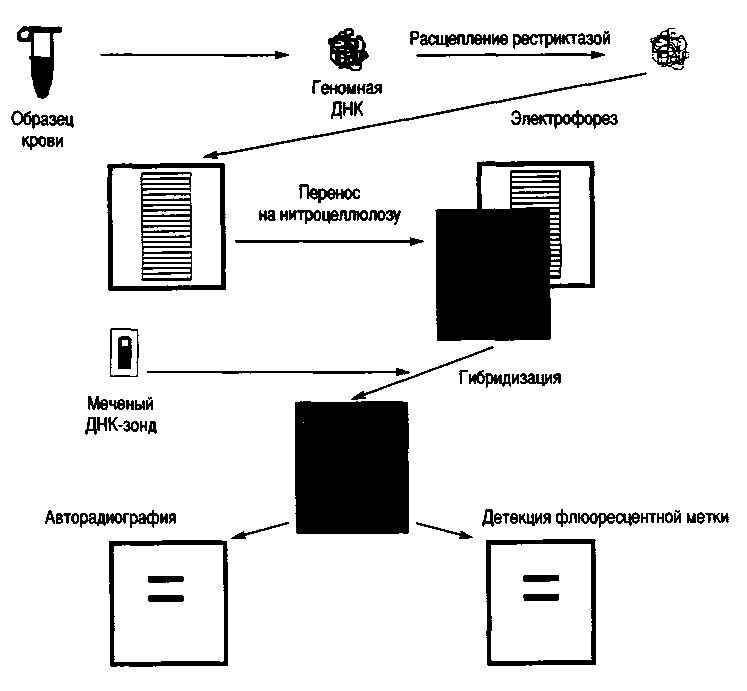
Рис.49. Блот-гибридизация по Саузерну
меткой олигонуклеотидным синтетическим зондом (16—30 пар нуклеотидов) либо клонированным фрагментом ДНК. Нуклеотидная последовательность зонда должна быть полностью или частично комплементарна изучаемому участку геномной ДНК.
При инкубации фильтра с раствором, содержащим меченый зонд, происходит гибридизация комплементарных цепей ДНК-зонда и фрагмента на фильтре. Неспецифически связанные молекулы зонда отмываются с помощью специальной процедуры. Радиоактивно меченые участки выявляют путём экспонирования фильтра с рентгеновской плёнкой (авторадиография). После проявления на плёнке видны полосы меченной зондом ДНК. Нерадиоактивные метки визуализируют с помощью флюоресценции или опосредованно с помощью антител. Блот-гибиридизация — высокочувствительный, но дорогостоящий и трудоемкий метод выявления специфических последовательностей ДНК.
Метод норзерн-блот-гибридизации — Northern-blot. Метод используется для определения уровня экспрессии гена путем количественной оценки иРНК. Метод сложный и длительный по выполнению (5—7 суток). Трудности связаны с необходимостью блокировать при выделении РНК так называемые РНКазы, которые чрезвычайно стабильны и устойчивы по отношению ко многим химическим процедурам, применяемым при экстракции РНК. Процедуры блот-гибридизации по Э. Саузерну и нозерн-блот-гибридизации не нашли применения в клинической микробиологии, поскольку они трудоемки. Точками приложения данных методов явились задачи, связанные с проведением научных исследований и задач по изучению геномной структуры ДНК (РНК), а также для выявления точечных мутаций.
Метод гибридизации in situ (ISH - in situ hybridization). Метод основан на проведении процессов гибридизации непосредственно на срезе или в мазке с использованием любых зондов. Частная методика гибридизации in situ — FISH (fluorescent in situ hybridization), позволяет установить наличие патогена в препаратах, фиксированных в формалине, и залитых парафином срезах и пунктатах ткани, что особенно важно при патоморфологическом анализе. Метод гибридизации in situ базируется на основных принципах гибридизации твердофазной и гибридизации в растворе. Чувствительность метода гибридизации in situ ограничена возможностью проникновения зондов внутрь клеток для связывания с искомой мишенью. Процесс гибридизации проходит в тканях, при этом зонд снабжен флуоресцентной меткой. После промывки материала и удаления несвязавшихся молекул осуществляется детекция, для чего мазок или срез просматривают в флуоресцентном микроскопе. Метод ISH сложен для осуществления и по сравнению с другими молекулярными методами малочувствителен. Метод наиболее удобен для определения мишеней, например, вирусов в инфицированных клетках, которые представлены большим числом копий.
Метод разветвленной ДНК (branch-DNA). Искомая нуклеиновая кислота связывается с улавливающим зондом, один конец которой комплементарен мишени, а другой — определенному концу усиливающего зонда. При этом усиливающий зонд может быть комплементарен следующему зонду и т.д. Количество зондов может быть велико, и все они связаны с несколькими (от одного до нескольких десятков) люминофорами, которые по мере увеличения количества связанных зондов усиливают (хеми-, флуоро-) люминесценцию. Преимуществом данного метода является возможность использования в одной реакции нескольких улавливающих и связывающихся с мишенью зондов, что обеспечивает выявление агентов, характеризующихся значительной геномной гетерогенностью, например, вирус иммунодефицита человека.
В последнее время в практике нашел применение метод гибридизации в растворе с зондами, мечеными акридином. Результаты гибридизации регистрируют по испусканию меткой света определенной длины волны после обработки щелочью.
В настоящее время ведутся интенсивные разработки по совершенствованию методов гибридизации в следующих направлениях:
Упрощение процедуры генного зондирования до одной — двух стадий процесса.
Отказ от сорбции на мембране.
Повышение чувствительности гибридизационных методов за счет использования процедуры амплификации сигнала с зонда.
Активные разработки по третьему направлению стали возможными лишь с момента появления и внедрения в практику методов амплификации нуклеиновых кислот.
Клонирование фрагментов нуклеиновых кислот in vitro. Полимеразная цепная реакция (ПЦР). В большинстве случаев для успешной диагностики болезни или гетерозиготного состояния достаточно исследовать лишь небольшой фрагмент генома, поэтому для проведения анализа необходимо получить достаточное количество таких фрагментов, т.е. амплифицировать (умножить) их. Ранее эта задача решалась с помощью трудоёмкого подхода: создание рекомбинантной плазмиды - введение плазмиды в бактериальную клетку - размножение бактериальных клеток - выделение заданных фрагментов ДНК. Теперь эта задача - накопление нужных фрагментов ДНК - решается с помощью ПЦР. Открытие данной реакции совершило подлинную революцию в изучении генома человека и в молекулярно-генетической диагностике наследственных болезней.
Полимеразная цепная реакция (ПЦР) — метод амплификации ДНК in vitro. В течение нескольких часов можно размножить определённую последовательность ДНК в количестве, превышающем исходное в миллион раз и более. Следовательно, исходно требуется очень незначительное количество материала. Необходимым условием для проведения ПЦР является знание нуклеотидной последовательности амплифицируемого фрагмента или, по крайней мере, этого фрагмента (рис.50).
В соответствии с нуклеотидной последовательностью концов исследуемого участка синтезируется два олигонуклеотидных праймера (затравки). Длина праймеров составляет 20—30 пар нуклеотидов.
Процесс амплификации заключается в осуществлении повторяющихся циклов. Каждый цикл включает 3 стадии: температурная денатурация ДНК (разделение двухцепочечной ДНК на одноцепочечные молекулы) - присоединение праймеров к комплементарным последовательностям одноцепочечных молекул (отжиг) - синтез полинуклеотидных цепей на одноцепочечных молекулах в границах присоединенных праймеров с помощью полимеразы.
Впервые состав ингредиентов, входящих в реакционную смесь для постановки полимеразной цепной реакции, и основные принципы использования праймеров для получения копий ДНК были описаны Kleppe с соавт. в 1971 году. Однако тогда еще не была продемонстрирована основная черта ПЦР - экспоненциальное увеличение количества копий фрагмента исходной ДНК как результат реакции. Это было осуществлено в 1985 г. Последующее использование в ПЦР термостабильной ДНК-полимеразы существенно расширило возможности ее применения, как в научных целях, так и в клинике. Метод стал настолько популярен, что сегодня уже трудно представить работу в области молекулярной биологии без его использования. Особенно бурное развитие метод полимеразной цепной реакции получил благодаря международной программе «Геном человека». Были созданы современные лазерные технологии сиквенирования (расшифровки нуклеотидных последовательностей ДНК). Если в недавнем прошлом для расшифровки последовательности ДНК размером в 250 пар нуклеотидов (п.н.) требовалась неделя, то современные лазерные секвенаторы позволяют определять

Рис.50. Три этапа ПЦР-анализа
до 5000 п.н. в день. Это в свою очередь способствует значительному росту информационных баз данных, содержащих последовательности ДНК. В настоящее время предложены всевозможные модификации ПЦР, показана возможность создания тест-систем для обнаружения микроорганизмов, выявления точечных мутаций, описаны десятки различных применений метода. В настоящее время ПЦР используется при диагностике: генетических, инфекционных и онкологических заболеваний; патогенов в пище; идентификации личности; в судебной медицине, криминалистике; при трансплантации органов и тканей; определении отцовства. В отличие от иммуноферментного анализа, который широко используется для диагностики инфекционных заболеваний, ДНК-диагностика позволяет определять непосредственно возбудителя заболевания. С помощью усовершенствованных схем постановки ПЦР можно выявлять патогенные микроорганизмы в очень низкой концентрации.
ДНК-диагностика рака ограничивается небольшим, но активно возрастающим количеством сведений о генах, ассоциированных с раком. В рамках проекта «Геном человека» ученые продолжают поиски мутаций, ассоциированных с этим типом заболеваний.
Полимеразная цепная реакция - это осуществляемая in vitro специфическая амплификация нуклеиновых кислот, инициируемая синтетическими олигонуклеотидными праймерами; ее основные этапы представлены на рис. ПЦР-цикл состоит из тепловой денатурации ДНК, ее отжига с праймером и удлинения цепи (элонгации); смена этих этапов происходит в результате простого изменения температуры. Праймеры при этом ориентируются на матрице так, что число раундов репликации растет экспоненциально, соответственно увеличивается и число копий специфической нуклеотидной последовательности.
Применение молекулярных методов для целей клинической диагностики ограничивается их невысокой чувствительностью и длительностью анализа. Так, для выявления нуклеиновой кислоты-мишени методом гибридизации in situ с присутствовала в препарате в нескольких тысячах копий. Нередко число аномальных последовательностей в клиническом препарате диагностически- значимо, но меньше этой величины и гибридизация может дать ложноотрицательный результат. В отличие от этого ПЦР позволяет выявить уникальную нуклеотидную последовательность. Для этого в реакционную смесь добавляют в большом избытке специфичные для данной последовательности олигонуклеотидные праймеры («амплимеры»), которые образуют с ней комплекс, и проводят репликацию ДНК in vitro. Поскольку амплимеры гибридизуются с обеими цепями ДНК, то и нативная последовательность, и синтезируемые ПЦР-продукты могут служить матрицами в последующих раундах репликации, в результате чего число копий уникальной последовательности экспоненциально увеличивается. Благодаря этому последовательности, присутствующие в клиническом препарате в минимальном количестве (одна или несколько копий) и не обнаруживаемые никакими другими методами, легко выявляются с помощью ПЦР. ПЦР позволяет найти всего одну аномальную последовательность на 100000-1000000 нормальных клеток.
Экспоненциальное увеличение числа копий молекулы-мишени не только обеспечивает высокую чувствительность метода, но и облегчает их выявление. Каждый раунд ПЦР занимает от 2 до 5 мин, и обычно для достижения необходимой чувствительности достаточно 25-50 раундов, т. е. 2-4 ч (рис.51). Кроме того, поскольку содержание ПЦР-продуктов достаточно велико, можно использовать неизотопные методы детекции.
Амплификация РНК. Возможность использования РНК в качестве мишени для ПЦР существенно расширяет спектр применения этого метода. Например, геномы многих вирусов (гепатита С, вирус инфлюэнцы, пикорнавирусы и т.д.) представлены именно РНК. При этом в их жизненных циклах отсутствует промежуточная фаза превращения в ДНК. Для детекции РНК необходимо в первую очередь перевести ее в форму ДНК. Для этого используют обратную транскриптазу, которую выделяют из двух различных вирусов: avian myeloblastosis virus и Moloney murine leukemia virus. Использование этих ферментов связано с некоторыми трудностями. Прежде всего, они термолабильны и поэтому могут быть использованы при температуре не выше 42° С. Так как при такой

Рис.51. Полимеразная цепная реакция
температуре молекулы РНК легко образуют вторичные структуры, то эффективность реакции заметно снижается и по разным оценкам приблизительно равна 5%. Предпринимаются попытки обойти этот недостаток используя в качестве обратной транскриптазы термостабильную полимеразу, полученную из термофильного микроорганизма Thermus thermophilus, проявляющего транскриптазную активность в присутствии Mn2+. Это единственный известный фермент, способный проявлять как полимеразную, так и транскриптазную активность.
Для проведения реакции обратной транскрипции в реакционной смеси также как и в ПЦР должны присутствовать праймеры в качестве затравки и смесь 4-х дНТФ, как строительный материал.
После проведения реакции обратной транскрипции, полученные молекулы кДНК могут служить мишенью для проведения ПЦР.
Подбор праймеров. ПЦР-праймеры, или амплимеры, обычно имеют размер от 18 до 25 нуклеотидов. Их можно синтезировать с помощью автоматических синтезаторов ДНК, имеющихся в большинстве крупных исследовательских центров. Количества получаемых таким образом олигонуклеотидов (0,2—1 мкмолей) обычно достаточно для проведения нескольких сотен или тысяч ПЦР-реакций. Часто в 5’-концевой участок праймеров для упрощения клонирования ПЦР-амплифицированной ДНК вводят сайты узнавания для рестриктирующих эндонуклеаз.
Подбор праймеров - ключевое звено ПЦР, поскольку именно ими определяется возможность амплификации и выявления нужной последовательности, а также чрезвычайная гибкость метода. Простое варьирование праймеров позволяет выявлять многие патогенные микроорганизмы и генетические нарушения при минимальных изменениях в методике.
ПЦР-амплифицированные фрагменты ДНК имеют разный размер. Он определяется суммой размера праймеров и расстояния между их 3’-концами и в большинстве случаев лежит в диапазоне 100—300 нуклеотидов. Возможна амплификация (но обычно менее успешная) последовательностей-мишеней длиной более 1000 п.н. Скорость репликации с помощью ДНК-полимеразы Tag составляет 35—100 нуклеотидов в секунду.
Таg-полимераза. В 1980 году полимеразная активность была открытая у некоторых форм термофильных бактерий. Таg-полимераза была выделена из бактерий вида Thermus aquaticus, способных расти при температуре 70-75°С. Молекулярный вес очищенного протеина 94 кД и оптимальная температура полимеразной активности 70-80°С. Активность фермента уменьшается, но полимераза не денатурируется при 90°С, при снижении температуры до 70-80°С уровень активности восстанавливается.
Tag-полимераза имеет очень высокую скорость синтеза. При оптимальных условиях фермент может достраивать до 150 основ на секунду. При низкой температуре активность падает до 2 основ на секунду. Время полужизни Таg-полимерази при 95°С составляет 40 минут.
Секвенирование ДНК — определение нуклеотидной последовательности. В настоящее время разработаны методы определения полной нуклеотидной последовательности любой молекулы ДНК. При решении этой задачи необходимо иметь большое количество идентичных фрагментов молекул ДНК. Наработку интересующих последовательностей можно осуществить клонированием соответствующего фрагмента, например, методом ПЦР. Метод секвенирования по Максаму — Гилберту основан на химическом расщеплении ДНК по определенному основанию. Другой ферментативный метод (метод Сэнгера) базируется на применении аналогов нуклеотидов, прерывающих синтез комплементарной цепи ДНК по одноцепочечной матрице в месте встраивания в цепь соответствующего аналога. Секвенирование позволяет определить полную нуклеотидную последовательность всех хромосом, всего ДНК любого генома, любого организма. Это уже почти полностью сделано для некоторых бактерий, мухи дрозофилы, мыши и человека. Кроме того, этот метод позволяет определить последовательность нуклеотидов любых генов, что дает возможность их синтеза.
Методы ДНК-диагностики. Прямые и косвенные методы ДНК-диагностики. Виды ДНК-диагностики: подтверждающая, пресимптоматическая, носительства, пренатальная.
Принципиально различают прямую и косвенную ДНК-диагностику моногенных наследственных болезней. Прямые методы возможны лишь при условии, что ген заболевания клонирован, известна его экзон-интронная организация или нуклеотидная последовательность полноразмерной комплементарной ДНК. При прямой диагностике предметом анализа являются мутации гена. Главным преимуществом прямых методов диагностики является почти 100% эффективность.
Однако в большинстве случаев наследственных заболеваний ген не клонирован или заболевание является генетически гетерогенным, т.е. обусловлено повреждениями в разных генах, либо молекулярная организация гена не позволяет использовать прямые методы. Эти трудности могут быть преодолены с помощью косвенных методов ДНК-диагностики, основанных на использовании сцепленных с геном полиморфных маркёров. В этом случае определяется гаплотип хромосомы, несущей мутантный ген в семьях высокого риска, т.е. у родителей больного и его ближайших родственников. Такой подход возможен практически для всех моногенных заболеваний с известной локализацией гена.
Прямые методы поиска мутаций. В ДНК-диагностике в настоящее время используются разнообразные прямые методы. Наиболее просто обнаруживаются мутации, изменяющие длину амплифицированных фрагментов ДНК, которые выявляются при электрофоретическом анализе.
Для выявления точковых мутаций, небольших делеций и инсерций в исследуемых генах используется множество различных подходов, основанных на методе ПЦР, благодаря которому можно многократно увеличить уникальную последовательность ДНК, а затем проанализировать её на предмет мутации. С помощью специфических олигонуклеотидных праймеров проводят амплификацию кодирующих участков геномной ДНК в случае, если известна экзон-ннтронная структура исследуемого гена.
Если структура гена не известна, то получают кДНК-продукты путем обратной транскрипции мРНК, выделенной из клеток больных. Продукты амплификации являются объектами дальнейшего поиска мутаций с помощью ряда методов, позволяющих выявлять небольшие структурные изменения.
Методы, основанные на технологии ПЦР. В общем случае секвенирование полноразмерной кДНК, или всех экзонов, для определения мутаций у отдельных пациентов достаточно трудоемко, дорого и требует больших затрат времени. Поэтому на практике чаще проводят предварительный отбор более простыми методами амплификации фрагментов ДНК, предположительно содержащих мутации, а затем секвенируют только эти участки ДНК. Методы поиска фрагментов ДНК, содержащих мутации, основаны на сравнительном анализе мутантных и нормальных последовательностей по целому ряду физических и химических характеристик, которые в значительной степени варьируют в зависимости от типа мутационного повреждения. Следует подчеркнуть, что независимо от метода детекции мутации точные молекулярные характеристики каждой мутации могут быть получены только путем прямого секвенирования.
Наиболее просто обнаруживаются мутации, изменяющие длину амплифицированных фрагментов, так как подобные нарушения легко выявляются при электрофоретическом анализе. Протяженные делеции, захватывающие целые экзоны в генах, сцепленных с полом, могут успешно выявляться при использовании так называемого мультиплексного варианта ПЦР. Разница в размерах и числе амплифицированных фрагментов позволяет легко идентифицировать такие мутации при электрофорезе. Данный подход применим к анализу делеций в аутосомных генах только в тех случаях, когда возможно дополнить ПЦР количественной оценкой результатов амплификации. Оригинальный метод идентификации подобных делеций у гетерозигот основан на использовании в качестве матричной ДНК для ПЦР кДНК, полученной путем обратной транскрипции мРНК, изолированной из экспрессирующих данный ген тканей пациента. В отличие от нормального гомолога, в мутантной молекуле кДНК экзоны граничащие с делецией сближены. Для обнаружения гетерозигот по протяженным внугригенным делециям проводят мультиплексную ПЦР с использованием системы олигопраймеров, полностью перекрывающих всю молекулу кДНК. Наличие делеций регистрируют по появлению продуктов амплификации необычного размера.
После выявления различий между нормальной и мутантной ДНК по длине амплифицированного фрагмента необходимо провести секвенирование необычного фрагмента с целью определения изменений в нуклеотидной последовательности предположительно мутантной ДНК.
При мутациях гена, представляющих собой замену одного или нескольких нуклеотидов, длины амплифицированных фрагментов остаются постоянными, однако некоторые физико-химические свойства мутантных молекул меняются. С учетом этих особенностей разработаны различные варианты поиска мутантных фрагментов ДНК и идентификации в них точковых мутаций. Ведущими из этих методов являются: метод анализа информационного полиморфизма однонитевой ДНК (SSCP), метод анализа гетеродуплексов (НА), денатурирующий градиентный гель-электрофорез (DGGE) и метод химического расщепления некомплементарных сайтов (ССМ).
SSCP (Single Strand Conformation Polymorphism) — метод анализа конформа-ционного полиморфизма однонитевой ДНК — основан на регистрации различий в электрофоретической подвижности однонитевых ДНК, одинаковых по величине, но различающихся вследствие нуклеотидных замен по пространственной организации молекул. Конформация небольших однонитевых ДНК зависит от нуклеотидной последовательности, поэтому замена даже одного нуклеотида приводит к изменению пространственной структуры. Метод включает амплификацию фрагментов ДНК размером до 300 пар нуклеотидов, денатурацию продуктов ПЦР и высокоразрешающий электрофорез в полиакриламидном геле.
Конформационный метод выявления точковых мутаций получил широкое распространение вследствие относительной простоты и возможности обнаруживать любые типы замен. Однако ограничением применения этого метода является размер исследуемого фрагмента ДНК, так как высокая эффективность детекции мутаций, составляющая 80—95%, показана при длине фрагментов менее 200 пар нуклеотидов, в то время как для фрагментов более 400 пар нуклеотидов вероятность обнаружения мутаций уменьшается до 50%.
В настоящее время разрешающая способность метода значительно повышена. В частности, разработаны подходы для идентификации точковых мутаций методом SSCP-анализа в амплифицированных фрагментах ДНК размером до 800 пар нуклеотидов. Для этого используется полиакриламидный гель с низким значением рН.
НА (Heteroduplex Analysis) позволяет выявлять мутации, находящиеся в гетерозиготном состоянии, а также инсерции и делеции. Принцип этого метода заключается в следующем.
При амплификации фрагментов генов гетерозигот, последующей денатурации и медленной ренатурации полученных продуктов ПЦР в амплификационной смеси наряду с двумя типами гомодуплексов образуются гетеродуплексы между нормальной и мутантной цепями ДНК. Такие гетеродуплексные молекулы отличаются по электрофоретической подвижности от гомодуплексов за счет конформационных особенностей в местах несовпадения нуклеотидов, поскольку электрофоретическая подвижность гетеродуплексов значительно ниже, чем гомодуплексов. Эти различия обнаруживаются при электрофорезе в обычном полиакриламидном геле.
На сегодняшний момент наиболее распространенным способом скрининга мутаций является комбинация анализа гетеродуплексов и метода однонитевого конформационного полиморфизма, позволяющая выявить точковые мутации почти в 100% случаев и не требующая больших затрат времени.
DGGE — денатурирующий градиентный гель-электрофорез. В этом методе ДНК-дуплексы подвергаются миграции в геле с градиентом денатурирующих условий (может быть использован и температурный градиент). Миграция продолжается до тех пор, пока ДНК-дуплексы не достигают в геле точки плавления и не разделяются, после чего миграция фрагментов останавливается. Однонуклеотидные различия в нормальной и тестируемой ДНК выявляются по различной электрофоретической подвижности в геле. Высокая чувствительность метода (95%) достигается благодаря специфическим праймерам с так называемым GC-зажимом, представленным чередованием гуанина и цитозина в количестве до 20 нуклеотидов. За счет этого температура плавления продукта амплификации сильно увеличивается, что повышает эффективность определения мутации. Однако праймеры с GC-зажимом достаточно дороги, поэтому метод используется ограниченно.
ССМ (chemical cleavage of mismatch) — метод химического расщепления неспаренных оснований. Метод основан на гибридизации радиоактивно меченой ДНК-пробы с тестируемой ДНК. Места ошибок затем выявляют с помощью серии химических реакций (модификация с использованием тетрахлорида осмия), которые происходят с однонитевой ДНК в сайтах неправильного спаривания. Этот метод может быть применен для тестирования фрагментов ДНК размером до 1 тыс. пар нуклеотидов, выявляет локализацию ошибки и является довольно чувствительным. Однако он не нашел широкого распространения вследствие токсичности применяемых химических реагентов и методической сложности. Подобное расщепление неспаренных нуклеотидов может быть и энзиматическим, что позволяет избежать токсических химикатов. Метод основан на расщеплении неспаренных оснований в гетеро-дуплексе, образуемом между тестируемой ДНК и нормальной последовательностью посредством таких ферментов, как резолваза фага Т4 или эндонуклеаза VII. Однако этот метод еще более «капризный», чем ССМ.
Заключительным этапом анализа мутаций является их секвенирование, т. е. определение нуклеотидной последовательности фрагмента ДНК, показавшего аномальную электрофоретическую подвижность. Последовательность нуклеотидов этого фрагмента сравнивается с нормой, в результате чего патология приобретает свою окончательную характеристику.
Метод секвенирования. Любые типы мутаций могут быть обнаружены путем прямого секвенирования мутантной кДНК или отдельных экзонов, и часто первичный поиск нарушений в кодирующих областях гена осуществляют именно таким образом. Для некоторых генов, имеющих небольшие размеры, метод прямого секвенирования с успехом применяется как основной метод сканирования мутаций. Так, в частности, особенно удобным оказалось его применение для детекции мутаций в сравнительно небольших по размеру генах, таких, как ген фактора IX свертывания крови (гемофилия В).
Разработанные в последние годы модификации методов ПЦР значительно облегчили секвенирование амплифицированных фрагментов и повысили его эффективность. Так, в частности, предложен вариант асимметричной ПЦР, когда при амплификации концентрация одного из олигопраймеров в несколько десятков раз превосходит концентрацию другого праймера, в результате чего синтезируется преимущественно только одна, нужная для секвенирования цепочка ДНК.
Врач лаборант-генетик заранее определяет стратегию поиска исходя из оснащенности лаборатории.
Многие мутации прерывают синтез белкового продукта. В этих случаях образуются укороченные полипептидные цепи, функционально незначимые. Для диагностики таких мутаций можно применять метод «трансляции белкового продукта». Он проводится в системе in vitro на основе полученной специфической мРНК с добавлением лизата ретикулоцитов (в нём содержатся все необходимые компоненты для синтеза белка). В этой системе синтезируется белковый продукт соответствующего гена. Продукт трансляции анализируют с помощью электрофореза. Изменение электрофоретической подвижности белка свидетельствует о наличии мутации (нонсенс-мутация, нарушение сплайсинга РНК, сдвиг рамки считывания), приводящей к «обрыву» синтеза полипептидной цепочки.
Косвенное выявление мутаций. Косвенное выявление мутаций применяется в тех случаях, когда нуклеотидная последовательность гена ещё не известна и вместе с тем имеется информация об относительном положении гена на генетической карте. Фактически это соответствует диагностике с помощью метода сцепления генов.
Косвенная ДНК-диагностика по существу сводится к анализу полиморфных генетических маркёров у больных и здоровых членов семьи. Маркёры должны быть расположены в том хромосомном регионе, где и ген болезни, т.е. они сцеплены. Такими маркёрами могут быть участки ДНК, существующие в популяции в нескольких аллельных вариантах. Отличия могут быть по составу нуклеотидов, по числу динуклеотидных повторов. На основе вариабельности состава маркерных участков ДНК можно дифференцировать материнское или отцовское происхождение конкретного варианта маркёра, сцепленного с геном болезни. Сцепление означает, что маркёр и ген болезни располагаются близко друг от друга; они передаются в составе одного хромосомного сегмента. Благодаря анализу полиморфных генетических маркёров можно проследить в ряду поколений наследование каждой из родительских хромосом.
Технические приёмы в косвенной диагностике те же самые, что и в прямой диагностике (получение ДНК, рестрикция, электрофорез и т.д.). Естественно, к этому добавляется математический анализ сцепления признаков.
Использование косвенных подходов оказалось возможным благодаря существованию в геноме полиморфных участков (локусов) ДНК. Нуклеотидные замены достаточно часто встречаются в некодирующих участках ДНК. Значительное число нуклеотидных замен приводит к изменению мест рестрикции. Эти изменения можно выявить с помощью блот-гибридизации по Саузерну, поскольку изменяется длина рестриктных фрагментов. Эта разновидность полиморфизма ДНК получила название полиморфизма по длине рестриктных фрагментов.
Расположенный вблизи изучаемого гена или внутри него полиморфный сайт может служить маркёром аллельных вариантов этого гена, в том числе маркёром патологических мутаций.
Полиморфизм, обусловленный нуклеотидными заменами или делециями, как правило, диаллелен, а значит, его информационная ценность ограничена. Более информативными являются кластеры тандемных повторов, которые обусловливают полиморфизм по количеству копий (VNTR — variable number of tandem repeates), так называемый полиморфизм мини- и микросателлитных последовательностей.
Микросателлиты — короткие тандемные повторы, обычно дву-гексануклеотидные. Самым распространённым из них является СА-повтор. Показано, что кластеры СА-повторов встречаются в среднем 1 на 30 тыс. пар нуклеотидов. Они локализованы, как правило, в некодирующих районах ДНК. Блоки СА-повторов демонстрируют менделевское наследование в семьях и не обнаруживают новых мутаций. Немаловажным положительным фактором является относительная простота обнаружения таких повторов в геноме человека. Кроме СА-повторов, достаточно распространены GA-повторы и другие кластеры тандемных повторов (ТТТА)п; (ТСТА)п; (ТТТС)п, также обнаруживающие вариабельность по числу повторов. Широкая распространённость в геноме (частота различных микросателлитов, взятых вместе, составляет 1 на 6 тыс. пар нуклеотидов), высокий уровень полиморфизма делают микро- и минисателлиты идеальными полиморфными маркёрами для картирования генов наследственных заболеваний и проведения косвенной ДНК-диагностики.
Полиморфные ДНК-маркёры и интегральная карта их расположения позволяют определить и проследить в поколениях хромосому, несущую патологический ген, а также подробнейшим образом охарактеризовать определённый хромосомный район, выявить субмикроскопические перестройки, определить наименьший район их перекрывания и локализовать ген-кандидат, ответственный за заболевание.
Основной недостаток косвенных методов диагностики — обязательное предварительное изучение генотипа (гаплотипа) хотя бы одного поражённого родственника. В случае отсутствия поражённых родственников, «доступных» для обследования, проведение диагностики (за редким исключением) становится невозможным.
Итак, даже из схематического описания нетрудно понять, что существует достаточно много молекулярно-генетических методов диагностики наследственных болезней. Эти методы оказались настолько универсальными, что нашли применение не только в медицинской генетике, но и в диагностике инфекционных заболеваний. Для каждого из методов имеется много вариантов. Одни и те же болезни можно диагностировать разными методами. Отсюда нетрудно заключить, что есть большие возможности для диагностики болезни даже в трудных случаях (невозможность обследования родителей, малое количество биологического материала, отсутствие сведений о гене и т.д.).
Автоматизация существующих и разработка принципиально новых подходов к изучению структуры нуклеиновых кислот наряду с ускоренными темпами изучения генома человека и клонирования генов, ответственных за развитие моногенной патологии, позволяют прогнозировать появление в недалеком будущем средств диагностики большинства известных наследственных болезней человека.
Микрочипы. ДНК-микрочипы позволяют осуществлять автоматизированный и высокопроизводительный анализ сложных геномов. Эта технология в ее различных вариантах развивается очень интенсивно. Кратко рассмотрим принципы технологии и ее применения к медицинским проблемам. Простейший принцип микрочипа: в разные квадраты твердой подложки помещаются олигонуклеотиды, соответствующие разным аллелям одного гена. Например, представлено 3 аллельных олигонуклеотида, различающихся одной заменой, которые ковалентно прикреплены к подложке. Эти олигонуклеотиды соответствуют трем вариантам мононуклеотидного полиморфизма (SNP, single nucleotide polymorphism). Таким образом, каждому аллелю отведен на подложке свой квадрат. Зададимся вопросом, какой аллель или какие аллели данного локуса представлены в ДНК пациента. Этот вопрос решается с помощью гибридизации меченной радиоактивно или флюоресцентно пробы ДНК от пациента с микрочипом. Если в этой пробе представлен, например, только аллель 1, то гибридизация будет происходить только с тем квадратом, где иммобилизован олигонуклеотид 1. Если в пробе представлены 2 аллеля (1 и 2), то гибридизация будет происходить с двумя квадратами (1 и 2) и т. д. Микрочипы, содержащие связанные с подложкой олигонуклеотиды, будем далее определять как олигонуклеотидные микрочипы. ДНК-олигонуклеотидный чип, содержащий тысячи олигонуклеотидов, создается современными методами в течение 1 дня. Может быть приготовлена серия микрочипов, содержащая сотни тысяч олигонуклеотидов с заданной последовательностью. Как и в приведенном выше схематическом примере, техника анализа основана на физической гибридизации исследуемой ДНК с множеством олигонуклеотидов, иммобилизованных на твердой подложке. Такой подход предполагает заведомое знание структур аллелей. Его определяют как «приобретение пробы» (gain of probe). Незамедлительным применением такого подхода может стать анализ сцеплений. Если в семье с болезнью сцеплен один из аллелей маркера, тогда как другой аллель (аллели) сцеплен со здоровым геном, то анализ сцеплений может быть выполнен следующим образом:
амплифицируйте у каждого члена семьи полиморфный аллель с помощью праймеров Р1 и Р2,
пометьте амплифицированные продукты с помощью радиоактивной или флюоресцентной метки,
гибридизуйте каждый продукт с микрочипом и выявите квадрат, в котором произошло связывание с меченой пробой. Этот квадрат будет показывать, какой аллель присутствует у данного члена семьи.
Технология может быть использована для анализа полиморфизма генома. В частности, 149 микрочипов, каждый из которых содержал 150 000— 300 000 олигонуклеотидов, были использованы для скрининга 263 млн п. о. последовательности генома человека, и в результате был обнаружен 3241 полиморфный сайт. Следует обратить внимание на то, что во всех случаях исследовалась определенная, небольшая по сравнению с полным геномом, область.
Несмотря на впечатляющие результаты и кажущуюся простоту описанной выше технологии, использующей олигонуклеотидные микрочипы, существует множество проблем, связанных с ее практическим использованием. Микрочипы могут давать высокий уровень ложнопозитивных ответов при обнаружении SNP. Инсерции, вставки, делеции и перегруппировки трудно поддаются анализу этим методом. Повторяющиеся элементы генома также способны вносить серьезные осложнения в анализ.
Помимо детекции мутаций и полиморфизмов, олигонуклеотидные микрочипы предполагают использовать для создания генетической карты третьего поколения. В частности, олигонуклеотиды, соответствующие SNP, легко можно поместить на микрочипы. Поскольку SNP в основном диаллельны, для создания карты их нужно раза в 3 больше, чем мультиаллельных маркеров. Можно предвидеть множество других применений олигонуклеотидных микрочипов, включая анализ сцеплений и ассоциаций, потерю гетерозиготности и ДНК-дактилоскопию.
Другой важный аспект использования олигонуклеотидных микрочипов — анализ экспрессии генов. Анализ особенностей экспрессии генов — один из необходимых элементов для понимания их функций. 20-звенный олигонуклеотид, представляющий определенный ген, по-видимому, достаточен для надежного обнаружения продукта этого гена среди клеточных РНК. Содержание транскриптов может быть измерено вплоть до нескольких копий на клетку. Удается прослеживать экспрессию 10 000 генов на 1 чип. Эта система уже использована для изучения изменений в экспрессии генов в раковых клетках. Сравнение экспрессии 900 генов в 2 клеточных линиях показало, что при опухолевой трансформации 1,7% генов понижало уровень экспрессии, тогда как 7% — повышало.
Для анализа экспрессии генов используют также другой вариант микрочипов, содержащих не олигонуклеотиды. а иммобилизованные кДНК. В случаев кДНК-микрочипов ППР-амплифицированные фрагменты индивидуальных кДНК наносят в разные квадраты микрочипа, так что каждый квадрат ставится в соответствие с определенным геном. ДНК фиксируют в этих квадратах и денатурируют, чтобы сделать ее одноцепочечной. Чип с иммобилизованной ДНК гибридизуют со смесью различно флюоресцентно меченных кДНК, полученных из сравниваемых тканей, точно так же, как это делалось в случае олигонуклеотидных микрочипов.
Недавно кДНК-микрочипы использовали также для анализа различий близкородственных геномов. В этом случае технология была использована для анализа ДНК из клеточных линий и опухолей с известными хромосомными аномалиями, чтобы оценить перспективность метода. Показана возможность обнаружения делеции в одной из хромосом и различия в числе копий хромосом в анеуплоидных клетках.
Хотя исходной идеей использования микрочипов было быстрое секвенирование ДНК, сейчас эта идея отошла на задний план. Однако чипы могут быть использованы для повторного секвенирования уже известных последовательностей. В частности, был ресеквенирован полный митохондриапьный геном длиной 16,6 килобаз, митохондриальный чип содержал 13600025-меров. Полная последовательность была прочитана с 99% точностью, что позволяет осуществить однозначное определение митохондриальных мутаций. Скорость такова, что полная митохондриальная геномная последовательность может быть получена за 12 мин. В настоящее время этот чип используется для изучения вариабельности митохондриальной ДНК в популяциях. Исследуется возможная роль митохондриальных мутаций в нервологических заболеваниях. Понятно, что возможны и другие применения ресеквенирования для анализа известных участков генома.
В частности, микрочипы в усовершенствованном варианте будут использоваться в будущем для анализа природы сложных болезней, который требует полногеномного подхода.
Микрочипы принципиально открывают возможность сравнительного анализа экспрессии практически всех генов в различных клетках. Появляется путь к исследованию влияния громадного разнообразия генетических факторов и факторов окружающей среды на изменения экспрессии. Создаются предпосылки для анализа тотальных изменений экспрессии генома в разных типах клеток при болезнях. Это в свою очередь создает новые возможности для функционального анализа и диагностики.
В изделиях, которые промышленность выпускает для нашего повседневного обихода, используется около 80 тысяч различных химических веществ. И, как ни странно, подавляющее большинство из них никогда полностью не проверялось на вредность. Издавна всякое новое вещество проверяют на животных. Но дело это хлопотное, долгое и дорогое, да и защитники животных, случается, суют палки в колеса. Но самое главное: данные, полученные на животных, не всегда годятся для людей. Так что, стопроцентной уверенности в безвредности того или иного лекарства, пищевой добавки, косметического средства и других веществ, при всем желании, не получается.
Выход из положения сулит применение метода, который предлагает новое научное направление - токсикогеномика. Животные клетки в специальной пробирке входят в соприкосновение с проверяемым веществом. Собственно, это даже не клетки, а так называемые ДНК-чипы. Входящие в ДНК гены реагируют на вещество: одни гены активизируются, другие, наоборот, выключаются, и по этой генной реакции нетрудно определить, безвредно вещество, или нет.
Преимущества нового метода очевидны - говорят его создатели. Традиционные испытания веществ на животных, могут показать, что именно в них действует разрушительно на печень, что вызывает рак или приводит к врожденным физическим недостаткам. Но почему это происходит - останется загадкой. Разрешит ее лишь анализ генной активности.
Новый метод может значительно уменьшить количество подопытных животных - ведь он, в основном, ориентируется на клетки. Правда, в отдельных случаях генная активность проверяется и на живых животных, бывает также необходимо дополнить новый метод традиционным. Но, в целом, тенденция здесь клеточная. Еще один плюс в том, что генная активность может сигнализировать об опасности задолго до появления ее видимых симптомов, например, до появления опухоли. Генетический уровень чувствительнее физиологического. О скорости метода в сравнении с традиционной проверкой на животных, по мнению его сторонников, и говорить не приходится: это преимущество не нуждается в доказательствах.
Однако фармацевтические и химические фирмы относятся к новинке со смешанным чувством. Их представители говорят, что результаты испытаний, проведенных по генетической методике, могут, как это ни парадоксально, быть истолкованы неверно или пристрастно, чем тут же воспользуются защитники окружающей среды и начнут добиваться введения запрета на вполне невинный продукт. «Внедрение в практику ДНК-чипов откроет собой эпоху бесконечных судебных процессов, на которых создатели новых веществ будут терпеть поражение за поражением», - предсказывают специалисты.
«Придраться можно ко всему, особенно, в нашей области, - говорит Джозеф Сайна, токсиколог одной из фармацевтических фирм и редактор журнала «Молекулярная токсикология». - Только бы новый метод не поторопились использовать до того, как он будет доведен до совершенства - тогда ошибок не избежать. Ложные тревоги поведут к неоправданным запретам, а запоздалые тревоги и вовсе скомпрометируют новшество».
Выяснить, какие гены активизируются от контакта с новым веществом, с помощью ДНК-чипов несложно. Когда ген, состоящий из ДНК, становится активным, он создает молекулу РНК, которая сообщает клетке, какой именно белок ей надлежит выработать. Фиксируя эту информационную РНК, ученые видят, какие гены активизировались.
ДНК-чип представляет собой микроскопическую пластинку из стекла или пластика, содержащую тысячи генов. Как различить, что на ней происходит? Обычно информационная РНК из клетки снова превращается в ДНК, после чего окрашивается светящейся краской. Каждый кусочек этой ДНК прилепляется к соответствующей ДНК на чипе, эта точка светится, как светятся и сотни других. Так на чипе возникает паттерн, или рисунок генной активности.
Подобные чипы уже широко применяются. Например, в Боулдере разрабатывают специализированные чипы для онкологии, где сравнивают генную активность в раковых и здоровых клетках. О генной активности будет по-прежнему свидетельствовать мозаика светящихся точек.
Но можно ли истолковать эту мозаику однозначно? Ведь гены в процессе работы организма могут включаться и выключаться по самым разнообразным причинам. В одном случае на генной активности отразится естественная гибель клеток, в другом - это будет реакция на нейтральное вещество. И так далее. «Множество перемен в активности генов не связано с токсичностью, - указывает Крис Кортон из Института токсикологии в Северной Каролине. - Вспомним хотя бы ген, ведающий ферментом, разрушающим многие лекарства и химические вещества. Этот ген включается от углекислого газа, от брюссельской капусты и еще, Бог знает от чего. Фармацевтические фирмы всегда опасаются его неожиданных реакций».
Невзирая на эти сложности, ученые испытывают новым методом сотни веществ с заведомой токсичностью, чтобы пополнить базу генетических данных, с которыми можно будет сравнивать картину, получаемую от веществ с неизвестными свойствами. В США начал работать недавно организованный Центр токсикогеномики, в задачу которого входят как фундаментальные исследования, так и создание такой базы данных, которой могли бы безвозмездно пользоваться все, кто пожелает.
Сознавая многие несовершенства нового метода, ученые говорят, что, в принципе, он работает. Им удалось найти вполне определенные паттерны для таких токсических соединений, как разрушители гормонов, канцерогены и опасные для печени яды. Фирма «Джонсон энд Джонсон» установила, как вели себя гены, когда клетки печени входили в контакт с сотней различных токсичных веществ. Не зная, что это за вещества, компьютер сумел сгруппировать их по типу токсичности. Результаты этой работы опубликованы в последнем выпуске журнала «Токсикологические науки». Другая фирма - «Берринген Ингельхайм» - использовала ДНК-чипы для определения таких типов токсичности, которые в обычных условиях потребовали бы длительных исследований клеток с помощью электронного микроскопа.
Интересное и полезное исследование провела фирма «Phase 1», с которой, кстати, сотрудничают многие из упомянутых фармацевтических компаний. Она обнаружила 260 генов, проявляющих специфическую активность у людей с аллергией на пенициллин. Нередко бывает так, что при клинических испытаниях нового лекарства, прошедшего перед этим проверку на животных, пациенты страдают от побочных эффектов. Теперь, как говорит Спенсер Фар - глава фирмы «Phase 1», можно будет предвидеть генетический ответ пациентов на новое лекарство и не тратить миллионы попусту. Фар убежден, что у нового метода блестящие перспективы.
Разрабатываются и другие методы, позволяющие кардинально улучшить проверку веществ на животных. Один из них, в частности, предлагает генная инженерия. Кроме того, токсикогеномика пока еще дороговата. Один ДНК-чип стоит 1000 долларов. Правда, чипы будут постоянно дешеветь.
Чипы могут и не заметить опасность. Например, побочный эффект от нового лекарства может возникнуть из-за его взаимодействия с другим лекарством. Сложные взаимодействия веществ чипы пока не улавливают. Поводов для сомнений в новом методе почти столько же, сколько и поводов для уверенности в его преимуществах. Так что, обсуждение перспектив токсикогеномики пока в самом разгаре.
Молекулярно – генетические методы исследований в судебной медицине. Прогресс молекулярно-биологической науки открыл новые пути решения проблемы судебно-медицинской идентификации личности, обеспечив возможность выявления индивидуализирующих личность признаков на уровне не фенотипа, а генетической матрицы - клеточной ДНК. Молекулярно-генетические маркерные системы основаны на существовании различий в структуре ДНК (генов) у разных индивидуумов. Гомологичные гены, то есть те, что определяют формирование одного и того же признака, например, форму носа или цвет глаз, у разных людей могут находиться в разных аллельных состояниях. На молекулярном уровне аллельные варианты одного и того же гена отличаются небольшими изменениями в структуре их ДНК, конкретно, в последовательности нуклеотидов в полинуклеотидной цепи. Возможны замена единичных нуклеотидов, так называемые точковые замены, или локальные перестройки, именуемые делециями и инсерциями - соответственно утрата либо добавление небольших участков цепи. Столь незначительные различия в конечном итоге и определяют то, чем разные люди отличаются друг от друга: уникальное сочетание аллельных вариантов всех генов обеспечивает биологическую индивидуальность каждого человека.
Геном человека содержит десятки тысяч генов и состоит из более чем 3 млрд. нуклеотидных пар, при этом молекулы ДНК любых двух людей (неродственников) отличаются в среднем только одним нуклеотидом из каждых трехсот-четырехсот. Но даже такие отличия, как правило, носят характер случайных отклонений от некой доминирующей нормы. Теоретически это означает, что если у сотни человек проанализировать фрагмент ДНК длиной 300-400 нуклеотидов для одного и того же среднестатистического гена, то девяносто девять человек вполне могут оказаться неотличимыми друг от друга. Практическое значение для целей генетической индивидуализации личности (как предпосылки для ее идентификации) имеют отнюдь не любые гены, а только такие, у которых много аллельных форм.
На практике в качестве маркеров индивидуальности выступают мультиаллельные гипервариабельные гены (гипервариабельные генетические локусы). Индивидуализирующими характеристиками служат многочисленные структурные варианты таких локусов, которые в разных сочетаниях присутствуют в ДНК разных индивидуумов. Открытие в начале 1980-х годов феномена локального генетического гиперполиморфизма в лаборатории Р. Уайта в США и позже разработка А. Джеффрисом высокоэффективных молекулярных зондов типа минисателлитной ДНК предоставили новые, недостижимые ранее возможности для решения проблемы индивидуализации человека и установления кровнородственных связей.
Технологии молекулярно – генетической индивидуализации. В судебно-экспертной практике базовыми молекулярно-генетическими технологиями признаны: анализ полиморфизма (вариабельности) длины рестриктазных фрагментов ДНК, анализ полиморфизма длины амплифицированных фрагментов ДНК и анализ полиморфизма нуклеотидных последовательностей (сайт-полиморфизма) ДНК.
Анализ полиморфизма длины рестриктазных фрагментов ДНК. Большая часть вариаций в полинуклеотидной цепи геномной ДНК вызвана точковыми нуклеотидными заменами и некоторыми другими вариантами реорганизации нуклеотидных последовательностей - инверсиями, делециями и инсерциями. В результате в молекулах ДНК появляются новые или утрачиваются существовавшие ранее участки воздействия (сайты) особых ферментов - рестрикционных эндонуклеаз (рестриктаз), в которых они расщепляют полинуклеотидные цепи ДНК.
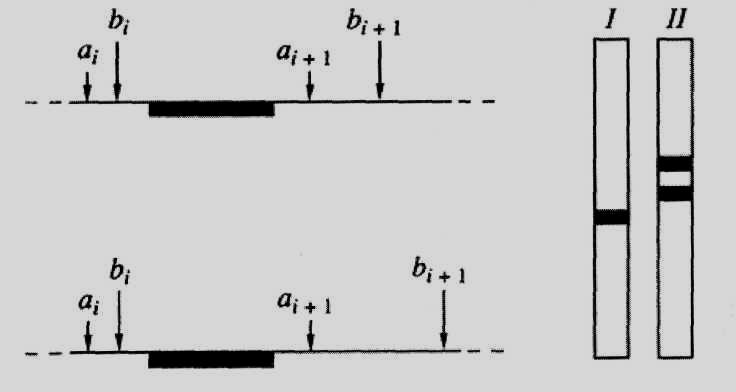
Рис.52. Схема блот-гибридизациии фрагментов ДНК
Слева - схема расположения на гомологичных хромосомах соседних участков узнавания (аі и ai+i; bi и bi+i) двух рестриктаз (I и II), зачерненный участок - область гомологии зонда; справа - схематическая картина результата блот-гибридизации с данным зондом суммарной ДНК, гидролизованной рестриктазами I и II, обусловливает изменение длины получающихся рестриктазных фрагментов ДНК.
Интересующие фрагменты ДНК можно визуализировать путем молекулярной гибридизации с соответствующим зондом; данный метод хорошо известен в молекулярной биологии нуклеиновых кислот как блот-гибридизационный анализ (рис. 52). С его помощью полиморфные участки генома обнаруживаются в виде имеющих разную длину гомологичных фрагментов ДНК, которые образуются после гидролиза геномной ДНК рестриктазами. Этот феномен получил название полиморфизма длины рестриктазных фрагментов (ПДРФ) ДНК.
Индивидуальный полиморфизм длины рестриктазных фрагментов создает предпосылки для решения задач, связанных с индивидуализацией организма и установлением его биологических родственных связей с другими индивидуумами. Однако большинство полиморфных геномных локусов - потенциальных генетических маркеров - имеет только два варианта: дикий тип/мутация, то есть являются диморфными или диаллельными. Ценность диморфных маркеров невелика, потому что у многих людей может оказаться один и тот же вариант такого гена. Поэтому, как уже указывалось, индивидуализирующее значение имеют не любые, а только гипервариабельные полиморфные фрагменты.
Поскольку гипервариабельные локусы мультиаллельны, то информативность маркерных систем на их основе намного выше, чем информативность систем (как правило, диаллельных), базирующихся на единичных нуклеотидных заменах. Теоретически можно предполагать, что высокая локальная генетическая вариабельность вызвана не столько точковыми нуклеотидными мутациями или микроделециями/инсерциями, сколько другими механизмами, приводящими к более существенной реорганизации геномных последовательностей: транспозициями, неравными или незаконными рекомбинациями, проскальзыванием репликативного комплекса и т.п. Как оказалось, такие локусы достаточно распространены в геноме человека.
Наиболее примечательны из них «минисателлитные» ДНК, впервые описанные Джеффрисом. Это относительно короткие (10-60 нуклеотидных пар), рассеянные по геному, повторяющиеся нуклеотидные последовательности, имеющие тандемную организацию и демонстрирующие разную степень внутригрупповой гомологии. Число тандемных повторов в минисателлитных блоках (и следовательно, длина самих блоков) варьирует в широких пределах - от трех-четырех до нескольких тысяч; такие блоки представляют разные аллельные варианты мультиаллельных генетических локусов.
В 1987 г. И. Накамура предложил называть такого рода генетические элементы локусами с варьирующимся числом тандемных повторов (рис.53), или просто тандемными повторами с переменным числом звеньев (общепринятая английская аббревиатура VNTR - Variable Number Tandem Repeat).
Вариации числа повторяющихся элементов в VNTR-блоках как раз и обусловливают структурный полиморфизм этих локусов, проявляющийся в форме ПДРФ. Дело в том, что длина соответствующих рестриктазных фрагментов, если отсутствуют участки расщепления внутри самих повторов, зависит от числа повторяющихся единиц.
Пожалуй, наиболее значимое свойство открытых Джеффрисом минисателлитов - их существование в виде семейств, диспергированных по геному. Все локусы каждого семейства содержат наборы тандемных олигонуклеотидных последовательностей, объединяемых одним нуклеотидным «мотивом», или кор-последовательностью. Таким образом, помимо мультиаллельности, то есть полиморфизма, обусловленного переменным числом повторяющихся элементов в самих локусах, минисателлитные маркеры
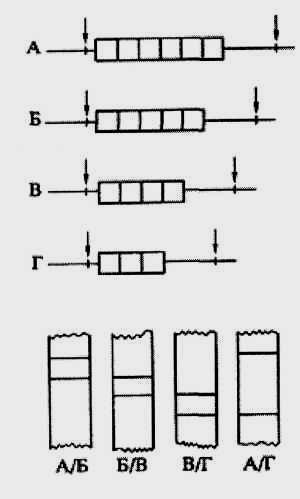
Рис.53. Последовательности ДНК с варьирующимся числом тандемных повторов: вверху - варианты таких локусов А, Б, В и Г различаются по ширине на один повторяющийся сегмент, сайты рестрикции - мечены стрелками; внизу - схематическая картина блот- гибридизации с молекулярным зондом, гомологичным идейному повтору, некоторых гетерозиготных по данному локусу ДНК.
характеризуются еще и «системным» полиморфизмом - возможностью одновременного выявления аллельных вариантов сразу нескольких (часто генетически не сцепленных между собой) локусов, представляющих одно семейство. В результате информативность таких гиперполиморфных мультилокусных систем оказывается предельно высокой, в принципе, достаточной для доказательной индивидуализации человека. В настоящее время неизвестно общее число семейств гипервариабельных локусов в геноме человека, но, по-видимому, оно достаточно велико; каждое из них потенциально представляет собой мультилокусную гипервариабельную систему с очень высоким индивидуализирующим потенциалом.
Анализ полиморфизма длины амплифицированных фрагментов ДНК. Не требующий использования рестрикционных ферментов и отличающийся чрезвычайно высокой чувствительностью, подобный анализ стал возможным в результате внедрения в практику метода так называемой энзиматической амплификации гипервариабельных генетических локусов с помощью полимеразной цепной реакции (ПЦР). Сейчас области применения этой реакции, как в фундаментальной науке, так и в биотехнологии столь разнообразны и многочисленны, что трудно их даже перечислить. Главный же смысл этого открытия в том, что удалось преодолеть все ограничения молекулярно-генетических методов исследования, которые были связаны с недостаточным для анализа количеством ДНК.
Полимерная цепная реакция позволяет выделить и размножить любую необходимую для анализа последовательность ДНК в количестве, превышающем исходное в десятки и даже сотни миллионов раз. Такая высокая степень направленного обогащения теоретически позволяет работать с единичными молекулами ДНК, следовательно, открывается возможность молекулярно-генетического типирования даже в случае исчезающе малых количеств доступного для экспертизы биологического материала. Действительно, еще в 1986 г. Джеффрис экспериментально доказал, что с помощью ПЦР реальной становится задача геномной идентификации на уровне нескольких или даже одной клетки. Кроме того, ПЦР весьма эффективна при анализе сильно разрушенных ДНК, подвергшихся высокой степени деградации.
Метод энзиматической амплификации ДНК положен в основу создания высокоспецифичных диагностических и индивидуализирующих тест-систем. Все они разрабатываются по единому принципу, который заключается в подборе праймеров на известной последовательности нуклеотидов ДНК (как правило, это олигонуклеотиды длиной 20-25 нуклеотидов, которые располагаются по флангам высокополиморфных мультиаллельных локусов) и оптимизации условий энзиматической амплификации выбранных генетических локусов.
Как мы уже знаем, гипервариабельные локусы VNTR-типа содержат различное число повторяющихся элементарных звеньев. При амплификации с праймерами, расположенными по краям такого локуса, образуются фрагменты ДНК различной длины, причем длина фрагмента будет пропорциональна числу повторов. Таким образом, в данной аналитической системе любой индивидуальный образец ДНК человека характеризуется наличием двух амплифицированных фрагментов разной или одинаковой длины (соответственно, гетерозиготное и гомозиготное состояние), поскольку каждая из двух гомологичных хромосом несет свой вариант гипервариабельного локуса, который может отличаться от других числом содержащихся в нем тандемных повторов. Этот феномен получил название полиморфизма длины амплифицированных фрагментов (ПДАФ) ДНК.
Молекулярные копии амплифицируемого локуса ДНК накапливаются в реакционной смеси, вследствие чего количественно оказываются доступными для сравнительного анализа. Далее полученные амплификационные продукты фракционируют с помощью электрофореза в геле агарозы или полиакриламида, фрагменты ДНК, амплифицированные в ходе реакции, выявляют, используя различные методы детекции. Собственно идентификационный анализ ПДАФ хромосомной ДНК в целом аналогичен монолокусному анализу ПДРФ: полиморфные по длине фрагменты, представляющие (как и в случае рестриктазных фрагментов в анализе ПДРФ) разные аллельные варианты гипервариабельных локусов, выступают в качестве индивидуализирующих личность признаков.
Анализ полиморфизма нуклеотидных последовательностей ДНК. Мы уже отмечали, что существенная часть вариаций в полинуклеотидных цепях геномной ДНК обусловлена точковыми нуклеотидными заменами: очень многие локусы, в том числе и высокополиморфные, имеют варианты (аллели), которые на молекулярном уровне одинаковы по длине, но в той или иной степени различаются последовательностью нуклеотидов. Это так называемый сайт-полиморфизм (от англ. «site» - участок), который условно можно обозначить ППАФ - полиморфизм последовательности амплифицированных фрагментов ДНК. Понятно, что амплификация локусов ДНК, обладающих свойством сайт-полиморфизма, приведет к образованию неразличимых по длине фрагментов. Дифференцировать такие фрагменты с помощью обычных методов электрофореза невозможно, поэтому в индивидуализирующих системах ППАФ-типа используются иные принципы дифференциации аллельных вариантов.
Наиболее радикальный путь - секвенирование амплифицированных фрагментов ДНК, то есть определение первичной структуры полинуклеотидной цепи. Теоретически это самый точный и доказательный метод анализа индивидуальных генетических вариаций, поскольку по своей сути секвенирование означает расшифровку генетического кода, который в принципе уникален для каждого организма. В настоящее время единственной молекулярно-генетической индивидуализирующей системой, основанной на секвенировании сайт-полиморфных амплифицированных фрагментов ДНК, являются полиморфные локусы митохондриальной ДНК (мтДНК).
Митохондриальная ДНК человека (см.1.4) представляет собой кольцевую молекулу, которая имеет размер 16 569 пар нуклеотидов и насчитывает всего 37 генов. Она характеризуется рядом уникальных биологических свойств: быстрым темпом мутирования и, как следствие, высоким уровнем изменчивости, большим числом копий в каждой клетке, материнским характером наследования и отсутствием рекомбинации. Эти свойства, ставшие причиной широкого использования мтДНК в популяционных и эволюционных исследованиях, делают ее высокоинформативным, а в некоторых случаях единственно применимым инструментом и в судебно-медицинской практике.
Можно использовать мтДНК как генетический маркер материнской линии наследования, и особенно успешно при установлении родства в тех случаях, когда генетическая дистанция, разделяющая родственников, больше, чем одно поколение. Здесь аутосомные маркеры не дают доказательного результата, поскольку практически невозможно проанализировать очень большое количество вариантов их наследования в ряду поколений. Нуклеотидная же последовательность мтДНК идентична у всех родственников, связанных материнской линией родства (за исключением редких мутационных событий). По этой причине для установления принадлежности индивида к конкретной генетической линии, а, следовательно, для его косвенной идентификации, можно использовать сравнительный анализ мтДНК любых родственников индивида по материнской линии (сестра, бабка, дядя, племянник и т.д.).
Анализ мтДНК возможен, если для экспертного исследования доступны крайне малые количества биологического материала или ДНК, содержащаяся в образце, сильно деградирована и хромосомная ДНК не может быть амплифицирована. Митохондриальная ДНК многократно использовалась для анализа костных останков, возраст которых исчисляется десятками, сотнями и даже десятками тысяч лет. Такие результаты недостижимы для индивидуализирующих систем, основанных на анализе однокопийных генов хромосомной ДНК.
Высокий уровень изменчивости мтДНК обеспечивает широкий спектр индивидуализирующих характеристик, а значит, и высокий дискриминирующий потенциал данного метода. Поскольку мтДНК не подвержена рекомбинации, она должна рассматриваться как единый локус. Количество вариантов последовательности контрольного региона мтДНК существенно превышает количество аллелей любого, даже самого полиморфного хромосомного маркера. Полиморфизм мтДНК столь высок, что иногда один лишь его анализ может обеспечить достаточно надежное подтверждение родства.
Вариации в полинуклеотидных цепях мтДНК обусловлены в основном точковыми нуклеотидными заменами - типичный полиморфизм последовательности ДНК. При типировании мтДНК в судебно-экспертных идентификационных исследованиях используются анализ полиморфизма длины рестриктазных и амплифицированных фрагментов (ПДРФ, ПДАФ), анализ полиморфизма нуклеотидных последовательностей (ППАФ, SSO, гибридизационные микроматрицы) и анализ конформационного полиморфизма (SSCP, DGGE). Тем не менее, следует отметить, что из них практическое значение имеет только индивидуализирующая система ППАФ-типа, в основе которой лежит секвенирование амплифицированных фрагментов ДНК, синтезированных на матрице мтДНК. Такой анализ, предусматривающий прямое секвенирование амплифицированного продукта, дает полную информацию о первичной структуре исследуемого фрагмента (рис.54).
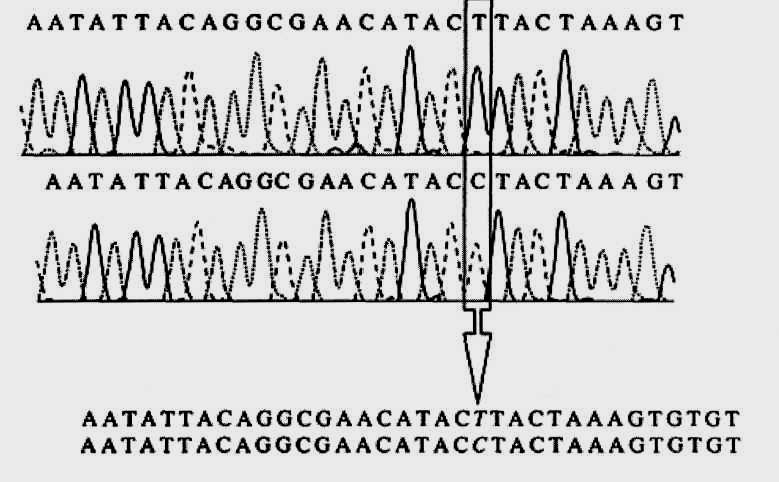
Рис.54. Выявление нуклеотидных замен в митохондриальной ДНК методом прямого флуоресцентного секвенирования
Мы уже говорили, что применительно к задачам судебно-медицинской экспертизы молекулярно-генетический идентификационный анализ наиболее эффективен в двух случаях: идентификация личности и установление биологического родства (в наиболее распространенном варианте - экспертиза спорного отцовства). Под идентификацией понимается, во-первых, задача экспертизы по конкретному уголовному или гражданскому делу, и во-вторых, собственно процесс и результат экспертизы, который заключается в установлении тождества исследуемых объектов (а в случае отрицательного результата - их дифференциации). Предпосылкой для идентификации объекта является его индивидуализация: процесс выявления и оценки признаков объекта, обладающих максимальной значимостью с точки зрения его неповторимости, то есть отличия от иных объектов. Отождествление или дифференциация осуществляются на основании сравнительного анализа совокупности индивидуализирующих признаков ДНК, выявленных в ходе идентификационного исследования.
Индивидуализирующие системы на основе анализа ПДАФ хромосомной ДНК. В настоящее время в мировой судебно-экспертной практике применяется несколько десятков молекулярно-генетических ПДАФ-систем на основе полиморфных локусов.
Наследование аллельных вариантов каждого полиморфного локуса происходит по ядерному типу, то есть примерно половина всех маркерных элементов, составляющих локальный геномный профиль каждого человека, ведет начало от его отца, а другая половина - от матери. Такой характер наследования обусловлен аутосомной локализацией гипервариабельных локусов: каждый аллельный вариант наследуется как простой менделевский кодоминантный признак.
Экспертиза спорного отцовства, по сути, также является идентификационным тестом. Однако в отличие от прямой судебно-медицинской идентификации личности отождествление здесь носит опосредованный характер. Если пользоваться криминалистической терминологией, признаки «образующего» объекта (в данном случае - родительского индивидуума), используемые с целью идентификации, отражаются в «воспринимающем» объекте - ребенке - не непосредственно, как в биологических следах, а преломляются через призму сложных генетических закономерностей. Знание и правильная оценка этих закономерностей необходимы для адекватной интерпретации результатов экспертного исследования.
Идентификационный тест, направленный на разрешение случаев оспариваемого отцовства, предполагает сравнительный анализ геномных профилей ребенка, матери и предполагаемого отца. При этом сначала регистрируют те полосы в геномном отпечатке ребенка, позиции которых совпадают с материнскими полосами, а оставшиеся полосы у ребенка сопоставляют с геномным профилем мужчины. Если исследуемое трио представляет собой истинную биологическую семью, все нематеринские полосы ребенка обнаружатся в геномном профиле отца. В противном же случае часть полос в локальных геномных профилях ребенка окажется «лишними», то есть не найдет соответствия в геномных профилях заявленных родителей. Этот стандартный алгоритм решения данной экспертной задачи базируется на закономерностях наследования гипервариабельных локусов. В частности, опираясь на менделевский кодоминантный характер наследования, можно считать, что все полосы, составляющие геномный профиль ребенка, должны иметь либо отцовское, либо материнское происхождение. Присутствие у ребенка посторонних фрагментов служит основанием для исключения заявленного отцовства (при условии, что материнство рассматривается как бесспорное). В свою очередь, полное комплементарное соответствие геномных профилей ребенка и заявленных родителей означает неисключение заявленного родства.
Индивидуализирующая система на основе анализа ПДАФ митохондриальной ДНК. Особая ценность данного методического подхода обусловлена тем обстоятельством, что в целом ряде случаев для экспертизы могут быть недоступны идентифицирующие объекты, которые позволили бы прямо установить индивидуализирующие признаки погибших на уровне их хромосомной ДНК. Остается возможность только непрямой идентификации, например, путем использования в качестве идентифицирующих объектов биологических образцов, полученных от родственников устанавливаемых лиц. Однако в этих условиях решение судебно-медицинской задачи идентификации с помощью стандартного молекулярно-генетического анализа хромосомных маркеров сталкивается с серьезными трудностями.
Проблема в том, что единственно возможная в таких обстоятельствах схема непрямой, то есть опосредованной через родственников, идентификации дает доказательный результат, если только в качестве индивидуализирующих элементов используется достаточно большое число полиморфных хромосомных локусов. Кроме того, часто приходится анализировать не близкородственную вертикальную схему «родители-дети», а более далекую, например, «дед/бабка-внук» или «дядя/тетка-племянник» либо же горизонтальные схемы типа «брат-сестра» (в отсутствие родителей). В этих случаях речь идет о достаточно отдаленном родстве и о более вариантных схемах наследования ядерных генов-признаков. Когда генетическая дистанция, разделяющая родственников по вертикали, превышает одно поколение, или анализируются горизонтальные схемы родства, верификация родственных связей с помощью анализа одной лишь хромосомной ДНК оказывается проблематичной.
Напротив, типирование митохондриальной ДНК, по существу, позволяет выявлять родственные связи с помощью не близкородственных, а так сказать, трассирующих родословных маркеров. Одним из первых и наиболее ярких примеров использования митохондриальной ДНК в экспертном исследовании стала идентификация останков членов российской императорской семьи. Данная экспертиза положила начало серии работ, основанных на анализе мтДНК и проливающих свет на исторические события прошлого.
Такова, например, экспертиза предполагаемых останков нацистского преступника Мартина Бормана. На протяжении многих лет была распространена легенда о том, что Борману удалось остаться в живых и после окончания войны покинуть Германию. В 1972 г. в ходе строительных работ были обнаружены костные останки, которые по ряду косвенных признаков могли принадлежать Борману. Для окончательного пресечения спекуляций было проведено исследование мтДНК костных останков, которое выявило полное совпадение с мтДНК ныне живущих матрилинейных родственников Бормана. Такое совпадение с большой вероятностью подтвердило принадлежность костных останков исторической фигуре.
К событиям более далекого прошлого относится экспертиза предполагаемых останков принца Луи XVII. Согласно официальной истории, 10-летний сын Луи XVI и Марии-Антуанетты умер в парижской тюрьме в 1795 г. Однако многочисленные слухи свидетельствовали о чудесном спасении принца. Обнаружились даже люди, объявившие себя спасенным Луи XVII. Одним из них был Карл Вильгельм Наундорф, похороненный в 1845 г. в Нидерландах как Луи XVII. Для выяснения исторической истины был проведен сравнительный анализ мтДНК останков Наундорфа и ныне живущих родственников Марии-Антуанетты и параллельно - анализ мтДНК сохранившегося сердца мальчика, скончавшегося в 1795 г. в парижской тюрьме. Исследование исключило родство Наундорфа с родственниками Марии-Антуанетты (а, следовательно, и его права наследника), поскольку выявило различия в их мтДНК, и установило совпадение нуклеотидных последовательностей мтДНК сердца и матрилинейных родственников Луи XVII, тем самым подтвердив официальную версию исторических событий.
