
- •Дніпродзержинський державний технічний університет
- •Конспект лекцій
- •«Аналітична хімія та інструментальні методи аналізу»
- •«Теоретичні основи аналітичної хімії. Якісний аналіз»
- •6.051401 „Біотехнологія»,
- •6.051301 “Хімічна технологія»
- •1.1 Вступ. Предмет, завдання, методи аналітичної хімії
- •1.2С основні етапи аналітичного визначення
- •1.3 Якісний аналіз
- •1.4С характеристика сірководневої і
- •1.5 Хімічна рівновага в гомогенних системах
- •1.6 Розчини електролітів у хімічному аналізі
- •1.7 Гетерогенна рівновага у системі розчин-осад
- •1.8 Кислотно-основна рівновага у розчині
- •1.9С буферні розчини. Гідроліз солей. Явище амфотерності
- •Підставляючи ці значення до рівняння для константи гідролізу,маємо:
- •1.10 Реакції окислення-відновлення
- •1.11С комплексні сполуки і колоїдні системи у хімічному аналізі
- •Література
- •51918 М. Дніпрдзержинськ,
Підставляючи ці значення до рівняння для константи гідролізу,маємо:
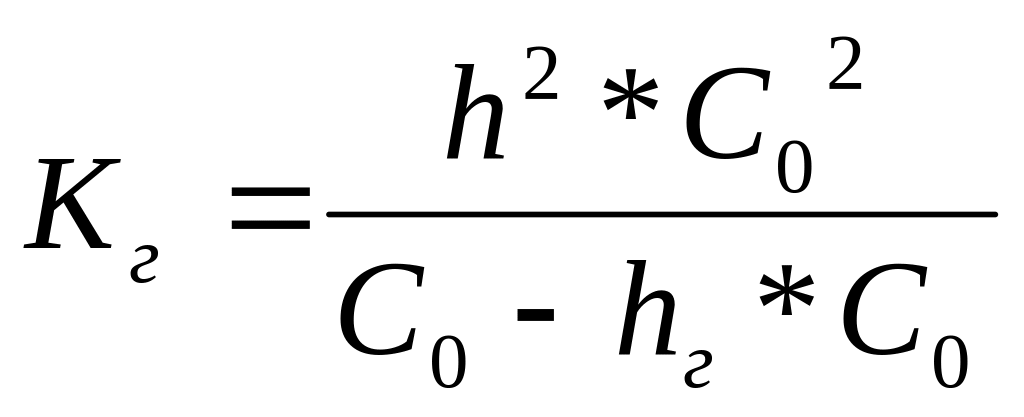
![]() =hг2*С0.
=hг2*С0.
Тому що hг <<1. Тоді:
hг
=![]() =
=
![]() .
.
Таким чином ступінь гідролізу тим більше, чим більше Kw, яке збільшується зі збільшенням температури, чим менше С0 (чим більше розведення),а також чим менша константа дисоціації,Кк ( чим слабше кислота тим більша ступінь гідролізу і тим більше середовище розчиненої солі відрізняється від нейтрального).
Розрахуємо концентрацію іонів гідрогену і рН розчину солі, що гідролізується:
![]() =
=![]() =
=![]()
![]()
![]()
Вирішив рівняння відносно [OH−], отримаємо:
![]() =
=![]() .
.
Підставив замість [OH−] її значення з рівняння іонного добутку води [OH−] = Kw/[H+], маємо:
![]() .
.
Звідки отримаємо рівняння для розрахунку рН у розчині такої солі:
рН = 7
+
![]() рКк
+
lgC0..
рКк
+
lgC0..
Сіль, утворена катіоном одно кислотної слабкої основи і аніоном одноосновної сильної кислоти.
Для розчинуNH4Cl:
Реакція дисоціації солі як сильного електроліту: NH4Cl NH4+ Cl-
Реакція дисоціації води як слабкого електроліту: H2O H+ + OH-.
Сумарна реакція: NH4Cl + H2O NH4OH + HCl.
Сумарна реакція у іонному вигляді: NH4+ + H2O NH4OH + H+.
Кажуть, що така сіль гідролізується по катіону. Внаслідок зв’язування у слабкий електроліт NH4ОН іонів гідроксилу зміщується рівновага процесу дисоціації води, в розчині накопичуються іони Н+, і середовище розчину набуває кислу реакцію (рН<7).
Константа рівноваги для цієї реакції має вигляд:
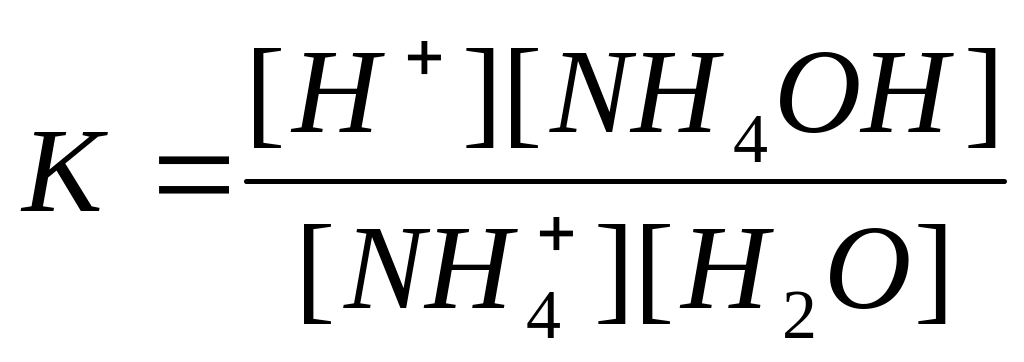 .
.
Аналогічно попереднему концентрація іонів гідрогену:
![]() ,
,
де С0 – концентрація солі, Косн – константа дисоціації основи.
рН у розчині такої солі розраховується за формулою:
рН = 7 - рКосн - lgC0.
Сіль, утворена катіоном одно кислотної слабкої основи і аніоном одноосновної слабкої кислоти. Така сіль гідролізується комбіновано і по катіону і по аніону. Наприклад для CH3COONH4:
Реакція дисоціації солі: CH3COONH4 CH3COO- + NH4+.
Реакція дисоціації води як слабкого електроліту: H2O H+ + OH-.
Сумарна реакція: CH3COONH4 + H2O CH3COOН + NH4ОН.
Концентрація іонів гідрогену розраховується за формулою:
![]() .
.
рН у розчині такої солі розраховується за формулою:
рН = 7 + рКк - рКосн.
В залежності від співвідношення констант дисоціації кислоти і основи середовище у розчині такої солі може бути нейтральним (Кк Косн), кислим (Кк>Косн) і лужним (Кк <Косн).
Сіль, утворена катіоном одно кислотної сильної основи і аніоном одноосновної сильної кислоти. Така сіль гідролізу не підкоряється (наприклад NaCl), оскільки не має взаємодії між компонентами розчину(не утворюються малодисоційовані чи малорозчинні сполуки), рН розчину нейтральне, а отже немає і гідролізу.
Гідроліз солей слабких багато основних кислот перебігає ступінчате:
І. K2CO3 + H2O KHCO3 + KOH, KI =4,5*10-7
ІІ. KHCO3 + H2O H2CO3 + KOH, KII=4,8*10-11
Гідроліз по першому ступеню перебігає більш ніж по другому.
Для кислих солей багато основних слабких кислот концентрація іонів гідрогену у розчині при гідролізі не залежить від концентрації солі, а визначається лише константами дисоціації кислоти за першим і другим ступенями. Наприклад для гідролізу KHCO3:
KHCO3 + H2O H2CO3 + KOH,
[H+]
=
![]() .
.
Гідроліз солей багато кислотних слабких основ також перебігає ступінчате:
FeCl3 + H2O Fe(OH)Cl2 + HCl,
Fe(OH)Cl2 + H2O Fe(OH)2Cl + HCl,
Fe(OH)2Cl + H2O Fe(OH)3 + HCl,
Солі, утворені катіонами багато кислотних слабких основ і аніонами багато основних слабких кислот. Такі солі підкоряються гідролізу і він перебігає повністю оскільки утворюються малорозчинні і газоподібні сполуки, які видаляються з зони реакції. Тому такі солі існують лише у твердому стані. Наприклад:
Al2S3 + 6H2O 2Al(OH)3 + 3H2S.
Крім природи сполуки на гідроліз можна впливати зміненням концентрації розчину; зміненням температури розчину; додаванням до розчину солі іншого гідролізуючого електроліту чи кислот або луг.
Таким чином під гідролізом розуміють взаємодію різноманітних сполук з іонами води, яка супроводжується порушенням рівноваги електролітичної дисоціації води зі зміненням рН розчину. Якщо такої взаємодії немає – не має і гідролізу.
Явище амфотерності. Рівноваги у розчинах амфотерних сполук. Використання явища амфотерності в аналітичній хімії.
До амфотерних відносять сполуки(амфоліти), які у розчинах поводять себе і як кислоти і як основи – гідроксиди деяких металів(Zn(OH)2, Cr(OH)3, Al(OH)3, Pb(OH)2, Sn(OH)2 та інші); аніони кислих солей (HCO-3, H2PO4- та інші). Якщо у розчині амфоліту присутній більш сильний донор протонів (кислота), то він веде себе як основа (акцептор протонів) і навпаки, в присутності більш сильного акцептора протонів (основи) амфоліт віддає свої протони поводячись як кислота.
Таким чином амфоліт у розчині може дисоціювати як кислота і як основа. Наприклад, для малорозчинного гідроксиду цинку, можливо представити рівноваги наступним чином:
Zn(OH)2 - осад
I
![]() II
II
2H+ + ZnO22- Zn(OH)2 Zn2+ + 2OH-
дисоціація по типу кислоти дисоціація по типу основи
Кожна з цих рівноваг характеризується своєю константою:
Kk
= K1
=
![]() ;
Ko
=
KII
=
;
Ko
=
KII
=
![]() .
.
Порівнюючи константи рівноваги можливо передбачити які властивості амфоліту більш виражені. Якщо Кк Ко то у амфоліту кислотні і основні властивості виражені приблизно однаково. Для Pb(OH)2 KPb(OH)2=9,6*10-4 >KH2PbO2 = 2*10-16 і більш виражені основні властивості. Для гідроксиду алюмінію KAl(OH)3=8*10-25 <KH3AlO3 = 4*10-13 більш виражені кислотні властивості.
Завдяки наявності таких рівноваг амфоліт у розчині кислоти реагує як основа:
Zn(OH)2 + 2 H+ Zn2+ + H2O,
а у розчині лугу – як кислота:
H2ZnO2 + 2OH- ZnO22- + H2O.
В обох випадках порушується рівновага, внаслідок чого цинк гідроксид буде розчинятися і в розчинах кислот і в розчинах луг.
Явище амфотерності широко використовується в аналітичній хімії для розділення катіонів. Наприклад, якщо аналізуєма суміш містить катіони Al3+ і Fe3+, то діючи лугом їх осаджують у вигляді гідроксидів, а додаючи надлишок лугу переводять амфотерний гідроксид алюмінію у розчин при цьому гідроксид феруму не розчиняється і залишається у осаду.
Контрольні питання до теми 1.9С
9.1.Які розчини звуться буферними?
9.2.Чим зумовлена дія буферної суміші при додаванні сильних кислот, основ, або розведенні?
9.3Що таке гідроліз солі?
9.4.Як гідролізується сіль, утворена катіоном сильної основи і аніоном сильної кислоти?
9.5Як гідролізується сіль, утворена катіоном слабкої основи і аніоном сильної кислоти?
9.6.Як гідролізується сіль, утворена катіоном сильної основи і аніоном слабкої кислоти?
9.7.Як гідролізується сіль, утворена катіоном слабкої основи і аніоном слабкої кислоти?
9.8.Які речовини відносять до амфолітів?
9.9.Як дисоціює амфоліт у розчині?
