
- •Дніпродзержинський державний технічний університет
- •Конспект лекцій
- •«Аналітична хімія та інструментальні методи аналізу»
- •«Теоретичні основи аналітичної хімії. Якісний аналіз»
- •6.051401 „Біотехнологія»,
- •6.051301 “Хімічна технологія»
- •1.1 Вступ. Предмет, завдання, методи аналітичної хімії
- •1.2С основні етапи аналітичного визначення
- •1.3 Якісний аналіз
- •1.4С характеристика сірководневої і
- •1.5 Хімічна рівновага в гомогенних системах
- •1.6 Розчини електролітів у хімічному аналізі
- •1.7 Гетерогенна рівновага у системі розчин-осад
- •1.8 Кислотно-основна рівновага у розчині
- •1.9С буферні розчини. Гідроліз солей. Явище амфотерності
- •Підставляючи ці значення до рівняння для константи гідролізу,маємо:
- •1.10 Реакції окислення-відновлення
- •1.11С комплексні сполуки і колоїдні системи у хімічному аналізі
- •Література
- •51918 М. Дніпрдзержинськ,
1.4С характеристика сірководневої і
КИСЛОТНО-ОСНОВНОЇ КЛАСИФІКАЦІЇ КАТІОНІВ
Сірководнева схема систематичного аналізу катіонів є класичною і найбільш методично розробленою(таблиця1.7).
Таблиця 1.7 - Класифікація катіонів за сірководневою схемою аналізу
№ групи |
Катіони |
Груповий реагент |
Характеристика групи |
1 |
K+, Na+, NH4+, (Mg2+) |
Немає |
Хлориди, сульфати, гідроксиди розчинені у воді |
II |
Ca2+, Ba2+, Sr2+
|
(NH4)2CO3 у присутності NH4OH + NH4Cl |
Карбонати не розчиняються у воді, лугах, розчині амоніаку. |
III |
Mn2+, Fe2+, Fe3+, Al3+, Zn2+, Cr3+, Co2+, Ni2+, |
(NH4)2S у присутності NH4OH + NH4Cl (PH = 9,25) |
Осади( гідроксиди Cr3, Al3+ сульфіди інших катіонів) розчиняються в кислотах |
IV |
Sb(III, V)Sn2+, Sn4+, Bi3+, Cu2+, Cd2+, Hg2+ |
H2S у присутності HCl (pH= 0,5) |
Сульфіди не розчиняються в кислотах |
V |
Ag+, Pb2+, Hg22+ |
HCl, розведена |
Хлориди нерозчинені у воді і розбавлених кислотах |
До першої
аналітичної групи
відносяться катіони K+,
Na+,
![]() ,
Mg2+.
Більшість солей катіонів першої
аналітичної групи добре розчинені у
воді. Розчини безбарвні. Групового
реагенту, що осаджує всі катіони першої
аналітичної групи, немає.
,
Mg2+.
Більшість солей катіонів першої
аналітичної групи добре розчинені у
воді. Розчини безбарвні. Групового
реагенту, що осаджує всі катіони першої
аналітичної групи, немає.
До другої аналітичної групи відносяться катіони Ca2+ i Ba2+. Водні розчини цих катіонів безбарвні. Малорозчинні у воді карбонати, сульфати, фосфати й оксалати. Добре розчинні у воді - хлориди, нітрати, гідрокарбонати, сульфіди кальцію і барію.
Як
груповий реагент застосовують карбонат
амонію (NH4)2CO3.
Осад
катіонів другої аналітичної групи
проводять у присутності. NH4OH
і![]() (pH
9,25) з розчину, нагрітого до 70-80 °С.
(pH
9,25) з розчину, нагрітого до 70-80 °С.
Гідроксид амонію NH4OH додають для уникнення гідролізу (NH4)2CO3:
![]()


![]()
У
присутності NH4OH
рівновага гідролізу зміщується у сторону
утворення іонів
![]() ,
це
необхідно тому, що карбонати кальцію і
барію нерозчинені у воді, а бікарбонати
- розчинені. Хлорид амонію
додають, щоб запобігти випадання в
осад катіона першої аналітичної групи
Mg2+
у виді (MgOH)2CO3
і Mg(OH)2
.
,
це
необхідно тому, що карбонати кальцію і
барію нерозчинені у воді, а бікарбонати
- розчинені. Хлорид амонію
додають, щоб запобігти випадання в
осад катіона першої аналітичної групи
Mg2+
у виді (MgOH)2CO3
і Mg(OH)2
.
Нагрівання розчину до 70-60 °C сприяє перетворенню аморфного осаду карбонатів CaCO3 і BaCO3 у кристалічний, а також зміщенню рівноваги реакції розкладання (NH4)2CO3 уліво:
![]()
![]()
До
третьої
аналітичної групи
катіонів відносяться
![]() ,
Fe3+,
Fe2+,
Zn2+,
Cr3+,
Mn2+,
Co2+,
Ni2+
та ін.
,
Fe3+,
Fe2+,
Zn2+,
Cr3+,
Mn2+,
Co2+,
Ni2+
та ін.
Більшість
сполук катіонів третьої аналітичної
групи малорозчинні у воді: сульфіди,
фосфати, гексацианоферрати, карбонати
й ін. Добре розчиняються у воді сульфати,
хлориди, нітрати, роданіди. Колір розчинів
солей:
і
Zn2+
–
безбарвний, Fe3+
–
жовтий, Fe2+
- блідо-зелений,
Mn2+
– блідо-рожевий, Cr3+
– зелений або фіолетовий, хромат
![]() – жовтий, біхромат
– жовтий, біхромат
![]() –
оранжовий, Со2+
- рожевий, Ni2+
– зелений.
–
оранжовий, Со2+
- рожевий, Ni2+
– зелений.
Від катіонів першої і другої аналітичних груп катіони цієї групи відрізняються нерозчинністю сульфідів у воді. Однак останні легко розчиняються в розведених кислотах, що відрізняє катіони третьої аналітичної групи від катіонів четвертої і п'ятої аналітичних груп.
Груповим реагентом на катіони третьої аналітичної групи є сульфід амонію (NH4)2S, який дає осад Fe3+, Fe2+, Mn2+, Zn2+, Ni2+ i Co2+ у вигляді сульфідів, а і Cr3+ – у виді гідроксидів. Сульфід амонію - сіль, утворена аніоном слабкої кислоти H2S і катіоном слабкої луги NH4OH. Сульфід амонію гідролізується у водному розчині практично цілком:
![]()
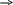
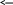
![]()
в іонному виді:
![]()
![]()
У наслідок гідролізу в розчині виявляється недостатньо іонів S2– для повного осадження катіонів третьої аналітичної групи. Для уникнення гідролізу в розчин додають гідроксид амонію. Уведення NH4OH сприяє також нейтралізації аналізованого розчину і запобіганню розчинення сульфідів і гідроксидів катіонів третьої аналітичної групи в кислому розчині.
Підвищення
рН розчину тільки за допомогою NH4OH
небажано,
тому що при рН > 9,3 осаджується катіон
першої аналітичної групи Mg2+
у виді гідроксиду, а амфотерні гідроксиди
алюмінію
і
хрому
переходять
у розчин у виді іонів
![]() і
і
![]() .
Якщо ж крім
NH4OH
до
аналізованого розчину додати достатню
кількість
,
то амонійною буферною сумішшю NH4OH
i
,
що утворилася, створюється рH 9,25. Постійне
значення рH сприяє повному осадженню
всіх катіонів третьої аналітичної
групи. Крім того,
грає роль електроліту-коагулятору, який
сприяє коагуляції колоїдних розчинів
сульфідів, особливо NiS. Для цієї ж мети
осадження проводять з нагрітого розчину.
.
Якщо ж крім
NH4OH
до
аналізованого розчину додати достатню
кількість
,
то амонійною буферною сумішшю NH4OH
i
,
що утворилася, створюється рH 9,25. Постійне
значення рH сприяє повному осадженню
всіх катіонів третьої аналітичної
групи. Крім того,
грає роль електроліту-коагулятору, який
сприяє коагуляції колоїдних розчинів
сульфідів, особливо NiS. Для цієї ж мети
осадження проводять з нагрітого розчину.
Таким чином, осадження катіонів третьої аналітичної групи проводять груповим реагентом (NH4)2S у присутності буферної суміші NH4OH i (рН»9) з розчину, нагрітого до 70-80°С.
До четвертої аналітичної групи відносяться катіони підгрупи купруму Cu2+, Cd2+, Bi3+ і підгрупи арсену As3+, As5+, Sb3+, Sb5+, Sn2+, Sn4+.
Груповим
реагентом на катіони четвертої аналітичної
групи є сірководень H2S
у кислому середовищі (рН 0,5). Практично
осадження ведуть пропускаючи газоподібний
сірководень через розчин катіонів,
підкислений попередньо краплею 2н
розчину
![]() .
.
До п'ятої
аналітичної групи
відносяться катіони Ag+,
Pb2+.
Груповим реагентом на катіони п'ятої
аналітичної групи є хлорводнева кислота
.
Іони Ag+
і Рb2+
утворюють з іонами
![]() малорозчинні
хлориди на відміну від катіонів четвертої
аналітичної групи, хлориди яких добре
розчинні у воді.
малорозчинні
хлориди на відміну від катіонів четвертої
аналітичної групи, хлориди яких добре
розчинні у воді.
Водні розчини солей катіонів четвертої і п'ятої аналітичних груп безбарвні, крім розчинів солей купруму, що мають блакитне фарбування. У водних розчинах солі піддаються значному гідролізу і дають кислу реакцію. Малорозчинні солі цих катіонів: сульфіди, фосфати, карбонати й ін.
Однак, внаслідок властивостей сірководню, сучасне застосування цієї схеми систематичного аналізу обмежено і більш використовується кислотно-лужна схема якісного аналізу катіонів(таблиця 1.8).
Таблиця 1.8 - Класифікація катіонів за кислотно-основною схемою аналізу
№ групи |
Катіони |
Груповий реагент |
Характеристика групи |
1
|
K+, Na+,NH4+,(Mg2+) |
Немає |
Хлориди, сульфати, гідроксиди розчинені у воді |
II |
Ag+, Pb2+, Hg22+ |
HCl, розведена |
Хлориди нерозчинені у воді і розбавлених кислотах |
III |
Ca2+, Ba2+, Sr2+
|
H2SO4, розведена
|
Сульфати нерозчинені у воді і розбавлених кислотах |
IV |
Al3+,
Cr3+,
Zn2+,
Sn2+,
Sn4+ |
NaOH, надлишок |
Гідроксиди розчинені в надлишку лугу |
V |
Bi3+, Mn2+, Fe2+, Fe3+, Sb(III, V) |
NH3, H2O2 |
Гідроксиди нерозчинені в надлишку амоніаку |
VI |
Co2+, Ni2+, Cu2+, Cd2+, Hg2+, (Mg2+) |
NH3 надлишок,
|
Гідроксиди розчинені в надлишку амоніаку, гідроксид магнію розчинений в розчинах солей амоніаку |
Перша група катіонів за цією схемою ідентична сірководневій класифікації.
До другої групи відносять катіони Ag+, Pb2+, Hg22+(5-а група за сірководневою класифікацією). Водні розчини їх солей безбарвні, але ці катіони утворюють забарвлені сполуки. У водних розчинах розчинні солі Pb2+, Hg22+ піддаються значному гідролізу і дають кислу реакцію. Малорозчинні солі катіонів Ag+, Pb2+, Hg22+: сульфіди, фосфати, карбонати й тощо, розчинні солі ці катіони утворюють з аніонами F-, NO3-, ClO4-.
Груповим реагентом на катіони Ag+, Pb2+, Hg22+ є хлоридна кислота .
Іони Ag+, Рb2+, Hg22+ утворюють з іонами малорозчинені хлориди, тобто їх можна виділити у вигляду осаду хлоридною кислотою з суміші катіонів всіх аналітичних груп. Умови реакції: розведена хлоридна кислота, стехіометрична кількість HCl, понижена температура.
До третьої групи відносяться катіони Ca2+, Ba2+ і Sr2+(2-а група за сірководневою класифікацією). Груповим реагентом за кислотно-лужною схемою аналізу на катіони Ca2+, Ba2+ і Sr2+ є розведена сульфатна кислота, яка утворює з ними малорозчинні у воді і в розведених кислотах білі кристалічні осади сульфатів(ДРBaSO4 = 1,1*10-10, ДРCaSO4 = 9,1*10-6). Всі осади дуже дрібні, але при осаджені з гарячих розчинів утворюються більш крупнозернисті осади. Осад CaSO4 утворюється лише з концентрованих розчинів. Осадження іону кальцію розведеною сульфатною кислотою неповне, тому осадження ведуть у присутності етилового спирту.
Четверту групу утворюють типові амфотерні елементи Алюміній, Цинк, Хром, Станум, Арсен. Груповим реактивом на катіони цієї групи є натрій гідроксид, або калій гідроксид, які утворюють з ними аморфні осади гідроксидів. Останні розчиняються в надлишку лугу з утворенням відповідних гідроксокомплексів. Для того, щоб можна було виявити катіони у розчині дрібним методом, додають гідроген пероксид Н2О2 для окисненя Cr3+ до CrО42-, [As(OH)4]- до [As(OH)6]-, [Sn(OH)4]2- до [Sn(OH)6]2-.
П’яту групу утворюють катіони Fe3+, Fe2+, Mn2+, Bi3+, Sb3+, Sb5+, для яких властиві змінні ступені окислення, реакції окислення-відновлення, забарвлення їх іонів і сполук, здатність утворювати координаційні сполуки. Гідроксиди цих катіонів не проявляють добре виражених амфотерних властивостей(не розчиняються в надлишку лугу), не утворюють розчинних координаційних сполук з амоніаком і за цими властивостями відрізняються від катіонів IV і VI аналітичних груп. Груповим реактивом на катіони п’ятої аналітичної групи є амоній гідроксид, який утворює з ними осади гідроксидів, які не розчиняються у воді. Гідроксиди Fe2+, Mn2+ розчиняються в амонійних солях і тому з водних розчинів їх солей осаджуються амоній гідроксидом не повністю. Щоб вилучити їх з розчину при відокремлені катіонів V аналітичної групи від катіонів VI групи катіони Fe2+, Mn2+ окислюють до Fe3+, Mn4+ відповідно. Для цього осадження катіонів V групи ведуть у присутності гідроген пероксиду Н2О2.
Для катіонів шостої групи Cu2+, Cd2+, Co2+, Ni2+, властиві реакції окислення-відновлення, забарвлення їх іонів і сполук, здатність утворювати координаційні сполуки. Гідроксиди катіонів VI групи проявляють слабо виражені амфотерні властивості, але переважають основні, утворюють розчинені координаційні сполуки з амоніаком і за цими властивостями відрізняються від катіонів IV і V аналітичних груп. Груповим реактивом на катіони четвертої аналітичної групи є надлишок амоній гідроксиду, який утворює з ними осади гідроксидів, які розчиняються у його надлишку. Характерними реакціями катіонів шостої аналітичної групи є здатність утворювати малорозчинні сполуки гідроксидів, карбонатів, гексаціанофератів(П), фосфатів, сульфідів, оксалатів, хроматів(за винятком нікол(П) катіону), тіоціонатів(за винятком кадмій(П) катіону).
Контрольні питання до теми 1.4С
4.1.Які катіони відносяться до першої групи за кислотно-основною класифікацією?
4.2.Які катіони відносяться до другої групи за кислотно-основною класифікацією?
4.3.Які катіони відносяться до третьої групи за кислотно-основною класифікацією?
4.4.Які катіони відносяться до четвертої групи за кислотно-основною класифікацією?
4.5.Які катіони відносяться до п’ятої групи за кислотно-основною класифікацією?
4.6Які катіони відносяться до шостої групи за кислотно-основною класифікацією?
4.7.Який реактив є груповим реагентом на катіони першої групи за кислотно-основною класифікацією?
4.8.Який реактив є груповим реагентом на катіони другої групи за кислотно-основною класифікацією?
4.9.Який реактив є груповим реагентом на катіони третьої групи за кислотно-основною класифікацією?
4.10.Який реактив є груповим реагентом на катіони четвертої групи за кислотно-основною класифікацією?
4.11.Який реактив є груповим реагентом на катіони п’ятої групи за кислотно-основною класифікацією?
4.12.Який реактив є груповим реагентом на катіони шостої групи за кислотно-основною класифікацією?
