
- •Дніпродзержинський державний технічний університет
- •Конспект лекцій
- •«Аналітична хімія та інструментальні методи аналізу»
- •«Теоретичні основи аналітичної хімії. Якісний аналіз»
- •6.051401 „Біотехнологія»,
- •6.051301 “Хімічна технологія»
- •1.1 Вступ. Предмет, завдання, методи аналітичної хімії
- •1.2С основні етапи аналітичного визначення
- •1.3 Якісний аналіз
- •1.4С характеристика сірководневої і
- •1.5 Хімічна рівновага в гомогенних системах
- •1.6 Розчини електролітів у хімічному аналізі
- •1.7 Гетерогенна рівновага у системі розчин-осад
- •1.8 Кислотно-основна рівновага у розчині
- •1.9С буферні розчини. Гідроліз солей. Явище амфотерності
- •Підставляючи ці значення до рівняння для константи гідролізу,маємо:
- •1.10 Реакції окислення-відновлення
- •1.11С комплексні сполуки і колоїдні системи у хімічному аналізі
- •Література
- •51918 М. Дніпрдзержинськ,
1.5 Хімічна рівновага в гомогенних системах
Хімічна рівновага в розчинах. Закон діючих мас в аналітичній хімії. Константа рівноваги. Принцип Ле-Шательє. Константи рівноваги ступеневих реакцій і реакцій з сумісними рівновагами. Константи рівноваги термодинамічні, концентраційні та умовні.
При рішенні питання щодо застосування тієї чи іншої реакції для аналітичних цілей, необхідно знати у яку сторону і як повно перебігає реакція. Відповідь на це питання можливо отримати застосувавши один з основних законів хімії сформульованого Гульдбергом і Вааге – закон діючих мас, який описує взаємний зв'язок між концентрацією взаємодіючих речовин і швидкістю хімічною реакції: швидкість хімічної реакції v прямо пропорційна діючим масам, тобто концентраціям речовин, що реагують. Для реакції:
aA
+ bB
![]() cC
+ dD,
cC
+ dD,
швидкість
прямої реакції
![]() при постійних температурі і тиску буде
пропорційна добутку концентрацій
реагуючих речовин С(моль/л)
у ступенях, які дорівнюють відповідним
стехіометричним коефіцієнтам:
при постійних температурі і тиску буде
пропорційна добутку концентрацій
реагуючих речовин С(моль/л)
у ступенях, які дорівнюють відповідним
стехіометричним коефіцієнтам:
![]() .
.
Коефіцієнт пропорційності k зветься константою швидкості реакції і залежить від природи реагуючих речовин і температури і не залежить від концентрації. Фізичний сенс константи швидкості – це швидкість хімічної реакції при концентраціях реагуючих речовин, які дорівнюють одиниці.
Абсолютно незворотних реакцій немає, тому поряд з прямою перебігає і зворотна реакція, швидкість якої:
![]()
![]() .
.
Швидкості
реакцій залежать від концентрації
реагуючих речовин, отже на початку
реакції швидкість
буде максимальна, а швидкість
![]() буде дорівнювати 0, і з часом
буде зменшуватись, а
збільшуватись. Нарешті наступає момент
коли швидкості зрівняються – настає
хімічна
рівновага (рисунок
1.1).
буде дорівнювати 0, і з часом
буде зменшуватись, а
збільшуватись. Нарешті наступає момент
коли швидкості зрівняються – настає
хімічна
рівновага (рисунок
1.1).
При рівновазі ні пряма ні зворотна реакції не припиняються, вони ідуть з однаковою швидкістю – скільки вихідних продуктів витрачається за прямою реакцією, стільки їх утворюється за зворотною реакцією. Таким чином хімічна рівновага носить рухомий, динамічний характер, хоча склад системи не змінюється – концентрації речовин становляться «рівноважними» отже:
=
;
![]() .
.
![]() .
.
При хімічній рівновазі при постійних температурі і тиску відношення добутку рівноважних концентрацій продуктів реакції к добутку рівноважних концентрацій вихідних речовин є величина стала яка зветься константою рівноваги реакції КС . При цьому рівноважні концентрації беруться у ступенях, що відповідають стехіометричним коефіцієнтам.
Константа рівноваги залежить від природи реагуючих речовин і температури і не залежить від концентрацій. Константа рівноваги, яка виражена через концентрації реагуючих речовин зветься концентраційною.
![]() - швидкість
- швидкість
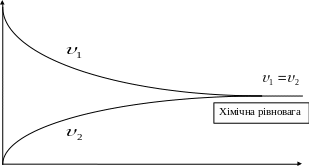
![]() - час
- час
Рисунок 1.1 - Залежність швидкостей прямої і зворотної реакцій від часу.
Для оборотної реакції рівновага, яка утворилася, може зберігатися як завгодно довго. Але зміна зовнішніх умов(Т, Р, С) спонукає зміщенню рівноваги у тому напрямку, який визначається принципом Ле-Шательє - якщо на систему, яка знаходиться у рівновазі, подіяти зовнішнім впливом, то рівновага зміститься у напрямку тієї реакції, яка протидіє цьому впливу. По відношенню до зміни концентрації це можна сформулювати таким чином: при збільшенні концентрації однієї з речовин рівновага зміщується у сторону тієї реакції, за котрою ця речовина витрачається. Якщо, наприклад, збільшити концентрацію вихідної речовини, то рівновага порушується, але через деякий час швидкості прямої і зворотної реакцій зрівняються і система перейде із одного рівноважного стану у друге. При цьому рівноважні концентрації будуть іншими(вихідних речовин зменшуються, а продуктів реакції збільшуються), але співвідношення між ними(константа рівноваги) залишиться незмінним.
Таким чином, збільшуючи концентрацію реактиву можливо досягнути більшу ступень перетворення компоненту, який визначається.
Як видно з рівняння для константи рівноваги, її чисельне значення характеризує напрямок і повноту перебігання реакції. Якщо КС > 1 реакція пряма; КС <1 реакція зворотна. Використовуючи надлишок реактиву можна змістити рівновагу реакції, у якій КС <1 у бік утворення продуктів реакції. Практично надлишок реактиву може вплинути на хід реакції, якщо КС > 1*10-4. В цьому випадку можливо, додаючи у 10000раз більше реактиву, змістити частково рівновагу у бік продукту реакції. Якщо КС <1*10-4 це зробити вже неможливо.
Таким чином: КС <1*10-4 - реакція неможлива; КС > 1*10-4 - реакція можлива при надлишку реактиву; КС > 1 - реакція пряма.
Чим більше константа рівноваги, тим більш повно перетворюються вихідні речовини. Можна розрахувати значення константи рівноваги, при якій реакція може бути використана для кількісних визначень. При взаємодії визначаємого компоненту А з реактивом Р за реакцією(у загальному вигляді):
А + Р АР,
досить, щоб ступень перетворення визначаємого компоненту складала 0,9999.
Тоді:
КС
=
![]() .
.
Для кількісних визначень можна застосовувати реакції, константа рівноваги яких більше ніж КС > 108. Такі реакції звуть практично необоротними.
Розглянемо реакцію:
H2S 2H+ + S2-.
Константа рівноваги:
КС=![]() .
.
Ця реакція ступенева, і складається з двох реакцій з відповідними константами рівноваги:
1.
H2S
H+
+ HS-;
КС1
=![]() =1,0*10-7,
=1,0*10-7,
2.
HS-
H+
+ S2-;
КС2=![]() =1,3*10-13.
=1,3*10-13.
Бачимо, що: КС = КС1* КС2= * = =1,3*10-20.
Таким чином, загальна константа рівноваги багато ступеневої реакції дорівнює добутку ступеневих констант рівноваги.
Якщо реакція складається з речовин, які у свою чергу, представляють теж рівноваги(реакція з сумісними рівновагами):
NH4OH + HCl NH4Cl + H2O,
то вона може бути представлена реакціями з відповідними рівновагами (враховуючи, що HCl і NH4Cl у розчині повністю дисоціюють):
1. NH4OH + HCl NH4+ + OН-, К1=КNH4OH;
2. H+
+ OН-,
H2O,
K2=![]() ;
;
КС = К1*К2 = К1* .
Також, загальна константа рівноваги реакції з сумісними рівновагами дорівнює добутку констант кожної рівноваги у ступенях, які рівні стехіометричним коефіцієнтам.
При розрахунках констант рівноваги треба враховувати, що в реальних системах на рівновагу впливають електростатичні і хімічні взаємодії.
Для врахування електростатичних взаємодій замість поняття концентрація [A] вводять поняття активність aA – це концентрація ідеального розчину, який мав би ті ж властивості, що і реальний розчин: aA=f*[A], де f – коефіцієнт активності. Тоді константа рівноваги, яка представлена через активності, зветься термодинамічною, або істиною і розраховується за формулою:
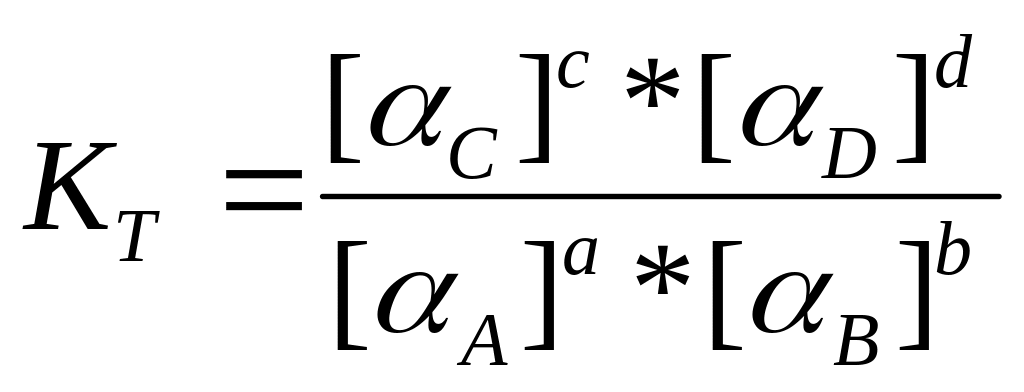 .
.
Компоненти
системи можуть брати участь одночасно
в декількох рівновагах. Тоді одну реакцію
вважають головною, а інші
побічними(конкуруючими). Концентрацію
окремої форми звуть рівноважною, а суму
концентрацій відповідних рівноважних
форм – загальною. Характеристикою
глибини перебігання конкуруючих реакції
вважають молярні долі
![]() :
[A]=
*СА,
де СА
– загальна концентрація усіх часток,
які містять компонент А. Якщо конкуруючих
реакцій нема, то [A]
= СА.
Якщо підставити у вираз для константи
рівноваги загальні концентрації,
отримаємо умовну константу рівноваги:
:
[A]=
*СА,
де СА
– загальна концентрація усіх часток,
які містять компонент А. Якщо конкуруючих
реакцій нема, то [A]
= СА.
Якщо підставити у вираз для константи
рівноваги загальні концентрації,
отримаємо умовну константу рівноваги:
Ку=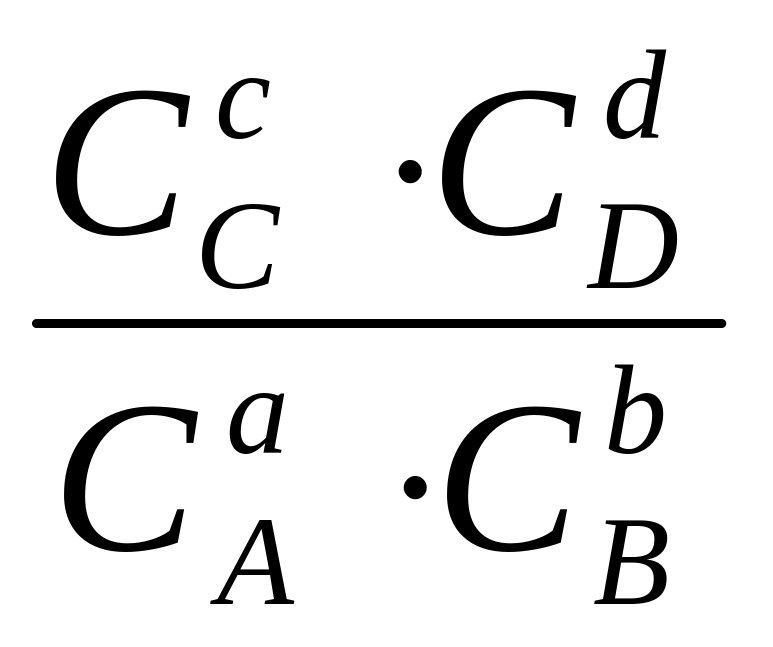 .
.
Таким чином маємо концентраційну реальну КС, термодинамічну КТ і умовну Ку константи рівноваги. Термодинамічна константа рівноваги залежить від найменшої кількості факторів і вона найчастіше наводиться у довідниках. Якщо можливо знехтувати електростатичними і хімічними взаємодіями, то КС=КТ= Ку. Зазначимо, що вплив електростатичних взаємодії значно менше ніж хімічних і ці взаємодії часто можна не враховувати.
Контрольні питання до теми 1.5
5.1.Сформулюйте закон діючих мас.
5.2 Від яких факторів залежить константа швидкості реакції?
5.3.У чому полягає принцип Ле-Шательє?
5.4.Що таке константа рівноваги? Від яких факторів вона залежить?
5.5.Які реакції звуться практично незворотними?
5.6.Яким чином константа рівноваги характеризує напрямок перебігання реакції?
5.7.Як розраховується константа рівноваги ступеневої реакції?
5.8. Як розраховується константа рівноваги реакції з сумісними рівновагами?
