
- •Вспомогательные материалы по теме. Исследование микроорганизмов в нативном состоянии.
- •Исследования микроорганизмов в окрашенном состоянии.
- •Окраска по методу Циля - Нельсена
- •Окраска спор
- •Окраска спор по методу Ожешко
- •Обнаружение капсул по методу Бурри
- •Техника приготовления некоторых полуфабрикатов и питательных сред общего назначения
- •Изучение изолированных колоний и отвивка чистых культур
Министерство здравоохранения Республики Беларусь
Гомельский государственный медицинский университет
Кафедра клинической лабораторной диагностики
Методы микробиологической диагностики клинического материала. Бактериоскопический, культуральный (бактериологический).
Учебно-методическое пособие для студентов
Автор: доцент кафедры, Ильинская Т.Н.
Гомель, 2005 год
Введение.
Микробиологические (бактериологические) исследования занимают важное место в общем комплексе клинико-лабораторных исследований, применяемых для профилактики, диагностики и лечения гнойно-воспалительных заболеваний и осложнений у больных в лечебно-профилактических учреждениях.
Цель: Получение знаний и практических навыков по вопросам выделения и идентификации возбудителей из патологического материала.
Задачи:
Знать методы микроскопического исследования микроорганизмов в нативном состоянии.
Знать методы микроскопического исследования микроорганизмов в окрашенном состоянии.
Знать этапы выделения возбудителей заболеваний.
Знать принципы биохимической дифференцировки выделенных микроорганизмов.
Практические навыки:
Освоение метода висячей капли.
Метод раздавленной капли.
Исследования в темном поле.
Фазово-контрастная микроскопия.
Окраска по Граму.
Окраска кислотоустойчивых микроорганизмов.
Посев патологического материала на питательные среды.
Питательные среды и реагенты для идентификации бактерий.
Классификация химических веществ, используемых в качестве тестов.
Пробирочный метод.
Метод биохимических пластин.
Ускоренные и упрощенные методы идентификации микроорганизмов.
Основные учебные вопросы:
Бактериоскопический метод. Определение формы, подвижности, внутренней структуры бактерий. Метод висячей капли. Фазово-контрастная микроскопия.
Исследования микроорганизмов в окрашенном состоянии. Способы фиксации препаратов. Окраска по Граму.
Окраска кислотоустойчивых микроорганизмов. Окраска спор.
Обнаружение капсул. Окраска по Романовскому-Гимзе.
Бактериологический метод. Виды клинического материала. Определение вида и объема клинического материала, необходимого для исследования. Сроки взятия материала. Способы взятия материала. Условия и способы транспортировки и хранения материала.
Питательные среды для культивирования бактерий. Классификация сред.
Сухие среды промышленного производства.
Выбор питательных сред для первичного посева. Способы первичного посева. Качественный посев. Количественный посев. Полуколичественный посев.
Способы культивирования бактерий.
Идентификация бактерий по биохимической активности.
Учет результатов биохимических тестов. Визуальный учет. Кодированный учет. Полуавтоматизированный учет. Автоматизированный учет.
Автоматизированные системы идентификации.
Основная литература:
Медицинская микробиология. Часть первая./ Под ред. А.М. Королюка и В.Б. Сбойчакова. –СПб., 1999. – 272с.
Медицинская микробиология./ Под ред. В.И. Покровского. –М.:ГЭОТАР МЕДИЦИНА, 1999.
Дополнительная литература:
Медицинская микробиология, иммунология и вирусология: Учебник для мед. вузов./ Под ред. А.И. Коротяева, С.А. Бабичева –СПб.: СпецЛит, 2000.
Приказ №535 то 22апреля 1985 года.
Вспомогательные материалы по теме. Исследование микроорганизмов в нативном состоянии.
В живом состоянии микроорганизмы исследуют с целью выявления их формы, подвижности или определения прижизненной внутренней структуры. Изучают нативные и окрашенные препараты, используя методы "раздавленной" или "висячей" капли.
Прижизненная (витальная) окраска. Взвесь микроорганизмов вносят в каплю 0,001% раствора метиленового синего или нейтрального красного. Затем готовят препарат "раздавленная" или "висячая" капля и микроскопируют его.
Приготовление препарата "раздавленная" капля. На центр обезжиренного предметного стекла наносят каплю жидкой бульонной культуры. Если культура выращивалась на плотной питательной среде, то на стекло наносят каплю стерильного изотонического раствора натрия хлорида, затем петлей прикасаются к культуре и приставшие к ней бактерии размешивают в приготовленной капле. Можно заранее приготовить взвесь микроорганизмов в изотоническом растворе и взять каплю из нее. На исследуемый материал накладывают покровное стекло так, чтобы не было пузырьков воздуха. Каплю надо брать такой величины, чтобы она заполняла все пространство между покровным и предметным стеклами и не выступала за края покровного. Препарат можно рассматривать как с сухими системами, так и с иммерсионной. Микроскопируют, используя объективы 40х или 90х. Очень хорошие результаты получают, применяя темнопольное или фазово-контрастное устройство. Препараты быстро высыхают, поэтому, если, их приходится рассматривать не тотчас, а спустя некоторое время, их помещают во влажную камеру (чашку Петри), на дно которой положено 2-3 влажных кружка фильтровальной бумаги, покрытых двумя сухими. Во избежание высыхания препарата и вызываемого конвекцией турбулентного движения жидкости подобные препараты можно герметизировать. Для этой цели следует пользоваться парафиновым маслом, смесью равных частей парафина и вазелина или лаком для ногтей.
В центре влажного препарата быстро возникает недостаточность кислорода. В сущности именно это помогло Пастеру открыть анаэробный обмен: наблюдая за препаратом, он заметил, что облигатные анаэробы сохраняли подвижность только в центре, но не по краям.
Подвижные микроорганизмы иногда могут адсорбироваться на стекле; в таких случаях подвижность легче наблюдать в "висячей" капле.
Приготовление препарата "висячая" капля. Препарат готовят на покровном стекле, в центр которого наносят одну каплю бактериальной взвеси. Затем предметное стекло с лункой, края которой предварительно смазывают вазелином, прижимают к покровному стеклу так, чтобы капля находилась в центре лунки, в результате чего стекла склеиваются. Быстрым движением переворачивают препарат покровным стеклом вверх. Получается герметически закрытая камера, в которой капля долго не высыхает. В правильно приготовленном препарате капля свободно висит над лункой, не касаясь ее дна или края. Микроскопируют со стороны покровного стекла, причем вначале следует найти край на малом увеличении и при суженной диафрагме, используя сухой объектив 8х, затем на большом и продолжить наблюдение (рис.3).
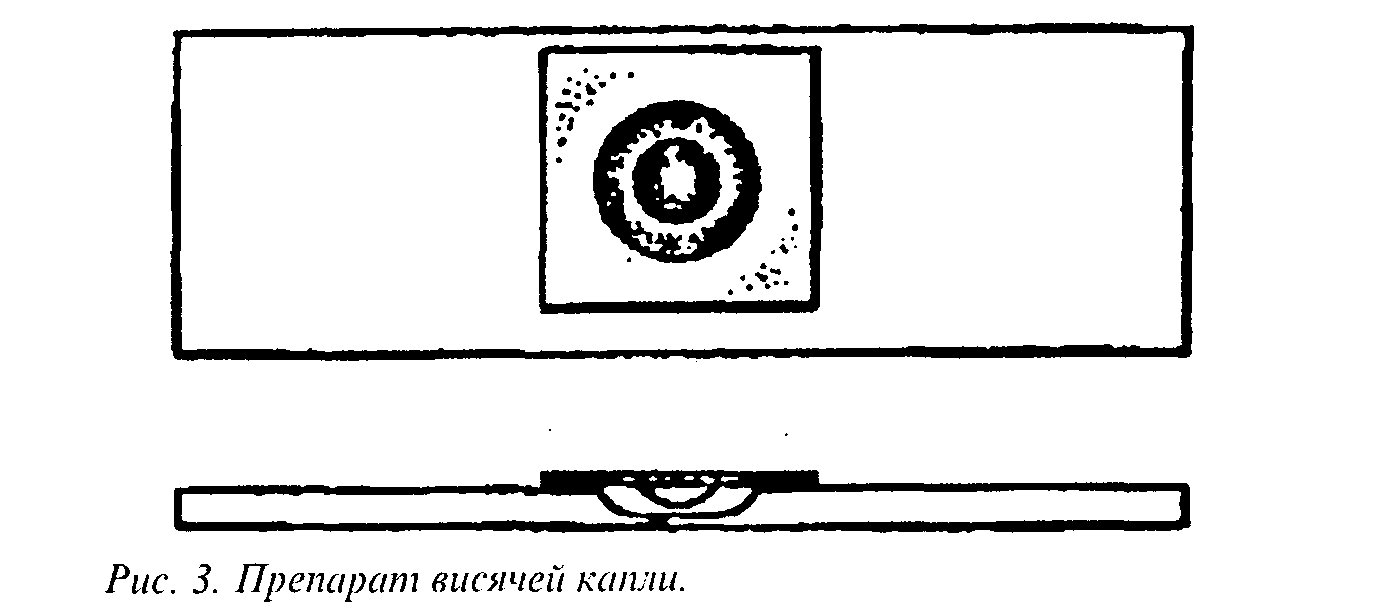
При изучении подвижности микроорганизмов необходимо отличать истинную подвижность от броуновского движения, которое является следствием ударов о бактерии движущихся в растворе молекул и выявляется в виде колебаний. Многие подвижные микроорганизмы движутся очень быстро, что затрудняет точное наблюдение. Добавляя к суспензии микроорганизмов метилцеллюлозу, можно уменьшить скорость их движения и создать условия, при которых движение жгутиков становится видимым.
Недостатком метода является наличие ряда оптических дефектов, связанных с кривизной лунки, что препятствует получению высококачественных мнкрофотографий, а также невозможность использования темнопольного и фазово-контрастного устройств из-за большой толщины предметных стекол с лунками.
