
- •Кафедра “Информационно-коммуникационные системы управления технологическими процессами”
- •5321700– Информационно-коммуникационные системы управления технологическими процессами
- •Бухара-2017
- •Введение
- •Лекция №1 основные понятия курса план:
- •Возникновение и развитие курса. Предмет курса и его задачи
- •Статика и кинетика процессов
- •Классификация процессов
- •4.Общая схема разработки и расчета аппаратуры
- •5.Материальный баланс процесса
- •6.Энергетический (тепловой) баланс
- •7.Определение основного размера аппарата
- •Основные определения и понятия
- •2. Некоторые физические свойства жидкостей
- •3. Основное уравнение гидростатики
- •Это есть основное уравнение гидростатики
- •Ключевые слова и выражения
- •Вопросы для самопроверки
- •Лекция №3 основы гидродинамики план:
- •Свойство жидкостей
- •Виды движения жидкостей
- •2.Уравнение сплошности (неразрывности) потока.Режимы движения жидкости
- •3.Моделирование процессов и аппаратов.
- •1. Устройство и принцип действия насосов
- •2.Сжатие и разрежение газов. Устройство и принцип действия компрессоров
- •3.Вентиляторы и вакуум-насосы.
- •Ключевые слова и выражения
- •Вопросы для самопроверки
- •Лекция №5 разделение неоднородных смесей план:
- •1.Разделение неоднородных систем
- •Материальный баланс процесса разделения
- •2.Осаждение в гравитационном поле (отстаивание)
- •4.Фильтрование.
- •Фильтровальная перегородка
- •5.Устройство и принцип действия фильтров. Фильтры периодического действия.
- •Ключевые слова и выражения
- •Вопросы для самопроверки
- •Лекция №6 центрифугирование. Перемешивание в жидких средах. План:
- •1. Центрифугирование. Устройство и принцип действия центрифуг
- •2. Перемешивание в жидких средах. Устройство и принцип действия механических мешалок.
- •Конструкции механических мешалок
- •Ключевые слова и выражения
- •Вопросы для самопроверки
- •Измельчение. Устройство и принцип действия дробилок и мельниц
- •1. Линейная степень измельчения
- •2. Объёмная степень измельчения
- •Методы измельчения.
- •Принцип работы щёковых дробилок
- •2. Машины раздавливающего действия применяются для среднего и мелкого дробления.
- •3. Машины для тонкого и сверхтонкого измельчения.
- •Классификация зернистых материалов
- •1.Общие сведения. Способы переноса тепла.
- •Передача тепла теплопроводностью
- •Передача тепла конвекцией
- •Основное уравнение теплопередачи
- •Лучистый теплообмен
- •Характеристики теплового излучения
- •2. Тепловой баланс.
- •Частные случаи.
- •Тепловой баланс
- •Ключевые слова и выражения
- •Вопросы для самопроверки:
- •Лекция №9 теплоносители. Теплообменники план:
- •Теплоносители
- •Нагревание водяным паром
- •Способы нагрева водяным паром
- •Нагревание топочными газами
- •Классификация теплообменников
- •Теплообменники. Их устройство и принцип действия. Кожухотрубчатые теплообменные аппараты
- •Основные способы увеличения интенсивности теплообмена
- •1.Выпаривание
- •Циркуляционной трубой
- •Материальный и тепловой баланс выпарного аппарата
- •Ключевые слова и выражения
- •Вопросы для самопроверки:
- •1. Общие сведения о массообменных процессах
- •Классификация массообменных процессов
- •Материальный баланс при массопередаче
- •2.Равновесие при массопередаче. Законы фика.
- •3. Массоотдача. Уравнение массопередачи.
- •1. Сушка. Способы сушки.
- •Равновесие в процессах сушки
- •2.Материальный и тепловой баланс сушильной установки. Материальный баланс сушки
- •Тепловой баланс конвективных сушилок
- •3.Устройство и принцип действия сушилок
- •1.Процесс абсорбции.
- •Физическая сущность процесса абсорбции
- •Равновесие при физической абсорбции
- •2.Материальный баланс абсорбера и расход абсорбента Материальный баланс абсорбции
- •Противоточного процесса
- •Абсорбента
- •3.Устройство и принцип действия абсорберов Промышленные схемы абсорбции
- •Линии двухступенчатой абсорбции Конструкции абсорберов
- •Насадочные аппараты
- •Гидравлического сопротивления насадки от скорости газа
- •Тарельчатые аппараты
- •Расчет абсорберов
- •Плотность орошения.
- •1.Адсорбция. Характеристики адсорбентов
- •Принципиальная схема адсорбции
- •Равновесие процесса адсорбции
- •Кинетика адсорбции
- •Классификация адсорберов
- •1 Цилиндрический корпус; 2 решетка; 3,4 штуцеры
- •Расчет адсорберов
- •1.Экстракция в системе “жидкость-жидкость”.
- •Принципиальная схема процесса
- •Выбор экстрагента
- •Равновесие в системе «жидкость жидкость»
- •Кинетика экстракции
- •Принципиальные схемы экстракции
- •Многократная (многоступенчатая) экстракция
- •Другие виды экстракции
- •Классификация экстракторов
- •Конструкции экстракторов
- •Способы повышения интенсивности процесса
- •2.Экстракция в системе “жидкость-твердое тело”. Устройство и принцип действия экстракторов. Экстракция в системах «твёрдое тело – жидкость»
- •Равновесие и скорость выщелачивания
- •Способы растворения и выщелачивания
- •Вакуум-фильтрах:
- •Устройство и принцип действия экстракторов.
- •Ключевые слова и выражения
- •Вопросы для самопроверки:
- •Лекция №16 перегонка и ректификация план:
- •1.Перегонка и ректификация
- •Физическая сущность процесса
- •Равновесие в системе «жидкость – пар»
- •Физическая сущность процесса
- •2.Аппаратура для ректификационной установки Описание схемы процесса непрерывной ректификации
- •Расчет ректификационной установки непрерывного действия для разделения бинарных смесей
- •Тепловой расчет колонны
- •3.Ректификационные колонны
- •Вопросы для самопроверки:
- •Лекция №17 кристаллизация. Мембранные процессы план:
- •1.Кристаллизация. Общие сведения.
- •Принципиальная схема кристаллизации
- •Равновесие процесса кристаллизации
- •«Пар жидкость твердое тело»
- •Материальный баланс кристаллизации
- •Тепловой баланс кристаллизации
- •Процесса кристаллизации
- •Кинетика процесса
- •Конструкции аппаратов
- •2.Мембранные процессы. Общие сведения
- •Физическая сущность процесса
- •Классификация мембран
- •Расчет мембранных процессов
- •Ключевые слова и выражения:
- •Вопросы для самопроверки:
- •Лекция №18 химические процессы план:
- •Химические процессы
- •Классификация химических процессов и реакторов.
- •Конструкция реакторов
- •Устройство и принцип действия реакторов.
- •Ключевые слова и выражения
- •Вопросы для самопроверки:
Выбор экстрагента
Оптимальным является экстрагент, обеспечивающий минимум капитальных и эксплуатационных затрат.
Требования, предъявляемые к экстрагенту:
– высокая селективность (избираемость);
– плотность, отличная от плотности первого растворителя В, (ρА ≠ ρВ);
– минимальная взаимная растворимость в растворителе исходного раствора;
– минимальная токсичность, низкая коррозионная активность, доступность, дешевизна, пожаро-, взрывобезопасность.
В качестве экстрагентов наиболее часто используют: органические кислоты, соли органических оснований, нейтральные растворители (спирт, вода). Если используют воду, то процесс называется выщелачиванием.
Равновесие в системе «жидкость жидкость»
Система состоит из двух фаз и трех компонентов. Согласно правилу фаз Гиббса (К+2=Ф+N)количество компонентов К=3, количество фаз Ф=2, следовательно число степеней свободы N=3.
При проведении процесса температура не изменяется, а изменение давления в подобной системе практически не оказывает влияния на ход процесса. Поэтому в ней можно изменять концентрацию одной из фаз без нарушения равновесия.
При этом
 ,
,
где у – концентрация компонентаА в растворителе С;х – концентрация компонента А в растворителе В.
То есть данной концентрации распределяемого вещества х в одной фазе в состоянии равновесия соответствует определенная концентрация у* вещества в другой фазе.
Равновесие
в системе определяется законом
распределения Нереста: При
Т=const
соотношение между концентрациями
компонентов в двух жидкостях при
равновесии постоянно:
 или для идеальных растворов:
или для идеальных растворов:
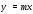 .
.
Вещество распределяется между двумя жидкостями в отношении m, не зависящем от его количества.
При полной взаимной нерастворимости участвующих в процессе фаз каждая из фаз будет представлять двухкомпонентный раствор. Тогда, откладывая равновесные составы по осям координат х-упри постоянных температуре и давлении, можно получить плоскую фазовую диаграмму, причем линия равновесия будет прямой, выходящей из начала координат.
На практике вышеуказанная равновесная зависимость не является прямой линией, поскольку вещества являются частично взаиморастворимыми. Такие системы называются реальными. Величина mопределяется для каждого конкретного случая опытным путем.
Для реальных растворов существуют два варианта:
– полная нерастворимостьВ и С; экстракт и рафинат – двойная система, и линия равновесия при постоянной температуре представляет собой кривую, которая называется изотермой экстракции (рис.15.2). Равновесная кривая называется биноидальной;
– фазыВ и Сограниченно растворимы, следовательно, появляется тройная система и линия равновесия представится на треугольной диаграмме (рис.15.3).

|
Рис. 15.2. Изотерма экстракции |
Рис. 15.3.Кривая равновесия на треугольной диаграмме |
Вершины равностороннего треугольника соответствуют чистым компонентам. Каждая точка на сторонах АВ, ВС и АС соответствует составу двухкомпонентных растворов. Каждая точка на площади внутри диаграммы соответствует составу трехкомпонентного раствора (тройной смеси). Содержание компонента в точке N определяется проведением прямых, параллельных противоположной стороне. Процессы смешения и расслаивания на диаграмме изображаются прямыми, соединяющими исходные и конечные растворы. Количество исходного раствора и экстрагента можем определить по диаграмме

