
- •Кафедра “Информационно-коммуникационные системы управления технологическими процессами”
- •5321700– Информационно-коммуникационные системы управления технологическими процессами
- •Бухара-2017
- •Введение
- •Лекция №1 основные понятия курса план:
- •Возникновение и развитие курса. Предмет курса и его задачи
- •Статика и кинетика процессов
- •Классификация процессов
- •4.Общая схема разработки и расчета аппаратуры
- •5.Материальный баланс процесса
- •6.Энергетический (тепловой) баланс
- •7.Определение основного размера аппарата
- •Основные определения и понятия
- •2. Некоторые физические свойства жидкостей
- •3. Основное уравнение гидростатики
- •Это есть основное уравнение гидростатики
- •Ключевые слова и выражения
- •Вопросы для самопроверки
- •Лекция №3 основы гидродинамики план:
- •Свойство жидкостей
- •Виды движения жидкостей
- •2.Уравнение сплошности (неразрывности) потока.Режимы движения жидкости
- •3.Моделирование процессов и аппаратов.
- •1. Устройство и принцип действия насосов
- •2.Сжатие и разрежение газов. Устройство и принцип действия компрессоров
- •3.Вентиляторы и вакуум-насосы.
- •Ключевые слова и выражения
- •Вопросы для самопроверки
- •Лекция №5 разделение неоднородных смесей план:
- •1.Разделение неоднородных систем
- •Материальный баланс процесса разделения
- •2.Осаждение в гравитационном поле (отстаивание)
- •4.Фильтрование.
- •Фильтровальная перегородка
- •5.Устройство и принцип действия фильтров. Фильтры периодического действия.
- •Ключевые слова и выражения
- •Вопросы для самопроверки
- •Лекция №6 центрифугирование. Перемешивание в жидких средах. План:
- •1. Центрифугирование. Устройство и принцип действия центрифуг
- •2. Перемешивание в жидких средах. Устройство и принцип действия механических мешалок.
- •Конструкции механических мешалок
- •Ключевые слова и выражения
- •Вопросы для самопроверки
- •Измельчение. Устройство и принцип действия дробилок и мельниц
- •1. Линейная степень измельчения
- •2. Объёмная степень измельчения
- •Методы измельчения.
- •Принцип работы щёковых дробилок
- •2. Машины раздавливающего действия применяются для среднего и мелкого дробления.
- •3. Машины для тонкого и сверхтонкого измельчения.
- •Классификация зернистых материалов
- •1.Общие сведения. Способы переноса тепла.
- •Передача тепла теплопроводностью
- •Передача тепла конвекцией
- •Основное уравнение теплопередачи
- •Лучистый теплообмен
- •Характеристики теплового излучения
- •2. Тепловой баланс.
- •Частные случаи.
- •Тепловой баланс
- •Ключевые слова и выражения
- •Вопросы для самопроверки:
- •Лекция №9 теплоносители. Теплообменники план:
- •Теплоносители
- •Нагревание водяным паром
- •Способы нагрева водяным паром
- •Нагревание топочными газами
- •Классификация теплообменников
- •Теплообменники. Их устройство и принцип действия. Кожухотрубчатые теплообменные аппараты
- •Основные способы увеличения интенсивности теплообмена
- •1.Выпаривание
- •Циркуляционной трубой
- •Материальный и тепловой баланс выпарного аппарата
- •Ключевые слова и выражения
- •Вопросы для самопроверки:
- •1. Общие сведения о массообменных процессах
- •Классификация массообменных процессов
- •Материальный баланс при массопередаче
- •2.Равновесие при массопередаче. Законы фика.
- •3. Массоотдача. Уравнение массопередачи.
- •1. Сушка. Способы сушки.
- •Равновесие в процессах сушки
- •2.Материальный и тепловой баланс сушильной установки. Материальный баланс сушки
- •Тепловой баланс конвективных сушилок
- •3.Устройство и принцип действия сушилок
- •1.Процесс абсорбции.
- •Физическая сущность процесса абсорбции
- •Равновесие при физической абсорбции
- •2.Материальный баланс абсорбера и расход абсорбента Материальный баланс абсорбции
- •Противоточного процесса
- •Абсорбента
- •3.Устройство и принцип действия абсорберов Промышленные схемы абсорбции
- •Линии двухступенчатой абсорбции Конструкции абсорберов
- •Насадочные аппараты
- •Гидравлического сопротивления насадки от скорости газа
- •Тарельчатые аппараты
- •Расчет абсорберов
- •Плотность орошения.
- •1.Адсорбция. Характеристики адсорбентов
- •Принципиальная схема адсорбции
- •Равновесие процесса адсорбции
- •Кинетика адсорбции
- •Классификация адсорберов
- •1 Цилиндрический корпус; 2 решетка; 3,4 штуцеры
- •Расчет адсорберов
- •1.Экстракция в системе “жидкость-жидкость”.
- •Принципиальная схема процесса
- •Выбор экстрагента
- •Равновесие в системе «жидкость жидкость»
- •Кинетика экстракции
- •Принципиальные схемы экстракции
- •Многократная (многоступенчатая) экстракция
- •Другие виды экстракции
- •Классификация экстракторов
- •Конструкции экстракторов
- •Способы повышения интенсивности процесса
- •2.Экстракция в системе “жидкость-твердое тело”. Устройство и принцип действия экстракторов. Экстракция в системах «твёрдое тело – жидкость»
- •Равновесие и скорость выщелачивания
- •Способы растворения и выщелачивания
- •Вакуум-фильтрах:
- •Устройство и принцип действия экстракторов.
- •Ключевые слова и выражения
- •Вопросы для самопроверки:
- •Лекция №16 перегонка и ректификация план:
- •1.Перегонка и ректификация
- •Физическая сущность процесса
- •Равновесие в системе «жидкость – пар»
- •Физическая сущность процесса
- •2.Аппаратура для ректификационной установки Описание схемы процесса непрерывной ректификации
- •Расчет ректификационной установки непрерывного действия для разделения бинарных смесей
- •Тепловой расчет колонны
- •3.Ректификационные колонны
- •Вопросы для самопроверки:
- •Лекция №17 кристаллизация. Мембранные процессы план:
- •1.Кристаллизация. Общие сведения.
- •Принципиальная схема кристаллизации
- •Равновесие процесса кристаллизации
- •«Пар жидкость твердое тело»
- •Материальный баланс кристаллизации
- •Тепловой баланс кристаллизации
- •Процесса кристаллизации
- •Кинетика процесса
- •Конструкции аппаратов
- •2.Мембранные процессы. Общие сведения
- •Физическая сущность процесса
- •Классификация мембран
- •Расчет мембранных процессов
- •Ключевые слова и выражения:
- •Вопросы для самопроверки:
- •Лекция №18 химические процессы план:
- •Химические процессы
- •Классификация химических процессов и реакторов.
- •Конструкция реакторов
- •Устройство и принцип действия реакторов.
- •Ключевые слова и выражения
- •Вопросы для самопроверки:
Материальный баланс кристаллизации
Материальный баланс кристаллизации по общим потокам может быть представлен в виде
 ,
(17.1)
,
(17.1)
где
 – расходы соотвественно исходного,
маточного растворов и полученных
кристаллов, кг/с;
– расходы соотвественно исходного,
маточного растворов и полученных
кристаллов, кг/с;
 – расход
выпаренной воды, кг/с.
– расход
выпаренной воды, кг/с.
Материальный баланс по абсолютно сухому веществу
 ,
(17.2)
,
(17.2)
где а– отношение молекулярных масс безводной соли и кристаллогидрата; а = 1, если процесс проходит без присоединения воды.
Из материального баланса можно определить массу удаляемого растворителя:
 ;
(17.3)
;
(17.3)
массу кристаллической фазы:
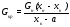 ;
(17.4)
;
(17.4)
массу кристаллической фазы без отгонки растворителя:
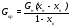 .
(17.5)
.
(17.5)
Тепловой баланс кристаллизации
Целью расчета теплового баланса является определение расхода пара для отгонки растворителя.
Рис.17.4.
К тепловому балансу
Процесса кристаллизации
Рассмотрим
кристалллизацию с отгонкой растворителя
– Wi
вт.п.
(рис.17.4).
В аппарат поступает исходный раствор Gн с характеристикой снtн, из которого образуется кристаллическая фаза Gкр, и в результате процесса остается маточный раствор Gк. Для отгонки растворителя подается пар – Dг.п.. При протекании процесса кристаллизации внутри аппарата выделяется некоторое количество теплоты Gкрqкр.
Тепловой баланс про-цесса кристаллизации:
 .
(17.6)
.
(17.6)
Кинетика процесса
Как уже говорилось выше, процесс кристаллизации протекает в две стадии: образование центров кристаллов и рост кристаллов.
Кристаллизация идет с достаточной скоростью лишь в пересыщенных растворах. В подобных растворах на начальном этапе образуются «зародыши» кристаллов.
Начало и скорость образования кристаллов зависит от степени пересыщения, природы растворенного вещества и растворителя, наличия нерастворимой твердой фазы, наличия электрического поля.
Причина появления «зародышей» – флуктуация концентраций, в результате которой образуются «дозародыши» кристаллов, представляющие собой скопления молекул или ионов растворенного вещества. При достижении некоторого критического размера «дозародышей» образуются зародыши кристаллов. Начиная с некоторого критического размера rкр в пределах от 0,5 до 5нм, начинается быстрый рост зародышей и образование большого числа полидисперсных кристаллов. Чем меньше критический размер кристалла, тем больше должна быть степень пересыщения раствора. Эта закономерность выражается следующим образом:
 (17.7)
(17.7)
где с – действительная концентрация раствора на момент начала кристаллизации, кг/м3;с* – равновесная концентрация (равновесная растворимость), кг/м3;σ – поверхностное натяжение, Н/м;М – молекулярная масса кристаллов;ρт – плотность кристаллов, кг/м3.
Отношение
 называется степенью пересыщения.
называется степенью пересыщения.
На стадии роста кристаллов происходит образование крупных кристаллов за счет массообмена с жидкой фазой.
Скорость обеих стадий можно повысить, увеличивая степень пересыщения, увеличивая температуру, используя интенсивное перемешивание, добавляя нерастворимые твердые частицы.
Рост самого кристалла протекает в две стадии:
-
диффузионная – подвод растворенного вещества к поверхности зародыша. Скорость этой стадии определяется по уравнению:
 ,
(17.8)
,
(17.8)
где G – масса кристаллической фазы, кг;βс– коэффициент массоотдачи в жидкой фазе;с – концентрация вещества в объеме раствора, кг/м3;сп– концентрация вещества у поверхности кристалла, кг/м3;
2) рост кристалла. Скорость этой стадии определяется:
 ,
(17.9)
,
(17.9)
где βт – коэффициент массоотдачи в твердой фазе;с* – концентрация насыщения, кг/м3.
Если скорость одной из стадий будет велика, следовательно, вторая стадия будет лимитировать процесс.
В случае соизмеримых скоростей процессов в сплошной и дисперсной фазах общая скорость процесса определится по уравнению массопередачи:
 ,
(17.10)
,
(17.10)
где
 – коэффициент
массопередачи при кристаллизации.
– коэффициент
массопередачи при кристаллизации.
