
- •Физика нефтяного и газового пласта
- •Типы пород–коллекторов
- •Залегание нефти, газа и воды
- •1.3. Гранулометрический состав горных пород
- •1.4.1. Виды пористости
- •1.4.2. Структура порового пространства
- •.5. Проницаемость
- •1.5.2. Радиальная фильтрация нефти и газа в пористой среде
- •1.5.3. Классификация проницаемых пород
- •1.5.4. Оценка проницаемости пласта, состоящего из нескольких продуктивных пропластков различной проницаемости
- •1.5.5. Зависимость проницаемости от пористости
- •1.6. Насыщенность коллекторов
- •1.7. Зависимости проницаемости от насыщенности коллекторов
- •1.8. Удельная поверхность
- •1.10. Карбонатность горных пород
- •1.11. Набухаемость пластовых глин
- •1.12. Механические свойства горных пород
- •1.13. Тепловые свойства горных пород
- •2.1. Состав природных газов
- •2.2. Способы выражения состава
- •2.3. Аддитивный подход расчета физико-химических свойств углеводородных газов
- •2.5. Состояние реальных газов
- •Критические давления, температуры и коэффициенты сверхсжимаемости компонентов нефтяных газов
- •2.7. Растворимость газов в нефти и воде
- •3.2. Физико–химические свойства нефти
- •3.2.1. Плотность нефти
- •3.2.3. Реологические свойства нефтий
- •3.2.5. Давление насыщения нефти газом
- •3.2.6. Сжимаемость нефти
- •3.2.7. Объёмный коэффициент нефти
- •3.2.9. Электрические свойства нефтей
- •3.3. Различие свойств нефти в пределах нефтеносной залежи
- •4. Фазовые состояния углеводородных систем
- •4.1. Схема фазовых превращений однокомпонентных систем
- •4.2. Фазовые состояния углеводородных смесей
- •4.3. Фазовые переходы в нефти, воде и газе
- •5.1. Химические свойства пластовых вод
- •5.1.1. Минерализация пластовой воды
- •5.1.2. Тип пластовой воды
- •5.1.3. Жесткость пластовых вод
- •5.1.4. Показатель концентрации водородных ионов
- •Величины ионного произведения воды при различных температурах
- •5.2.1. Плотность
- •5.2.2. Вязкость
- •5.2.3. Сжимаемость
- •5.2.4. Объёмный коэффициент
- •5.2.5. Тепловые свойства
- •5.2.6. Электропроводность
- •5.3. Характеристика переходных зон
- •6. Поверхностно–молекулярные свойства системы пласт–вода–нефть–газ
- •6.1. Роль поверхностных явлений в фильтрации
- •6.2. Поверхностное натяжение
- •6.4. Работа адгезии и когезии, теплота смачивания
- •6.5. Кинетический гистерезис смачивания
2.5. Состояние реальных газов
При повышенных давлениях для реальных газов характерно межмолекулярное взаимодействие, молекулы газов начинают притягиваться друг к другу, за счет физического взаимодействия.
Для учёта этого взаимодействия уравнение 2.17 на протяжении многих лет модифицировалось (голландским физиком Ван–дер–Ваальсом и др.). Однако на практике используется уравнение Менделеева–Клапейрона для реальных газов, содержащее коэффициент сверхсжимаемости z, предложенный Д. Брауном и Д. Катцом и учитывающий отклонения поведения реального газа от идеального состояния:
![]() ,
(2.26)
,
(2.26)
где Q – количество вещества, моль;
z – коэффициент сверхсжимаемости газа (см. 2.8).
Физический смысл коэффициента сверхсжимаемости заключается в расширении граничных условий уравнения Менделеева–Клапейрона для высоких давлений.
Коэффициент z зависит от давления и температуры (приведенных, критических давлений и температур), природы газа:
z = f (Тприв, Рприв), (2.27)
где Тприв – приведенная температура;
Рприв – приведенное давление.
Приведёнными параметрами индивидуальных компонентов называются безразмерные величины, показывающие, во сколько раз действительные параметры состояния газа (температура, давление, объём, плотность и др.) больше или меньше критических.
Тприв.. = Тпл. / Тср. кр; Р прив. = Рпл. / Рср. кр; Vприв. = Vпл. / Vср. кр. (2.28)
А для смесей газов они характеризуются отношением действующих параметров (температура, давление и др.) к среднекритическим параметрам смеси:
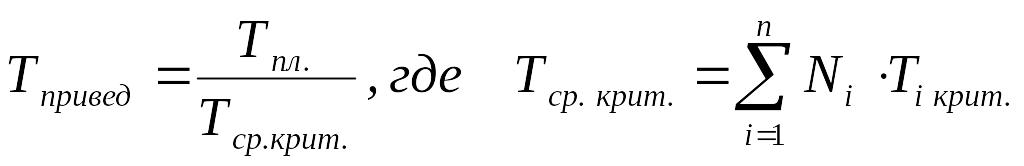 (2.29)
(2.29)
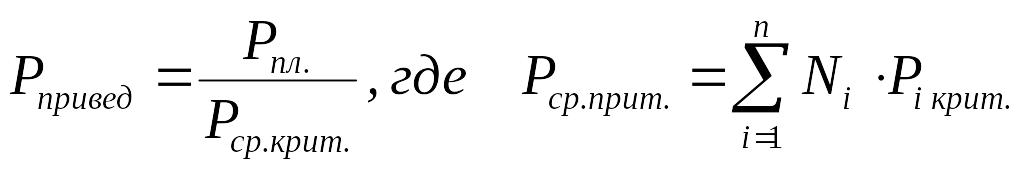 (2.30)
(2.30)
Критическая температура – температура, при которой жидкий углеводород переходит в газообразное состояние (табл. 2.4.).
Критическое давление – давление, при котором газообразный углеводород переходит в жидкое состояние (табл. 2.4).
Таблица 2.4
Критические давления, температуры и коэффициенты сверхсжимаемости компонентов нефтяных газов
№ п./п. |
Компонент |
ТКРi, оК |
РКРi, 0,1 МПа |
zКРi |
1. |
Метан, СН4 |
190,7 |
45,8 |
0,290 |
2 |
Этан, С2Н6 |
306,0 |
48,5 |
0,285 |
3 |
Пропан, С3Н8 |
369,8 |
43,4 |
0,277 |
4 |
Изо-бутан, i-С4Н10 |
407,2 |
37,2 |
0,283 |
5 |
н-Бутан, n-С4Н10 |
425,2 |
35,7 |
0,274 |
6 |
Изо-пентан, i-С5Н12 |
461,0 |
32,8 |
0,268 |
7 |
н-Пентан, n-С5Н12 |
470,0 |
33,0 |
0,269 |
8 |
Гексан, С6Н14 |
508,0 |
29,6 |
0,264 |
9 |
Гептан, С7Н16 |
540,3 |
27,0 |
0,259 |
10 |
Азот, N2 |
126,1 |
34,6 |
0,291 |
11 |
Двуокись углерода, СО2 |
304,2 |
74,96 |
0,274 |
12 |
Сероводород, Н2S |
373,6 |
88,9 |
0,268 |
Существуют графики (рис. 2.1), эмпирические формулы и зависимости для оценки коэффициента сверхсжимаемости от приведенных давлений и приведенных температур.
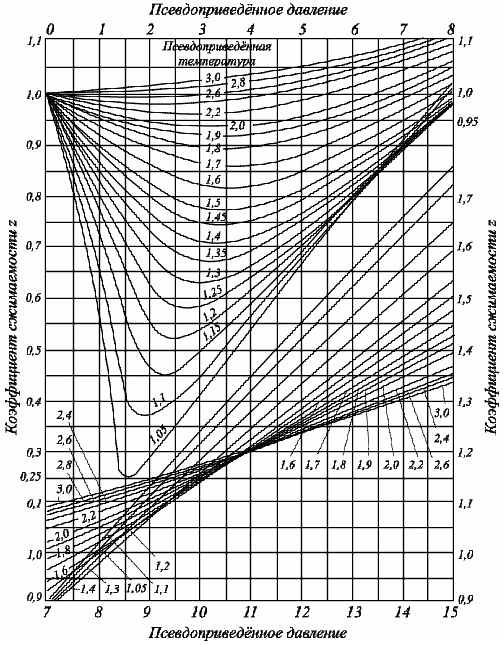
Рис. 2.1 Коэффициенты сжимаемости z углеводородных газов, в зависимости от приведённых параметров
При содержании неуглеводородных компонентов в составе нефтяных газов (N2, СО2, Н2S) следует вводить поправки в рассчитанное значение коэффициента сверхсжимаемости по правилу аддитивности:
z = NN2· z N2 + (1- NN2) · zув, (2.31)
где NN2 – молярная доля азота в смеси газов;
zN2, zув – коэффициенты сверхсжимаемости азота и углеводородной части смеси газов.
Для определения величин zN2 используются специальные графики (рис. 2.2).
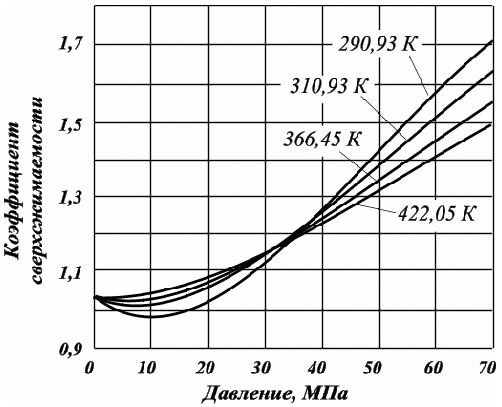
Рис. 2.2. Зависимость коэффициента сжимаемости азота от давления и температуры
Зная коэффициент сверхсжимаемости (z) и объём, занимаемый газом при нормальных условиях, можно оценить его объём при пластовых условиях по закону Бойля–Мариотта:
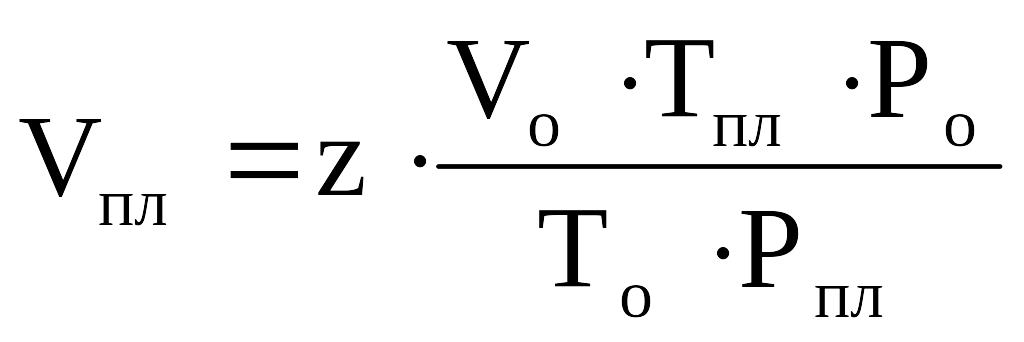 .
(2.32)
.
(2.32)
Отношение объёма газа при пластовых условиях (Vпл.) к объёму газа при нормальных условиях (Vo) называется объёмным коэффициентом (b) газа:
 .
(2.33)
.
(2.33)
Объёмный коэффициент газа используется при пересчёте объёма, занимаемого газом при нормальных условиях на пластовые условия и наоборот, например, при подсчёте запасов.
Рассмотрим пример. Дан мольный состав (Ni) газа:
Дано: Ni, доли Pкр, атм Ткр, К Ni Piкр, атм Ni Tiкр, К
СН4 0,8319 47,32 191 39,2 158,0
С2H6 0,0846 49,78 305 4,2 25,8
C3H8 0,0437 43,38 370 1,9 16,2
-C4H10 0,0076 38,25 407 0,3 3,1
n-C4H10 0,0168 38,74 425 0,6 7,1
i-C5H12 0,0057 33,89 461 0,2 2,6
n-C5H12 0,0032 34,10 470 0,1 1,5
C6H12 0,0063 30,52 508 0,2 3,2
Определить какой объём будет занимать 1000 м3 газа (при н. у.) для пластовых условий: Р = 100 атм, Т = 50°С?
Решение. Используя данные таблицы, мы можем найти коэффициенты сжимаемости (z) и объёмный коэффициент газа (b) для пластовых условий.
Рассчитаем приведенное температуру (2.27) и давление (2.28) для нашего состава и пластовых условий:
Tпр = (50 + 273,15) / (Ni Tiкр) = 323,15 / (0,8319 · 91 + 0,0846 · 305 + 0,0437 · 370 + 0,0076 · 407 + 0,0168 · 425 + 0,0057 · 461 + 0,0032 · 470 + 0,0032 · 470) = 323,15 / (158 + 25,8 + 16,2 + 3,1 + 7,1 + 2,6 + 1,5 + 3,2) = 323,15 / 217,5 = 1,48.
Рпр = 100 / (NiPiкр) = 100 / (0,8319 · 47,32 + 0,0846 · 49,78 + 0,0437 · 43,38 + 0,0076 · 38,25 + 0,0168 ·38,74 + 0,0057 · 33,8 + 0,0032 · 34,1 + 0,0063 · 30,52) = 100 / (39,2 + 4,2 + 1,9 + 0,3 + 0,6 + 0,2 + 0,1 + 0,2) = 100 / 46,7 = 2,14.
По графикам (рис. 2.1) находим значение z, как функцию z = f(Тпр. =1,48) и f(Pприв=2.14) при определяем z. Для нашего случая величина z = 0,81.
Объём газа в пластовых условиях определяем, используя закон Бойля–Мариотта:
Vпл = zVo(273,15 + t°) Po / (273,15Pпл),
Vпл = 0,811000323,151 / (273,15100) = 9,58.
Объёмный коэффициент газа оценивается отношением объёмов газа в пластовых условиях к объёму газа при н.у.:
b = Vпл/Vo = z(273,15 + t°)Po / (273,15Pпл),
b = 9,58 / 1000 = 0,81323,151 / (273,15100) = 0,00958.
Лекция 10. 2.6. Вязкость газов
Вязкость газа характеризует способность газа оказывать сопротивление перемещению одной части газа относительно другой.
Различают динамическую вязкость () и кинематическую вязкость () газов. Кинематическая вязкость учитывает влияние силы тяжести. Вязкость углеводородного газа при нормальных условиях невелика и не превышает 0,01 сантипуаза (спз) ≈ 10 мкПа·с.
1 пуаз = 0,1 н·сек/м2 = 0,1 Па·с; 1 спз = 1 мПа·сек. = 1·103 мкПа·с.
Неуглеводородные
компоненты природного газа: гелий, азот,
углекислый газ, сероводород, воздух -
более вязкие составляющие. Величина
вязкости для них изменяется от 0,01 до
0,025 спз. При низких давлениях и температурах
динамическая вязкость газа зависит от
средней длины пробега молекул газа (![]() ),
от средней скорости движения молекул
(
),
от средней скорости движения молекул
(![]() )
компонентов газа и от плотности газа:
)
компонентов газа и от плотности газа:
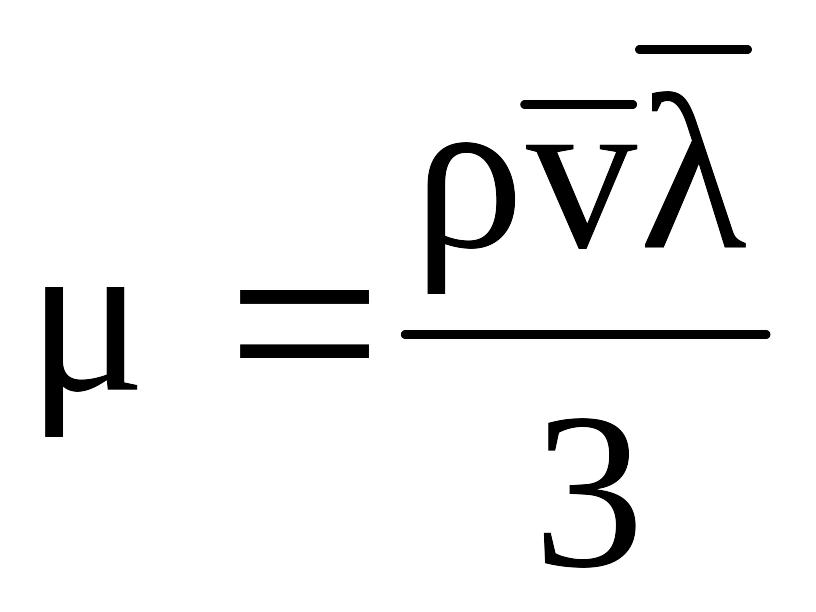 ,
(2.34)
,
(2.34)
где – плотность газа;
– средняя длина пробега молекулы;
– средняя скорость молекул.
С возрастанием температуры средняя длина свободного пробега молекулы и средняя скорость движения молекулы увеличиваются, а, следовательно, и вязкость газа возрастает, несмотря на уменьшение плотности (рис. 2.3).
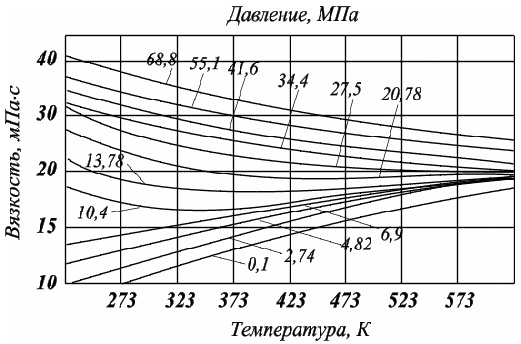
Рис. 2.3. Зависимость коэффициента динамической вязкости нефтяного газа плотности 0,6 от температуры при различных давлениях

Рис. 2.4. Зависимость вязкости газов от давления при различных температурах
Повышение давления от 0,1 до 1 МПа (рис. 2.4) не влияет на величину вязкости газа, поскольку уменьшение средней длины пробега молекулы и средней скорости движения молекулы компенсируется увеличением плотности. Однако эти закономерности при давлениях выше 3,0 МПа (более 30 атм) изменяются. Газ приближается к области критических давлений и температур и переходит в жидкое состояние. Вязкость жидких систем описывается законом Ньютона и для нее характерны свои закономерности.
