
- •Физика нефтяного и газового пласта
- •Типы пород–коллекторов
- •Залегание нефти, газа и воды
- •1.3. Гранулометрический состав горных пород
- •1.4.1. Виды пористости
- •1.4.2. Структура порового пространства
- •.5. Проницаемость
- •1.5.2. Радиальная фильтрация нефти и газа в пористой среде
- •1.5.3. Классификация проницаемых пород
- •1.5.4. Оценка проницаемости пласта, состоящего из нескольких продуктивных пропластков различной проницаемости
- •1.5.5. Зависимость проницаемости от пористости
- •1.6. Насыщенность коллекторов
- •1.7. Зависимости проницаемости от насыщенности коллекторов
- •1.8. Удельная поверхность
- •1.10. Карбонатность горных пород
- •1.11. Набухаемость пластовых глин
- •1.12. Механические свойства горных пород
- •1.13. Тепловые свойства горных пород
- •2.1. Состав природных газов
- •2.2. Способы выражения состава
- •2.3. Аддитивный подход расчета физико-химических свойств углеводородных газов
- •2.5. Состояние реальных газов
- •Критические давления, температуры и коэффициенты сверхсжимаемости компонентов нефтяных газов
- •2.7. Растворимость газов в нефти и воде
- •3.2. Физико–химические свойства нефти
- •3.2.1. Плотность нефти
- •3.2.3. Реологические свойства нефтий
- •3.2.5. Давление насыщения нефти газом
- •3.2.6. Сжимаемость нефти
- •3.2.7. Объёмный коэффициент нефти
- •3.2.9. Электрические свойства нефтей
- •3.3. Различие свойств нефти в пределах нефтеносной залежи
- •4. Фазовые состояния углеводородных систем
- •4.1. Схема фазовых превращений однокомпонентных систем
- •4.2. Фазовые состояния углеводородных смесей
- •4.3. Фазовые переходы в нефти, воде и газе
- •5.1. Химические свойства пластовых вод
- •5.1.1. Минерализация пластовой воды
- •5.1.2. Тип пластовой воды
- •5.1.3. Жесткость пластовых вод
- •5.1.4. Показатель концентрации водородных ионов
- •Величины ионного произведения воды при различных температурах
- •5.2.1. Плотность
- •5.2.2. Вязкость
- •5.2.3. Сжимаемость
- •5.2.4. Объёмный коэффициент
- •5.2.5. Тепловые свойства
- •5.2.6. Электропроводность
- •5.3. Характеристика переходных зон
- •6. Поверхностно–молекулярные свойства системы пласт–вода–нефть–газ
- •6.1. Роль поверхностных явлений в фильтрации
- •6.2. Поверхностное натяжение
- •6.4. Работа адгезии и когезии, теплота смачивания
- •6.5. Кинетический гистерезис смачивания
5.1. Химические свойства пластовых вод
Пластовые воды характеризуются набором свойств влияющие на процессы вытеснения нефти, так как она часто являясь вытесняющим агентом нефти из пласта, а следовательно, её свойства влияют на количество вытесненной нефти, на процессы подъема нефти на поверхность, на процессы сбора и подготовки скважинной продукции.
5.1.1. Минерализация пластовой воды
Минерализация воды характеризует содержание в ней растворённых солей в г/л, мг/л, г/м3, кг/м3. В пластовых водах всегда растворено некоторое количество (Q) солей. По степени минерализации пластовые воды делятся на четыре группы:
рассолы (Q > 50 г/л);
солёные (10 < Q < 50 г/л);
солоноватые (1< Q < 10 г/л);
пресные (Q ≤ 1 г/л).
Минерализация пластовой воды растёт с глубиной залегания пластов. Минерализация вод нефтяных месторождений колеблется от нескольких сотен г/м3 в пресной воде до 300 кг/м3 в концентрированных рассолах.
В пластовой воде содержатся ионы растворённых солей:
анионы: OH–; Cl–; SO42–; CO32–; HCO3–;
катионы: H+; K+; Na+; NH4+; Mg2+; Ca2+; Fe3+;
ионы микроэлементов: I–; Br–;
коллоидные частицы SiO2; Fe2O3; Al2O3;
нафтеновые кислоты и их соли.
Больше всего в воде содержится хлористых солей, до 80-90 % от общего содержания солей. В количественном отношении катионы солей пластовых вод располагаются в следующий ряд: Na+; Ca2+; Mg2+; K+; Fe3+.
Большое значение на растворимость солей и увеличение их концентрации в пластовых водах оказывает температура и парциальное давление СО2. Максимальная растворимость СаСО3 в воде наблюдается при 0оС, с возрастанием температуры она падает. Максимальная растворимость гипса (СаSО4·2Н2О) в воде наблюдается при 40оС. С дальнейшим возрастанием температуры она уменьшается. С увеличением парциального давления СО2 растворимость СаСО3 возрастает. Уменьшение пластового давления усиливает процесс выпадения солей СаСО3 и др. Изменение термобарической обстановки в пласте даже при небольшой минерализации пластовых вод влияет на растворимость солей и на процесс их выпадения.
5.1.2. Тип пластовой воды
По типу растворённых в воде солей различают хлоркальциевые (хлоркальциево-магниевые) и гидрокарбонатные (гидрокарбонатно-натриевые, щелочные) пластовые воды. Тип пластовой воды определяется анионом. Гидрокарбонатный тип воды определяется солями угольной кислоты, обусловленный наличием карбонат - CO32–, или бикарбонат - HCO3– аниона. Соли всех остальных кислот относятся к хлоркальциевому типу. В основном, это соли соляной кислоты – хлориды, обусловленный наличием Cl–– аниона.
5.1.3. Жесткость пластовых вод
Соли пластовых вод влияют, и определяет её жёсткость. Жёсткостью называется суммарное содержание растворённых солей двухвалентных катионов: кальция, магния и железа.
Жёсткость различают временную (карбонатную) и постоянную (некарбонатную). Временная жёсткость или карбонатная (Жк) обусловлена содержанием в воде карбонатов или гидрокарбонатов двухвалентных металлов: кальция, магния, железа.
Постоянная жёсткость или некарбонатная (Жнк) обусловлена наличием в воде сульфатов или хлоридов (или соли других кислот) двухвалентных металлов: кальция, магния, железа.
Общая жёсткость воды определяется как сумма карбонатной и некарбонатной:
Жо = Жк + Жнк (5.1)
Жёсткость
воды оценивается содержанием в ней
солей в миллиграмм эквивалентах на литр
![]() .
.
Жк, Жнк оценивают как сумму жесткостей всех i-ых ионов (∑gi):
Жо = gi (5.2)
Жесткость иона оценивается отношением массы иона к его эквиваленту:
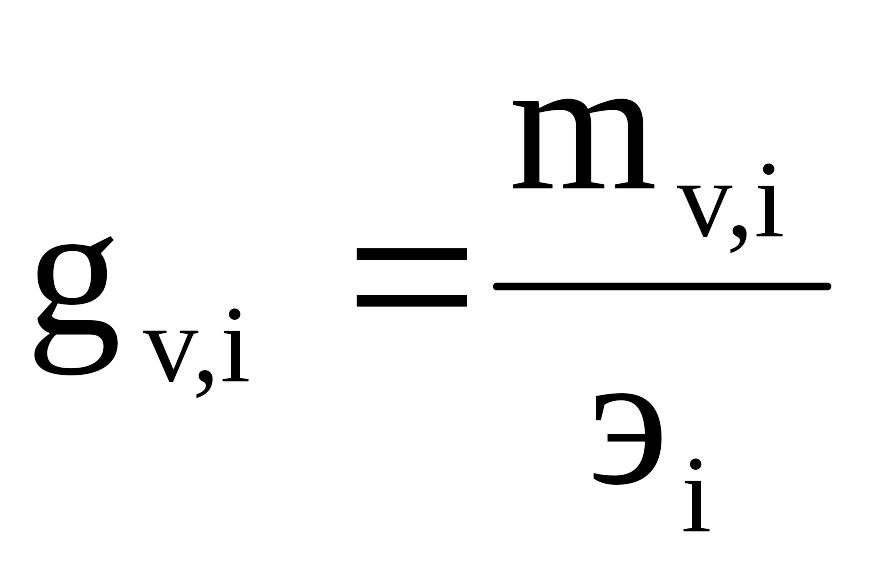 ,
(5.3)
,
(5.3)
где mvi – концентрация i-го иона в воде (мг/л);
эi – эквивалент i-го иона.
Эквивалент иона оценивается отношением молекулярной массы иона (МI) к его валентности (n):
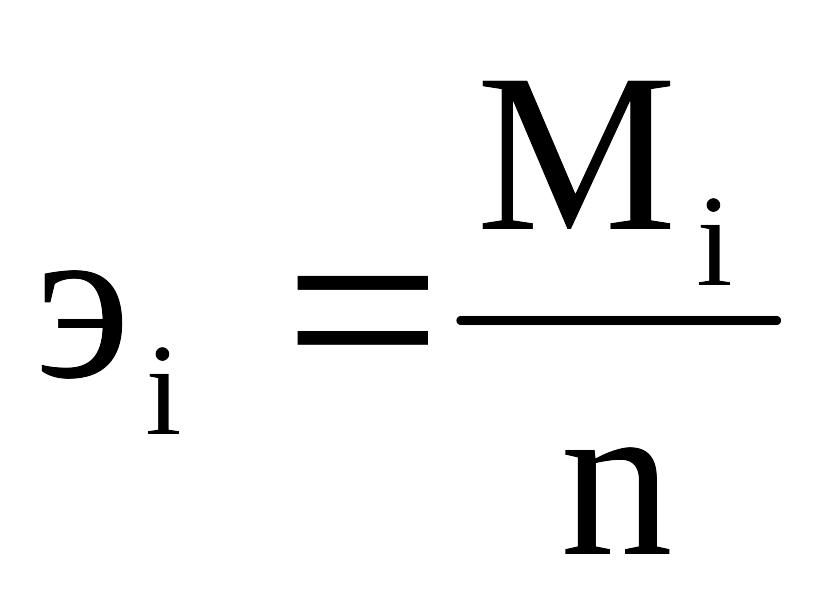 ,
(5.4)
,
(5.4)
где Мi – молекулярная масса иона;
n – валентность иона.
Рассмотрим пример. В одном литре воды содержатся ионы в количестве: Mg+2 =21мг и Ca+2 = 56 мг. Найти общую жесткость?.
Решение. Определим жесткость обусловленную наличием в воде ионов магния и кальция. Воспользуемся формулами 5.1–5.4:
Ж =G (мг -экв/л), g = m / Э, Э = Mn / Nn,
где Mn - масса иона;
Nn - валентность иона.
ММg = 24,3; ЭMg = 24,3 /2 = 12,5 мг-экв;
МCa = 40,08; ЭCa = 40,08 / 2 = 20 мг-экв;
gMg = 21/12,15 = 1,72 мг-экв/л; ЖMg = 1,728 мг - экв/л;
gCa = m/э = 56/20,04 = 2,79 мг-экв/л; ЖCa = 2,79 мгэкв/л;
Жобщ = ЖСa + ЖMg = 2,79 + 1,728 = 4,5181 (мг - экв/л).
Природные воды в зависимости от содержания в них двухвалентных катионов кальция, магния, железа подразделяются на следующие группы:
очень мягкая вода – до 1,5 мг-экв./л;
мягкая вода – 1,5-3,0 мг-экв./л;
умеренно жёсткая вода – 3,0-6,0 мг-экв./л;
жёсткая вода – более 6 мг-экв./л.
Жесткость пластовой воды и ее группа по жесткости определяется экспериментально-расчетным путем (см. разд. "Практикум для самостоятельной работы").
Временную (карбонатную) жёсткость можно устранить термическим методом, длительным кипячением или химическим методом – добавлением гидроксида кальция Са(ОН)2. В обоих случаях выпадает в осадок карбонат кальция СаСО3.
Постоянную жёсткость устраняют химическим способом с помощью добавления соды или щёлочи.
