
- •Лекция7 Второе начало термодинамики. Энтропия. Тепловой двигатель
- •4.1. II начало термодинамики
- •4.2. Обратимые и необратимые процессы
- •4.3. Круговые процессы. Коэффициент полезного действия тепловой машины.
- •4.4. Энтропия
- •4.5. Примеры вычисления энтропии
- •Энтропия идеального газа.
- •4.6. Цикл Карно
- •4.7. Термодинамическая диаграмма т – s и её применение
- •1) Cвязь между температурой и энтропией идеального газа в четырех простейших его процессах
4.4. Энтропия
Открытие Клаузиусом энтропии – одно из самых удивительных, сделанных на «кончике пера», т.е. чисто теоретическим. Несмотря на это обстоятельство и отсутствие приборов, которые бы измеряли энтропию вещества, это понятие оказалось плодотворным.
Энтропия S
вводится через элементарное приращение
как
![]() (2)
(2)
Особенность формулы:
- теплота
![]() не есть приращение какой-то функции, но
после деления на температуру Т
получается приращение некоторой функции
– энтропии.
не есть приращение какой-то функции, но
после деления на температуру Т
получается приращение некоторой функции
– энтропии.
В отличие от теплоты:
энтропия - функция состояния (как внутренняя энергия, температура или давление).
полученное системой тепло Q зависит от процесса перехода из начального состояния в конечное, приращение же энтропии
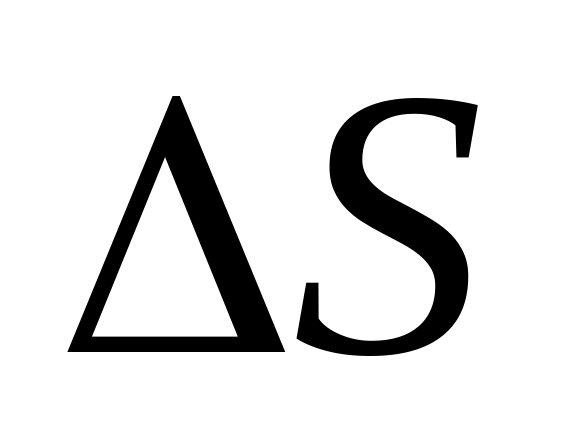 совершенно
не зависит от процесса, а зависит только
от начального и конечного состояний.
совершенно
не зависит от процесса, а зависит только
от начального и конечного состояний.
В интегральной
форме выражение (2) принимает вид
![]()
при этом не играет роли, какой именно процесс привел систему из состояния 1 в состояние 2.
Процесс перехода может быть даже необратимым. Однако, состояния 1 и 2 должны быть равновесными.
Введенное понятие энтропии позволяет вычислять разность энтропий в двух состояниях, но нельзя сказать чему равна энтропия в каждом из состояний, т.е. энтропия вычисляется с точностью до прибавления произвольной аддитивной постоянной.
Свойства энтропии.
 Энтропия
— функция состояния.
Энтропия
— функция состояния.
Если процесс проводят вдоль адиабаты, то энтропия системы не меняется. Значит адиабаты — это одновременно и изоэнтропы.
Каждой более “высоко” расположенной адиабате (изоэнтропе) отвечает большее значение энтропии.
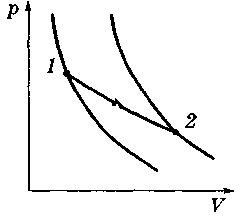
В этом легко
убедиться, проведя изотермический
процесс между точками 1 и 2, лежащими
на разных адиабатах ( рис. ). В этом
процессе Т = const,
поэтому
![]()
Для идеального
газа Q равно работе
А, совершаемой системой, так как
А > 0, то
![]() .
.
Таким образом, зная, как выглядит система адиабат, можно легко ответить на вопрос о приращении энтропии при проведении любого процесса между интересующими нас равновесными состояниями 1 и 2.
Э
p
нтропия — величина аддитивная: энтропия макросистемы равна сумме энтропий ее отдельных частей. энтропия изолированной системы в любом обратимом процессе не изменяется.
При передаче теплоты dQ от тела 1 к телу 2 в обратимом процессе температуры обоих тел одинаковы. Поэтому изменение dS2 энтропии тела 2, получающего теплоту dQ, равно и противоположно по знаку изменению dS1 энтропии тела 1, отдающего теплоту dQ:
![]()
Одно из важнейших свойств энтропии заключается в том, что энтропия замкнутой (т.е. теплоизолированной) макросистемы не уменьшается — она либо возрастает, либо остается постоянной (так ведет себя энтропия только замкнутых систем. Если система не замкнута, то её энтропия может как увеличиваться так и уменьшаться ).
Принцип возрастания энтропии замкнутых систем представляет собой еще одну формулировку второго начала термодинамики.
Величина возрастания энтропии в замкнутой макросистеме может служить мерой необратимости процессов, протекающих в системе. В предельном случае, когда процессы имеют обратимый характер, энтропия замкнутой макросистемы не меняется.
Теорема Нернста. При приближении температуры к абсолютному нулю энтропия макросистемы стремится к нулю
![]()
Эта теорема позволяет вычислить абсолютное значение энтропии:
![]()
При
![]() теплоемкость
теплоемкость
![]() всех макросистем должна тоже стремиться
к нулю, иначе интеграл не будет сходиться.
всех макросистем должна тоже стремиться
к нулю, иначе интеграл не будет сходиться.
Энтропия всегда вычисляется с точностью до произвольной аддитивной постоянной.
В последнем выражении она принята равной нулю.
Теорема Нернста не может бать выведена из первых двух начал термодинамики, поэтому называется третьим началом термодинамики.
