
- •Лекция7 Второе начало термодинамики. Энтропия. Тепловой двигатель
- •4.1. II начало термодинамики
- •4.2. Обратимые и необратимые процессы
- •4.3. Круговые процессы. Коэффициент полезного действия тепловой машины.
- •4.4. Энтропия
- •4.5. Примеры вычисления энтропии
- •Энтропия идеального газа.
- •4.6. Цикл Карно
- •4.7. Термодинамическая диаграмма т – s и её применение
- •1) Cвязь между температурой и энтропией идеального газа в четырех простейших его процессах
4.5. Примеры вычисления энтропии
Основное уравнение термодинамики. Оно представляет собой объединение энтропии с первым началом.
Подставив в
выражение для первого начала
![]() ,
,
получим для обратимых процессов:
![]() .
(3)
.
(3)
Это уравнение имеет многочисленные применения.
Энтропия идеального газа.
Пусть начальное
и конечное состояния, 1 и 2, газа
определяются параметрами
![]() и
и
![]() .
.
Согласно (3)
элементарное приращение энтропии
газа с учетом того, что dU=C![]() dT
и pV = νRT,
определяется как
dT
и pV = νRT,
определяется как
![]() .
(4)
.
(4)
Взяв дифференциал логарифма от vRT = pV получим
![]() (5)
(5)
и формуле (4) можно придать симметричный вид:
![]()
где учтено, что
![]()
Проинтегрировав последнее выражение, получим
![]()
3. Приращение энтропии при необратимом процессе между двумя равновесными состояниями 1 и. 2. Непосредственно считать энтропию по необратимому процессу совершенно невозможно. Но энтропия — функция состояния. Этим мы и воспользуемся, проведя между состояниями 1 и 2 какой-нибудь обратимый процесс, ничего общего не имеющий с реальным необратимым процессом. Обычно выбирают такой обратимый процесс, по которому расчет проще.
4. Возрастание энтропии при смешении газов.
Пусть в двух половинах теплоизолированного сосуда объемом V находятся два идеальных газа , 1 и 2, разделенных перегородкой.
Температура, давление и количество вещества в обеих половинах одинаково.
После удаления перегородки начинается необратимый процесс смешения газов, в результате которого система приходит в равновесное состояние, в котором оба газа равномерно перемешаны.
Температура в конечном состоянии окажется прежней, так как газы идеальные и система теплоизолирована.
При
![]() приращение
энтропии каждого газа равно
приращение
энтропии каждого газа равно
![]() ,
,
и суммарное
приращение энтропии системы
![]()
Приращение
![]() ,
так как процесс необратимый (обратный
процесс самопроизвольного разделения
газов невероятен).
,
так как процесс необратимый (обратный
процесс самопроизвольного разделения
газов невероятен).
Последняя формула
приводит к парадоксу
Гиббса.
Допустим, газы 1 и 2 тождественны. Тогда
после снятия перегородки энтропия
увеличивается, хотя конечное состояние
ничем не отличается от начального. Для
понимания описанной ситуации существенно
заметить, что формула получена только
для случая, когда газы различны. Для
тождественных газов
![]() .
.
Таким образом, формула справедлива только при смешивании различных газов, хотя бы это различие было сколь угодно малым.
4.6. Цикл Карно
Впервые изученный С. Карно (1824) .
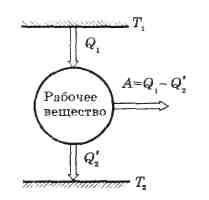 Циклом
Карно называется обратимый цикл,
который совершается теплом, вступающим
в теплообмен с двумя тепловыми резервуарами
бесконечно большой емкости. Этот
цикл
Циклом
Карно называется обратимый цикл,
который совершается теплом, вступающим
в теплообмен с двумя тепловыми резервуарами
бесконечно большой емкости. Этот
цикл
состоит из четырех обратимых процессов: двух изотермических и двух адиабатных.
позволил подойти к анализу коэффициентов полезного действия тепловых двигателей, т.о сыграл большую роль в развитии термодинамики и теплотехники.
Рассмотренный Карно тепловой двигатель состоял из
- нагревателя с температурой Т1;
- холодильника с температурой Т2;
- рабочего тела, т.е. устройства , способного получать тепло и совершать работу.
Под рабочим телом будем понимать идеальный газ в цилиндре с поршнем.
На рисунке изображен прямой цикл Карно, совершаемый идеальным газом и состоящий последовательных обратимых процессов:
1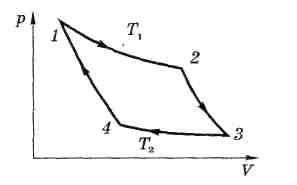 —2
- изотермического расширения при
температуре Т1 (газ находится в
контакте с нагревателем Т1, получает
тепло Q1) ,
—2
- изотермического расширения при
температуре Т1 (газ находится в
контакте с нагревателем Т1, получает
тепло Q1) ,
2 — 3 - адиабатного расширения,
3—4 - изотермического
сжатия при температуре Т2 (газ
отдает тепло
![]() холодильнику Т2);
холодильнику Т2);
4 – 1 - адиабатного сжатия.
При адиабатическом
процессе
![]() ,
поэтому
,
поэтому
![]() ,
т.е. S = const (процесс 2 -3 и 4-1).
,
т.е. S = const (процесс 2 -3 и 4-1).
Участок 1 – 2 и 3 -4 - изотермы, T = const
Можно показать, что КПД цикла Карно определяется выражением:
![]()
Практически прямой цикл Карно можно представить себе происходящим следующим образом.
Газ, заключенный в цилиндре с подвижным поршнем в процессе
1) изотермического расширения 1 – 2 газ находится в тепловом контакте и равновесии с телом, имеющим температуру Т1. Это тело называется нагревателем (теплоотдатчиком). Им может быть большой резервуар с водой. В процессе 1-2 нагреватель передает газу теплоту Q1 (Q1>0). Теплоемкость нагревателя должна быть бесконечно большой. Иначе отдача газу теплоты Q1 вызвала бы понижение температуры нагревателя, а следовательно, и нарушение изотермического процесса расширения газа 1 – 1 .
2) адиабатное расширение 2 –3 - газ полностью теплоизолируют. Для этого необходимо на участке 2 – 3 цикла разобщить газ с нагревателем и заключить в адиабатную оболочку, например покрыть цилиндр с газом толстым слоем войлока.
3) изотермическое сжатие 3—4 газ приводится в тепловой контакт с другим телом, имеющим температуру Т2 (Т2<Т1). Она называется холодильником (теплоприемником). В процессе 3 – 4 газ и передает холодильнику теплоту —Q2 (если считать, что Q2 есть теплота, получаемая газом от холодильника, т.е. Q2<0).
4) адиабатное сжатие 4 – 1 газ снова полностью теплоизолируется и до первоначального состояния 1, где цикл Карно завершается.
Работа, которую совершает рабочее тело в прямом цикле Карно, на основании уравнения равна
![]()
Из этой формулы видно, что A<Q1, т. е. при совершении рабочим телом цикла Карно полезная работа меньше энергии, полученной в форме теплоты от нагревателя, на количество теплоты, переданное холодильнику.
Этот результат справедлив для любого прямого кругового процесса: работа А, совершаемая за прямой цикл, всегда меньше количества теплоты Qподв., подводимого к рабочему телу всеми нагревателями.
Величина, равная отношению работы А, совершенной рабочим телом в прямом обратимом цикле, к количеству теплоты Qподв, сообщенному в этом процессе рабочему телу нагревателями, называется термическим коэффициентом полезного действия цикла.
![]()
Термический КПД
характеризует экономичность цикла теплового двигателя.
Зависит только от температур нагревателя и холодильника и определяется выражением:
![]()
Для прямого цикла Карно справедливо соотношение
![]() или
или
![]()
Доказано, что КПД всех обратимых машин, работающих при одних и тех же температурах нагревателя и холодильника, одинаков и определяется только температурами нагревателя и холодильника. Это теорема Карно.
Машина Карно (двигатель Карно) - самая эффективная из всех возможных типов тепловых машин. В машине Карно
используется цилиндр с поршнем, она не имеет каналов, так что во всех циклах многократно используется одно и тоже рабочее вещество.
Источник энергии (бензин, мазут и др. ) используется для поддержания постоянной температуры Т1 теплового резервуара.
Для работы машины необходим еще один резервуар с температурой Т2 (холодильник, например, озеро или река с водой).
Рассмотрим необратимый цикл.
Пусть машина работает с тем же нагревателем и холодильником, что и при обратимом цикле. После цикла машина возвращается в исходное состояние, поэтому приращение энтропии за цикл
![]() .
.
Все процессы, из
которых состоит цикл, необратимы, поэтому
![]() ,
тогда за цикл
,
тогда за цикл
![]() .
.
Этот интеграл представим в виде:
![]() ,
,
выражение
![]() соответствует получению от резервуара
с температурой Т1 (нагревателя)
тепла Q1 , поэтому
соответствует получению от резервуара
с температурой Т1 (нагревателя)
тепла Q1 , поэтому
![]() ;
;
выражение
![]() - это первый адиабатический участок
,
поэтому
=0;
- это первый адиабатический участок
,
поэтому
=0;
выражение
![]() соответствует передаче резервуару с
температурой Т2 (холодильнику)
тепла Q2 , поэтому
соответствует передаче резервуару с
температурой Т2 (холодильнику)
тепла Q2 , поэтому
![]() ;
;
![]() - второй адиабатический
участок цикла
- второй адиабатический
участок цикла
![]() ,
поэтому
,
поэтому
![]() ,
и
,
и
![]()
- КПД необратимой машины всегда меньше, чем обратимой, работающей в тех же условиях.
Если в качестве нагревателя и холодильника машины Карно являются кипящая и замерзающая вода, то =0,36. КПД двигателя использующегося на тепловых электростанциях 40%.
В любом случае при использовании тепловых машин большая часть энергии возвращается холодильнику в форме тепла, а затем рассеивается.
Теоретически доказано, что из всех тепловых машин, машина Карно имеет максимально возможный КПД.
Американское физическое общество предлагало определять КПД энергетических машин путем сравнения получаемой энергии с пределом, который можно получить с помощью идеальной машины Карно. Этот оценки получил название КПД по второму закону термодинамики.
КПД машины Карно можно увеличить, уменьшая температуру холодильника и увеличивая температуру нагревателя.
Отношение температур любых двух тепловых резервуаров можно найти, измеряя количество тепла, передаваемые за один цикл машины Карно. Это соотношение определяет термодинамическую шкалу температур. Она тождественна абсолютной шкале.
Для сопоставления температур двух тел нужно осуществить цикл Карно, используя тела в качестве нагревателя и холодильника. Отношение количества тепла, отдаваемого холодильнику, к количеству тепла, взятому у нагревателя, дает отношение температур рассматриваемых тел.
Докажем, что тепло может переходить лишь от горячего тела к холодному, а не наоборот. Рассмотрим два одинаковых тела, первоначально находящихся при температуре Т2 и Т2.
Между этими телами устанавливается тепловой контакт.
Через небольшой отрезок времени их температуры станут равными T1-dT1 и T1+dT1.
Теплота перехода dQ1= - mcdT1 и dQ2=+mcdT2.
Изменение энтропии первого тела dS1=dQ1/T1= - mcdT1/T1,
для второго dS2=dQ2/T2=+mcdT2/T2.
Суммарное изменение энтропии:dS=dS1+dS2= mcdT2/T2 - mcdT1/T1 = mcdT(1/T2-1/T1),
а изменение температуры: dT=(T1T2/mc)*(dS/T1-T2), dS>0,
следовательно, dT будет иметь тот же знак, что и T1-T2, т.е. dТ>0 при T1>T2 и dT<0 при T1<T2, т.е. тепло будет перетекать от тела с более высокой температурой к телу с меньшей температурой.
С этим фактом связана другая формулировка второго начала термодинамики, данная Клаузиусом: невозможны такие процессы, единственным конечным результатом которых был бы переход тепла от менее нагретого тела к более нагретому.
Полученный результат является частным случаем более общей теоремы:
При увеличении энтропии замкнутой системы, содержащей тела с разными температурами, возрастание энтропии ds сопровождается потерями полезной механической энергии, в количестве dS, \***\ на температуру более холодного тела. Таким образом, энтропия – это количество полезной энергии, которая теряется в расчёте на единицу температуры. Это ещё одна физическая интерпретация энтропии.
