
- •8. Окислительно-восстановительные процессы
- •8.1 Окислительно-восстановительные реакции
- •8.1.1. Степень окисления элементов
- •8.1.2. Составление уравнений окислительно-восстановительных реакций
- •8.2. Типы окислительно-восстановительных реакций
- •8.3. Направление окислительно-восстановительных реакций
- •8.4. Электрохимические процессы
- •8.4.1. Электродный потенциал
- •8.4.2. Уравнение Нернста
- •8.4.3. Гальванические элементы
- •8.4.4. Электродвижущая сила гальванического элемента
- •8.4.5. Измерение э.Д.С. Гальванического элемента
- •8.5. Химические источники тока
- •8.5.1. Гальванические первичные элементы
- •8.5.2. Аккумуляторы
- •8.5.3 Топливные элементы и электрохимические энергоустановки
- •8.6. Электролиз
- •8.6.1. Электролиз расплавов
- •8.6.2. Электролиз водных растворов
- •8.6.3. Законы электролиза
- •8.6.4. Электрохимическая поляризация при электролизе
- •8.6.5. Перенапряжение. Потенциал разложения
- •8.6.6. Выход по току
- •8.6.7. Применение электролиза
- •8.7. Коррозия металлов
- •8.7.1. Химическая коррозия
- •8.7.2. Электрохимическая коррозия
- •8.7.3. Методы защиты металлов от коррозии
8.7. Коррозия металлов
Коррозия - это разрушение металла под воздействием окружающей среды. Коррозия приводит к большим потерям в результате разрушения трубопроводов, цистерн, металлических частей машин, корпусов судов, морских сооружений и т.п. Безвозвратные потери металла от коррозии составляют до 15% от ежегодного выпуска стали. Кроме того, к убыткам от коррозии можно отнести также стоимость испорченных изделий и потерянного продукта: масла, газа, воды и т.п.. Выброс природного газа и других пожаро- и взрывоопасных веществ через прокорродировавшие отверстия может привести к взрывам и большим материальным и человеческим потерям.
Потери экономики от коррозии исчисляются млрд. рублей ежегодно. Цель борьбы с коррозией – это сохранение ресурсов металлов, мировые запасы которых ограничены.
По механизму коррозионного процесса различают химическую и электрохимическую коррозию.
8.7.1. Химическая коррозия
Химическая коррозия происходит при взаимодействии металла с сухими газами при повышенных температурах или неэлектролитами - жидкостями, непроводящими электрический ток (нефть сернистая) Химическая коррозия протекает без возникновения электрического тока. Этот тип коррозии также называется газовой коррозией.
При 250-300 ºС на поверхности углеродистой стали, чугуна появляется пленка оксидов, которая при повышении температуры до 600 ºC превращается в слой окалины из оксидов Fe3O4, имеющая поры и трещины.

Взаимодействие металлов с газами происходит при повышенных температурах в печах, двигателях внутреннего сгорания, ей подвергаются лопатки газовых турбин и металлы, подвергающиеся термической обработке.
Медь и алюминий защищает от коррозии защитная пленка:
![]()
8.7.2. Электрохимическая коррозия
Электрохимическая коррозия металлов является более распространенной. К ней относятся все случаи коррозии в водных растворах или во влажной атмосфере. К электрохимической коррозии также относится разрушение металлов при контакте двух разнородных металлов в присутствии H2O или других электролитов. Ей подвергаются подводные части судов, паровые котлы, трубопроводы в почве.
Механизм электрохимической коррозии связан с возникновением и работой на поверхности металла во влажной среде микрогальванических элементов. В результате коррозии протекает анодное окисление металла и катодное восстановление окислителя – среды. Скорость коррозии будет зависеть от природы металла, окислителя, природы и количества примесей в металле и среде.
1. Рассмотрим коррозию металла, содержащего малые включения инородного металла. Включения не влияют на величину потенциала основного металла. Этот вид коррозии будет наблюдаться, например, на стальном листе с медной заклепкой, контактирующим с кислотой HCl (рис. 24).

Возникающий гальванический элемент работает в соответствии со схемой:
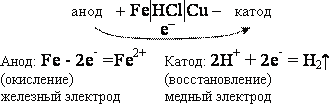
Это коррозия называется коррозией с водородной деполяризацией. (Окислитель называют обычно деполяризатором)
Согласно общим термодинамическим представлениям коррозия возможна, если потенциал металла в данной среде меньше, чем потенциал окислителя.
2. Рассмотрим коррозию стальных гвоздей во влажном воздухе.
Поверхность изделия содержит примеси углерода или карбидов (рис. 25) и покрыта во влажной атмосфере пленкой воды, с растворенным в ней кислородом.

Возникающий гальванический элемент работает в соответствии со схемой:

Это коррозия с кислородной деполяризацией.
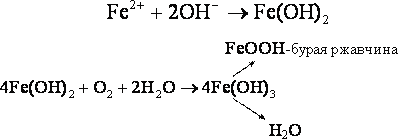
Примеси, загрязнения играют роль катода, металл – анода. Чистые металлы – не корродируются.
