
- •8. Окислительно-восстановительные процессы
- •8.1 Окислительно-восстановительные реакции
- •8.1.1. Степень окисления элементов
- •8.1.2. Составление уравнений окислительно-восстановительных реакций
- •8.2. Типы окислительно-восстановительных реакций
- •8.3. Направление окислительно-восстановительных реакций
- •8.4. Электрохимические процессы
- •8.4.1. Электродный потенциал
- •8.4.2. Уравнение Нернста
- •8.4.3. Гальванические элементы
- •8.4.4. Электродвижущая сила гальванического элемента
- •8.4.5. Измерение э.Д.С. Гальванического элемента
- •8.5. Химические источники тока
- •8.5.1. Гальванические первичные элементы
- •8.5.2. Аккумуляторы
- •8.5.3 Топливные элементы и электрохимические энергоустановки
- •8.6. Электролиз
- •8.6.1. Электролиз расплавов
- •8.6.2. Электролиз водных растворов
- •8.6.3. Законы электролиза
- •8.6.4. Электрохимическая поляризация при электролизе
- •8.6.5. Перенапряжение. Потенциал разложения
- •8.6.6. Выход по току
- •8.6.7. Применение электролиза
- •8.7. Коррозия металлов
- •8.7.1. Химическая коррозия
- •8.7.2. Электрохимическая коррозия
- •8.7.3. Методы защиты металлов от коррозии
8.4.2. Уравнение Нернста
Электродные потенциалы зависят от природы веществ, участвующих в электродном процессе, от соотношения между активностями этих веществ и температуры. Для разбавленных растворов, эта зависимость выражается уравнением Нернста в следующей форме:
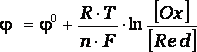
где ![]() -
стандартный электродный потенциал
данного процесса,
-
стандартный электродный потенциал
данного процесса, ![]() =
8,31 Дж/(мольК) - универсальная газовая
постоянная,
=
8,31 Дж/(мольК) - универсальная газовая
постоянная, ![]() -
абсолютная температура раствора,
-
абсолютная температура раствора, ![]() -
число молей электронов передаваемых в
процессе,
-
число молей электронов передаваемых в
процессе, ![]() =
96500 Кл/моль - постоянная Фарадея, [Ox] и [Red] –
произведения концентраций веществ,
участвующих в процессе в окисленной (Ox) и
восстановленной (Red) формах.
В общем случае в уравнении Нернста
вместо концентраций необходимо
использовать активности веществ.
=
96500 Кл/моль - постоянная Фарадея, [Ox] и [Red] –
произведения концентраций веществ,
участвующих в процессе в окисленной (Ox) и
восстановленной (Red) формах.
В общем случае в уравнении Нернста
вместо концентраций необходимо
использовать активности веществ.
После подстановки значений постоянных величин для стандартной при электрохимических измерениях температуре Т = 298 К уравнение Нернста имеет вид:
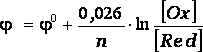 .
.
В электрохимической реакции растворения металла в растворе собственных ионов в условиях равновесия скорость растворения равна скорости разряда его ионов. Потенциал, устанавливающийся на электроде при равновесии, называется равновесным потенциалом металла.
При постоянных давлении и температуре для чистого металла активность и концентрацию металла можно положить равной, то есть
![]() .
.
Тогда
 .
.
8.4.3. Гальванические элементы
Гальванические элементы или химические источники электрической энергии это устройства, в которых химическая энергия окислительно-восстановительной реакции превращается в электрическую.
Рассмотрим
устройство и принцип работы гальванического
элемента Даниэля-Якоби. Он
состоит из корпуса 1 (рис. 22), разделенного
на две части пористой перегородкой 2. В
каждую из частей помещаются электроды:
медный 3 и цинковый 4. Медный электрод
погружается в раствор сульфата меди,
цинковый – в раствор сульфата цинка.
Пористая перегородка предотвращает
смешивание соприкасающихся растворов
и пространственно разделяет
окислительно-восстановительную реакцию,
протекающую при замкнутой внешней цепи:
окисление цинка и восстановление меди.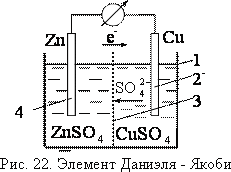
На поверхности цинка атомы, соприкасаясь с раствором, превращаются в ионы, гидратируются и переходят в раствор. В результате возникает двойной электрический слой, устанавливается равновесие и возникает электродный потенциал цинка.
![]() .
.
На медном электроде протекает аналогичный процесс, приводящий к возникновению электродного потенциала медного электрода.
![]() .
.
Потенциал цинкового электрода отрицательный по сравнению с медным электродом, поэтому при замыкании внешней цепи электроны будут переходить от цинка к меди. В результате этого равновесие на цинковом электроде сместится вправо и в раствор перейдет дополнительное число ионов цинка. На медном электроде равновесие сместится влево и произойдет разряд ионов меди. Эти процессы будут продолжаться до тех пор, пока не растворится весь цинк или не высадится на медном электроде вся медь.
Итак, при работе элемента Даниэля-Якоби протекают процессы:
-
Окисление цинка
![]()
![]() .
.
Этот процесс окисления называют анодным, а электрод – анодом.
-
Восстановление ионов меди
![]() .
.
Процессы восстановления называют в электрохимии катодными, а электроды, на которых идут процессы восстановления – катодами.
-
Движение электронов во внешней цепи.
Движение
ионов в растворе: анионов ![]() к
аноду, катионов
к
аноду, катионов ![]() к
катоду. Движение ионов в растворе
замыкает электрическую цепь гальванического
элемента.
к
катоду. Движение ионов в растворе
замыкает электрическую цепь гальванического
элемента.
Суммируя электродные реакции, получим:
![]() .
.
Это, так называемая, токообразующая реакция.
При схематическом отображении гальванического элемента границу раздела между проводником первого рода (металлом) и проводником второго рода (электролит) обозначают одной вертикальной чертой, а границу раздела между проводниками второго рода – двумя чертами:
![]()
или
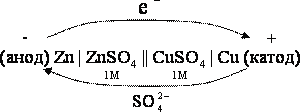
Гальванический элемент, составленный из одинаковых металлов, контактирующих с растворами солей этих же металлов различной концентрации (активности), называется концентрационным.
Схематически концентрационный элемент можно описать следующим образом
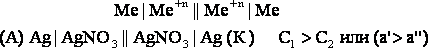 .
.
Электрический ток возникает при замыкании внешней цепи в процессе переноса вещества от анода к катоду и выравнивании концентраций. Оба электрода при работе не испытывают изменения.
Потенциалы электродов описываются уравнениями:
![]() ,
,
![]() ,
,
а э.д.с. концентрационного гальванического элемента выражением
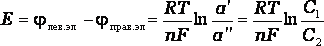 .
.
