
- •8. Окислительно-восстановительные процессы
- •8.1 Окислительно-восстановительные реакции
- •8.1.1. Степень окисления элементов
- •8.1.2. Составление уравнений окислительно-восстановительных реакций
- •8.2. Типы окислительно-восстановительных реакций
- •8.3. Направление окислительно-восстановительных реакций
- •8.4. Электрохимические процессы
- •8.4.1. Электродный потенциал
- •8.4.2. Уравнение Нернста
- •8.4.3. Гальванические элементы
- •8.4.4. Электродвижущая сила гальванического элемента
- •8.4.5. Измерение э.Д.С. Гальванического элемента
- •8.5. Химические источники тока
- •8.5.1. Гальванические первичные элементы
- •8.5.2. Аккумуляторы
- •8.5.3 Топливные элементы и электрохимические энергоустановки
- •8.6. Электролиз
- •8.6.1. Электролиз расплавов
- •8.6.2. Электролиз водных растворов
- •8.6.3. Законы электролиза
- •8.6.4. Электрохимическая поляризация при электролизе
- •8.6.5. Перенапряжение. Потенциал разложения
- •8.6.6. Выход по току
- •8.6.7. Применение электролиза
- •8.7. Коррозия металлов
- •8.7.1. Химическая коррозия
- •8.7.2. Электрохимическая коррозия
- •8.7.3. Методы защиты металлов от коррозии
8.7.3. Методы защиты металлов от коррозии
Электрохимические методы защиты.
1. Металлические покрытия. Корродирующий металл покрывают слоем другого металла, практически не разрушающегося в тех же условиях. Материалом для покрытия служат чистые металлы (цинк, медь, хром, серебро, олово и др.) и их сплавы (бронза, латунь и др.). В зависимости от соотношения между электродными потенциалами покрытия и защищаемого металла покрытия делят на две группы - анодные и катодные.
-
Анодное покрытие получают из металла, отрицательный электродный потенциал которого ниже потенциала защищаемого металла. Примером анодного покрытия является цинк на стали (оцинкованное железо), в растворе соляной кислоты (рис. 26). При повреждении покрытия возникает коррозионный элемент, в котором основной металл служит катодом и поэтому не корродирует.

Схема возникающего коррозионного гальванического элемента имеет вид
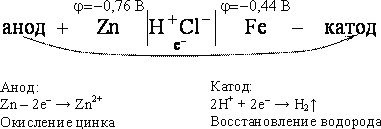
-
катодное покрытие получают из металла, электродный потенциал которого в данной среде выше потенциала защищаемого металла. Примером катодного покрытия на стали являются медь, никель, серебро, олово. Так как, металл покрытия менее активен по сравнению с защищаемым металлом, то катодные покрытия защищают металлы от коррозии только в отсутствии повреждений в покрытии. При повреждении покрытия возникает коррозионный элемент. Основной металл в поре повреждения служит анодом и растворяется, а металл покрытия служит катодом. В качестве примера рассмотрим процесс коррозии железа, покрытого оловом (луженное железа) в соляной кислоте при повреждении покрытия (рис. 27).

Схема возникающего при повреждении катодного покрытия коррозионного гальванического элемента имеет вид
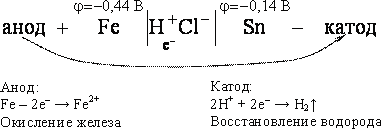
2. Протекторная защита – это метод защиты металлической конструкции (трубопровод, корпус судна), находящейся в среде электролита. В основе метода лежит торможение катодных или анодных реакций процесса коррозии. К защищаемой конструкции (рис. 28) прикрепляют пластины из металла Б (протектора) более активного, чем металл конструкции А. протектор постепенно разрушается, защищая от коррозии конструкцию А.

3. Электрозащита (катодная защита). Метод используется для защиты от коррозии конструкций (трубопроводы, кабели, корпуса подводных лодок, ворота шлюзов и др.), находящихся в коррозионной среде с высокой ионной проводимостью. Защищаемая конструкция подсоединяется к отрицательному полюсу источника тока – катоду, а металл (куски старого железа) – к аноду. При определенной силе тока на защищаемом изделии – катоде, идет восстановление окислителя, а анод – окисляясь, подвергается растворению.
Химические методы защиты.
Для защиты поверхности металлических изделий от коррозии широко применяются разнообразные металлические и неметаллические поверхностные покрытия, действие которых сводится к изоляции металла от окружающей среды. Кроме того, защитные покрытия часто имеют и декоративное значение.
1. Неметаллические защитные покрытия.
-
Эмалирование – это нанесение стекловидной массы – эмали на поверхность черного или цветного металла. Метод защиты применяется при производстве аппаратуры в фармацевтической, химической, пищевой отраслях промышленности и производстве изделий домашнего обихода.
-
Торкретирование – нанесение на поверхность слоя цементного раствора
-
Органические защитные покрытия представляют собой пленки высокополимерных веществ (каучук, синтетические смолы, битум), лакокрасочные покрытия. Наносимые покрытия должны сплошными, газо- и водонепроницаемыми, химически стойкими, обладать высоким сцеплением с металлом, механической прочностью.
2. Покрытия, образуемые на поверхности защищаемого металла.
Для создания защитного покрытия металлические изделия подвергают химической обработке для получения на его поверхности слоя химического соединения стойкого против коррозии. Для получения покрытий используются следующие процессы.
-
Оксидирование – образование на поверхности изделия при высокотемпературном окислении в воздухе или погружении в горячие концентрированные растворы щелочей защитной оксидной пленки: ZnO, Al2O3, FexOy.
-
Фосфатирование – процесс получения покрытия на стали из растворов ортофосфорной кислоты и ортофосфатов марганца: Fe3(PO4)2, Mn3(PO4)2.
-
Азотирование – процесс насыщения поверхности изделия азотом путем длительного нагревания в атмосфере NH3 при 500-600 ºС.
-
Воронение стали – это процесс поверхностного взаимодействия железа с органическими веществами при высоких температурах. При этом образуется слой Fe3O4 и др.
3. Изменение состава коррозионной среды.
Агрессивность коррозионной среды можно снизить уменьшением концентрации активных коррозионных компонентов. Коррозию, протекающую с поглощением кислорода, снижают деаэрацией среды (кипячение, барботаж инертного газа). Широкое распространение для защиты от коррозии получили ингибиторы. Ингибитор – это вещество, которое при добавлении в небольших количествах в коррозионную среду значительно уменьшает скорость коррозии металла. Ингибиторы, адсорбируясь на корродирующей поверхности, вызывают торможение анодных или катодных процессов.
4. Изменение состава технического металла.
Коррозионную стойкость металла повышают изменением состава его сплава. Этот метод называется легированием. При легировании в сплав металла вводят компоненты, вызывающие пассивность металла. Для стали такими компонентами являются хром, никель, вольфрам и др. При легировании повышается жаростойкость (стойкость к газовой коррозии при высоких температурах) и жаропрочность (сохранение высокой механической прочности при повышенных температурах). Так при легировании железа 12% Cr или 1% Si и 15% Crполучают нержавеющую сталь с высокой жаростойкостью, применяемую при изготовлении лопаток газовых турбин, реактивных двигателей и в двигателях внутреннего сгорания.
