
- •8. Окислительно-восстановительные процессы
- •8.1 Окислительно-восстановительные реакции
- •8.1.1. Степень окисления элементов
- •8.1.2. Составление уравнений окислительно-восстановительных реакций
- •8.2. Типы окислительно-восстановительных реакций
- •8.3. Направление окислительно-восстановительных реакций
- •8.4. Электрохимические процессы
- •8.4.1. Электродный потенциал
- •8.4.2. Уравнение Нернста
- •8.4.3. Гальванические элементы
- •8.4.4. Электродвижущая сила гальванического элемента
- •8.4.5. Измерение э.Д.С. Гальванического элемента
- •8.5. Химические источники тока
- •8.5.1. Гальванические первичные элементы
- •8.5.2. Аккумуляторы
- •8.5.3 Топливные элементы и электрохимические энергоустановки
- •8.6. Электролиз
- •8.6.1. Электролиз расплавов
- •8.6.2. Электролиз водных растворов
- •8.6.3. Законы электролиза
- •8.6.4. Электрохимическая поляризация при электролизе
- •8.6.5. Перенапряжение. Потенциал разложения
- •8.6.6. Выход по току
- •8.6.7. Применение электролиза
- •8.7. Коррозия металлов
- •8.7.1. Химическая коррозия
- •8.7.2. Электрохимическая коррозия
- •8.7.3. Методы защиты металлов от коррозии
8.4.4. Электродвижущая сила гальванического элемента
С помощью гальванического элемента можно совершить электрическую работу A за счет энергии химической реакции. Электрическая работа равна произведению разности потенциалов электродов на количество электричества.
Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой (э.д.с.) элемента.
э.д.с. Eэ равна разности равновесных потенциалов катода и анода
Eэ = φк - φа.
Если на электродах превращается один моль эквивалентов вещества, то по закону Фарадея через систему протекает один фарадей электричества, при превращении 1 моля вещества – n фарадеев электричества, равное числу молей эквивалентов в одном моле вещества. То есть, максимальная электрическая работа гальванического элемента при превращении 1 моля вещества равна
Aмэ = n·F·Eэ,
где Eэ - э.д.с. гальванического элемента;
n - число молей эквивалентов;
F – число Фарадея, 96500 Кл.
С другой стороны максимальная полезная работа, совершаемая системой при протекании реакции при постоянном давлении равна энергии Гиббса реакции.
Aмр = - ΔG.
Так как Aмр = Aмэ, то
Eэ = - [ΔG/(n·F)].
Это уравнение показывает связь между химической и электрической энергиями. Зная энергию Гиббса реакции, можно определить э.д.с. гальванического элемента и наоборот.
Энергия Гиббса реакции зависит от активностей реагентов и продуктов реакции или парциальных давлений. Рассчитаем э.д.с. для реакции
![]() .
.
Энергия Гиббса по уравнению Вант-Гоффа равна
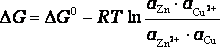 .
.
Здесь ΔG0 –
стандартная энергия Гиббса реакции; ![]() -
активности реагентов и продуктов
реакции, соответственно, (для газов
необходимо использовать вместо
активностей парциальные давления p).
-
активности реагентов и продуктов
реакции, соответственно, (для газов
необходимо использовать вместо
активностей парциальные давления p).
Так как ΔG = - n·F·Eэ, то
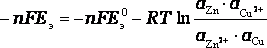 .
.
Отсюда
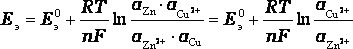 ,
,
где учтено, что активности чистых металлов aCu = aZn = 1, n = 2.
![]() -
стандартная э.д.с. элемента.
-
стандартная э.д.с. элемента.
Стандартной э.д.с. элемента называется э.д.с., если парциальные относительные давления исходных веществ и продуктов реакции равны единице или активности исходных веществ и продуктов реакции равны единице.
Для рассматриваемой реакции стандартная энергия Гиббса ΔG0 = - 212,3 кДж/моль. Поэтому стандартная э.д.с. элемента Даниэля-Якоби при температуре 298 К
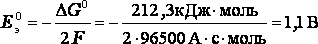
8.4.5. Измерение э.Д.С. Гальванического элемента
Напряжение, непосредственно измеряемое на клеммах гальванического элемента вольтметром, меньше его э.д.с.. (U < Eэ).
Разница обусловлена омическим падением напряжения на внутреннем сопротивлении элемента и другими эффектами. Измерение э.д.с., обычно, проводят компенсационным методом, при котором ток, протекающий через элемент, близок к нулю. Для этого параллельно элементу подключают внешний источник тока, э.д.с. которого имеет противоположный знак. В измерительную цепь включают также гальванометр для измерения тока и вольтметр для измерения напряжения. В момент, когда выходное напряжение внешнего источника тока равно э.д.с. гальванического элемента (момент компенсации э.д.с.), ток в цепи и показания гальванометра равны нулю. Измеренное в этот момент вольтметром напряжение на клеммах гальванического элемента равно его э.д.с..
Достаточно близким к э.д.с. элемента будет напряжение, измеренное на его клеммах, высокоомным, например цифровым, вольтметром.
Э.д.с. гальванического элемента измеряют для экспериментального определения термодинамических функций токообразующих реакций.
