
1. Лекции Термодинамика (УЭИ)
.pdf
50
более высокой температурой, при этом нижний источник отдаст количество теплоты q2 , а верхний получит количество теплоты ql = q2 + lц .
Р |
T |
|
|
1 |
|
|
q1 |
|
|
1 |
|
|
|
4 |
|
4 |
T1 |
|
|
-lц |
|
|
-qц |
2 |
T2 |
2 |
3 |
3 |
|
||
|
|
q2 |
|
|
|
|
|
v |
|
|
s |
Рисунок 4.5 - Обратный цикл Карно в pv- и Ts-координатах
Обратный цикл Карно является идеальным циклом холодильных установок и так называемых тепловых насосов.
Холодильный коэффициент обратного цикла Карно зависит только от абсолютных температур T1 и T2 источников теплоты и обладает наибольшим значением по сравнению с холодильными коэффициентами других циклов, протекающих в тех же пределах температур.
Доказательство этого утверждения совершенно аналогично доказательствам 1-й и 2-й теорем Карно.
Из рассмотрения обратного цикла Карно следует, что передача теплоты от тела менее нагретого к телу более нагретому возможна, но этот «неестественный» (точнее - несамопроизвольный) процесс требует соответствующей энергетической компенсации в системе. В обратном цикле Карно в качестве такой компенсации выступает затраченная работа.
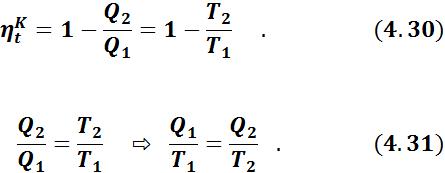
51
4.4 Обратимые и необратимые процессы
Если в результате какого-либо процесса система переходит из состояния А в другое состояние В и если возможно вернуть ее хотя бы одним способом в исходное состояние А и притом так, чтобы во всех остальных телах не произошло никаких изменений, то этот процесс называется обратимым. Если же это сделать невозможно, то процесс называется необратимым.
Если систему, из конечного состояния В можно вернуть в исходное состояние А безразлично каким способом, то такой процесс называется обрати-
мым в широком смысле слова.
Если же возможен обратный процесс (В→А), переводящий систему в исходное состояние А через ту же последовательность состояний, через которую прошла система в прямом процессе, то такой процесс называется обра-
тимым в узком смысле слова.
Все равновесные процессы обратимы и притом в узком смысле слова. Всякий равновесный круговой процесс может проходить как в прямом,
так и в обратном направлении.
Циклы бывают обратимые и необратимые. Цикл, состоящий из равновесных обратимых процессов, называют обратимым. Рабочее тело в таком цикле не должно подвергаться химическим изменениям.
Если хоть один из процессов, входящих в состав цикла, является необратимым, то и весь цикл будет необратимым.
Результаты исследований идеальных циклов могут быть перенесены на действительные, необратимые процессы реальных машин путем введения опытных поправочных коэффициентов.
4.5 Аналитическое выражение второго закона термодинамики
4.5.1 Аналитическое выражение в интегральной форме
Для обратимого цикла Карно термический КПД:
Отсюда следует, что для цикла Карно:

52
Учитывая, что подводимая теплота Q1 - величина положительная, а отводимая Q2 - отрицательная, получаем:
Отношение подводимой или отводимой теплоты к соответствующей абсолютной температуре называется приведенной теплотой.
Тогда равенство (4.32) можно сформулировать так: алгебраическая сум-
ма приведенных теплот для обратимого цикла Карно равна нулю.
Рассмотрим какой-либо произвольный обратимый цикл (рисунок 4.6). Разобьем такой цикл на бесконечно большое количество элементарных
обратимых циклов Карно.
Р
v
Рисунок 4.6 - Разбивка произвольного обратимого цикла на элементарные циклы Карно
Для каждого элементарного цикла Карно
Для всего произвольного цикла

53
Таким образом, алгебраическая сумма приведенных теплот для любого обратимого цикла равна нулю.
Уравнение (4.34), выведенное Клаузиусом в 1854 г., представляет собой математическое выражение второго закона термодинамики для произвольного обратимого цикла и называется первым интегралом Клаузиуса.
Именно это выражение позволило Клаузиусу позднее ввести понятие энтропии.
Для необратимого цикла Карно термический КПД будет меньше соответствующего КПД обратимого цикла при одинаковых температурах теплоотдатчика и теплоприёмника:
или
Так как Q2 / T2 есть величина отрицательная, то для необратимого цикла Карно получаем:
Алгебраическая сумма приведенных теплот для необратимого цикла Карно меньше нуля; она является величиной отрицательной.
Для произвольного необратимого цикла, составленного из бесконечно большого количества необратимых элементарных циклов Карно, получаим

54
Неравенство (4.38) представляет собой математическое выражение второго закона термодинамики для произвольного необратимого цикла и называется
вторым интегралом Клаузиуса.
Объединяя обе формулы (4.34) и (4.38), можно математическое выра-
жение второго закона в интегральной форме представить одним уравнением
где знак равенства относится к обратимым, а знак неравенства - к необратимым циклам.
4.5.2 Аналитическое выражение в дифференциальной форме
Рассмотрим изменение энтропии при необратимых процессах. Для этого проведем между состояниями 1 и 2 обратимый процесс (2-4-1) и условно пунктиром необратимый (1-3-2) (рисунок 4.7). Полученный в результате этих процессов цикл будет необратимым.
Р 
1
3
4
 2
2
v
Рисунок 4.8 - Необратимый цикл, состоящий из необратимого расширения (1-3-2) и обратимого сжатия (2-4-1)

55
Согласно уравнению (4.38) получим:
Так как процесс (2-4-1) обратимый, то второй интеграл равен разности S1-S2 , поэтому
Знак неравенства в уравнении (4.41) указывает на то, что в случае необратимого процесса интеграл в правой части его уже не выражает собой разности энтропии, а меньше ее.
Объединив уравнения (4.41) и (4.42), получим общее уравнение:
Энтропия есть функция состояния, поэтому изменение энтропии как для обратимого, так и необратимого процессов будет одним и тем же. Уравнение
(4.43) показывает, что для обратимого процесса  равен изменению эн-
равен изменению эн-
тропии (S2 - S1) , а для необратимого он меньше, чем (S2 - S1).
Так как уравнение (4.39) выражает собой второй закон термодинамики, то и уравнение (4.43) выражает тот же закон, но для более общего случая.
Выражение (4.39) применимо только к циклам, тогда как выражение (4.43) применимо к любым процессам, в которых начальное и конечное состояния 1 и 2 различны между собой.
Выражение (4.39) получается из (4.43) как частный случай.

56
В дифференциальной форме для элементарного процесса можно записать
где δQ
Т – абсолютная температура источника теплоты; Знак равенства относится к обратимым, а знак «больше» – к необратимым процессам.
Выражение (4.44) является математической записью второго закона термодинамики в дифференциальной форме.
Если система адиабатически изолирована (δQ = 0) , то из (4.44) следует:
Это есть закон возрастания энтропии.
Энтропия адиабатически изолированной системы не может убывать; она либо возрастает, либо остается постоянной.
Если  , то переход адиабатически изолированной системы из состояния 2 в состояние 1 невозможен, так как он сопровождался бы убыванием энтропии.
, то переход адиабатически изолированной системы из состояния 2 в состояние 1 невозможен, так как он сопровождался бы убыванием энтропии.
Наоборот, адиабатический переход системы из состояния с меньшей энтропией 1 в состояние с большей энтропией 2 не противоречит постулату второго начала термодинамики и в этом смысле является возможным.
Второе начало, таким образом, позволяет судить о направлении процессов, которые могут происходить в природе.
4.6 Эксергия
Эксергия Е (Дж) - это максимальная полезная работа, которую может совершить система при обратимом переходе из первоначального состояния в состояние равновесия с окружающей средой.
4.6.1 Расчетные формулы
Для расчета эксергии пользуются следующими формулами:

57
1 Эксергия теплоты
Как было показано в п.4.3.1, в заданном интервале температур наибольший КПД имеет обратимый цикл Карно.
Следовательно, максимальная полезная работа некоторого количества тепла Q , отбираемого от горячего источника с температурой Т, будет получена в том случае, когда в рассматриваемой системе осуществляется обратимый цикл Карно.
Тогда выражения для полной и удельной эксергии теплоты выглядят следующим образом:
где Т0 – температура окружающей среды.
Как видно из этих уравнений, эксергия (работоспособность) тепла тем больше, чем меньше отношение Т0 /Т.
Если температуры источников тепла равны между собой (Т0 = Т), то работоспособность тепла в этом случае равна нулю.
2 Эксергия изолированной системы
Удельная эксергия е (Дж/кг) изолированной системы определяется следующим выражением:
где величины без индекса относятся к первоначальному состоянию системы, а величины с индексом «0» – к параметрам окружающей среды.
Как видно из этих уравнений, величина эксергии системы однозначно определяется начальными параметрами источника работы и параметрами среды.
3 Эксергия потока рабочего тела
Формулу для удельной эксергии потока можно записать следующим образом:
где величины без индекса относятся к первоначальным параметрам потока, а величины с индексом «0» – к параметрам окружающей среды.
Из этого уравнении следует, что эксергия потока однозначно определена, если заданы параметры этого потока р и Т, и параметры среды (р0 и Т0).

58
4.6.2 Эксергетический анализ
Понятие эксергии оказывается весьма удобным для анализа степени термодинамического совершенства того или иного теплового аппарата.
В самом деле, рассмотрим какой-либо тепловой аппарат (например, тур-
бину), в который входит поток рабочего тела с параметрами р1 , Т1 |
и, соответ- |
||
ственно, удельной эксергией |
. |
|
|
Из аппарата этот поток рабочего тела выходит, имея параметры р2 , Т2 и |
|||
эксергию |
. |
|
|
Внутри аппарата этот поток произвел полезную работу |
. |
||
Если процесс внутри аппарата необратим, то в аппарате имеет место потеря работоспособности  потока.
потока.
Эта потеря работоспособности, очевидно, будет равна:
Если эксергия потока на входе в аппарат равна  , а на выходе из аппарата
, а на выходе из аппарата  , то разность величин (
, то разность величин ( –
– ) расходуется на совершение полезной работы
) расходуется на совершение полезной работы  и на потери, обусловленные необратимостью.
и на потери, обусловленные необратимостью.
Если бы процессы в этом аппарате были обратимы, то потеря работоспособности отсутствовала бы ( ) и в этом случае поток совершил бы
) и в этом случае поток совершил бы
максимально полезную работу:
В этом и состоит основная идея эксергетического метода: рабочее тело входит в аппарат с эксергией и, совершив полезную работу  , выходит из аппарата с эксергией , при этом потеря работоспособности вследствие необратимости процессов внутри аппарата определяется по уравнению
, выходит из аппарата с эксергией , при этом потеря работоспособности вследствие необратимости процессов внутри аппарата определяется по уравнению
(4.49).
Важно подчеркнуть, что этот метод позволяет судить о степени обратимости процессов внутри аппарата по внешней характеристике – разности эксергий на входе аппарата и на выходе из него.
В величину  входят потери работоспособности, обусловленные
входят потери работоспособности, обусловленные
как трением, так и теплообменом при конечной разности температур; в величине  учтены и потери тепла аппаратом, обусловленные теплообменом
учтены и потери тепла аппаратом, обусловленные теплообменом
с окружающей средой.
Суть эксергетического метода – подсчет потерь работоспособности.

59
Для количественной опенки степени термодинамического совершенства того пли иного аппарата используется понятие так называемого эксергетического КПД, определяемого как
Если процессы в аппарате обратимы, то |
и экс = 1. |
Для тепловых аппаратов, не производящих полезной работы, определение эксергетического КПД по уравнению (4.51) лишено смысла.
Для таких аппаратов логично определять эксергетический КПД следующим образом:
Эта величина является мерой необратимости процессов, протекающая внутри аппарата; если бы эти процессы были обратимыми, то  и
и
 .
.
Вуравнениях (4.51) и (4.52) под  подразумевается сумма эксергий потока рабочего тела и потока тепла.
подразумевается сумма эксергий потока рабочего тела и потока тепла.
Внастоящее время эксергетический метод получает распространение в различных областях теплотехники и холодильной техники.
Вопросы для самопроверки
1.Возможен ли процесс, в котором теплота, взятая от горячего источника, полностью превращается в работу?
2.Можно ли в круговом процессе превратить всю подведенную теплоту в работу?
3.Что называется круговым процессом, или циклом?
4.Какие требуются условия для создания непрерывного процесса превращения теплоты в работу?
5.Основные формулировки второго закона термодинамики.
6.Что называется термическим КПД?
7.При каких условиях термический КПД цикла может быть равен единице?
8.Обратимый цикл Карно. Теоремы Карно.
9.От каких параметров зависит термический КПД обратимого цикла Карно?
10.Может ли быть термический КПД обратимого цикла Карно равен единице?
11.Можно ли получить термический КПД цикла теплового двигателя больше, чем термический КПД цикла Карно?
12.Обратный цикл Карно. Какие машины работают по обратному циклу Карно?
