
- •Вопрос № 1.Метод и законы.
- •Вопрос №2.
- •Вопрос №3.
- •Вопрос №4 Теплоёмкость.
- •Вопрос №5
- •Вопрос №6
- •Второе начало термостатики
- •Вопрос 19.
- •Истечение паров, жидкостей и газов.
- •Истечение сжимаемых жидкостей (паров и газов).
- •Переход через критическую скорость (сопло Лаваля).
- •Особенности истечения из каналов переменного сечения.
- •Дросселирование.
- •Циклы газотурбинных установок (гту)
- •Циклы поршневых двигателей внутреннего сгорания
- •Теплопередача.
- •Основы теории теплообмена.
- •Теплопроводность.
- •Дифференциальное уравнение теплопроводности.
- •Решение:
- •Лучистый теплообмен.
- •Решение:
- •Холодильные установки.
- •Воздушная холодильная установка
- •Аборбционная холодильная установка
- •Газотурбинные установки.
Вопрос №3.
Термодинамич.работа:
![]() ,
где
,
где
![]() - обобщённая сила,
- обобщённая сила,
![]() - координата.
- координата.
Удельная
работа:
![]() ,
,
![]() ,
где
,
где
![]() - масса.
- масса.
Если
![]() и
и
![]() ,
то идёт процесс расширения
,
то идёт процесс расширения![]() работа
положительная. Если
работа
положительная. Если
![]() и
и
![]() ,
то идёт процесс сжатия
работа
отрицательная.
,
то идёт процесс сжатия
работа
отрицательная.
Если рассматривать малое изменение объёма, то давление при этом изменении практически не изменяется.
П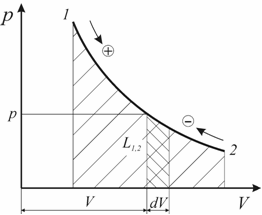 олную
термодинамическую работу можно найти
по формуле:
олную
термодинамическую работу можно найти
по формуле:
![]() .
.
В случае если
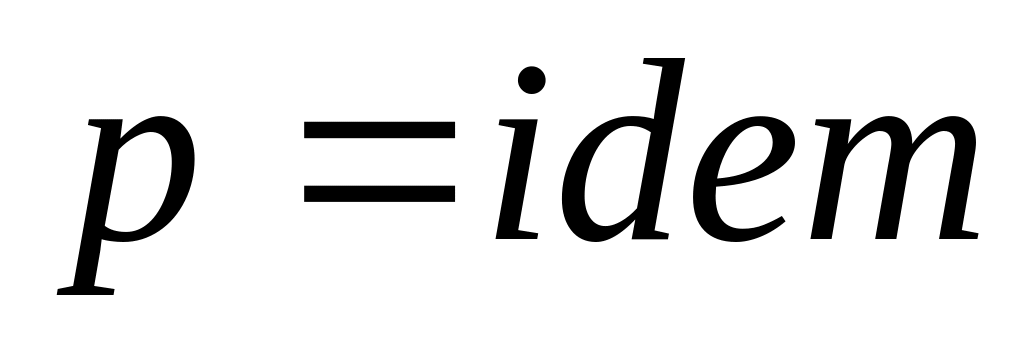 ,
то
,
то
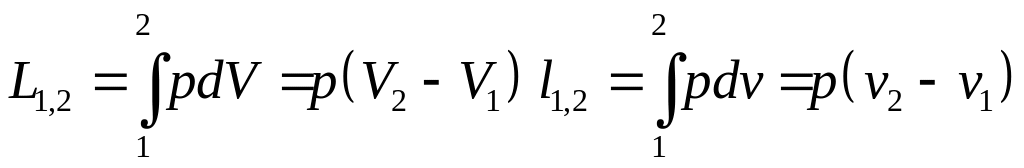 .
.В случае если дано уравнение процесса -
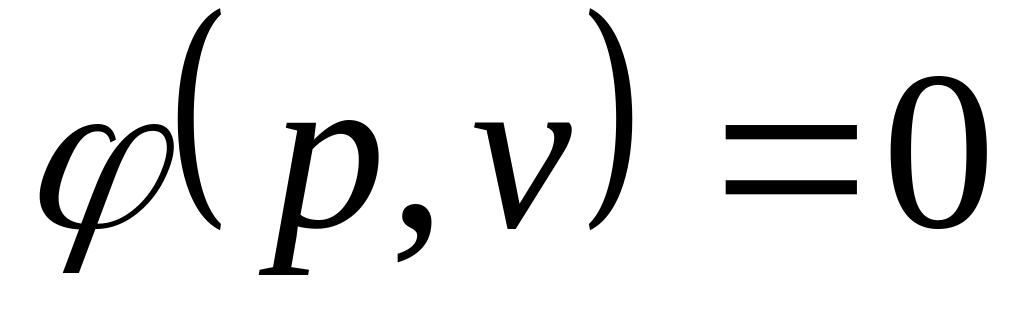 ,
то работа распределяется на две части:
,
то работа распределяется на две части:
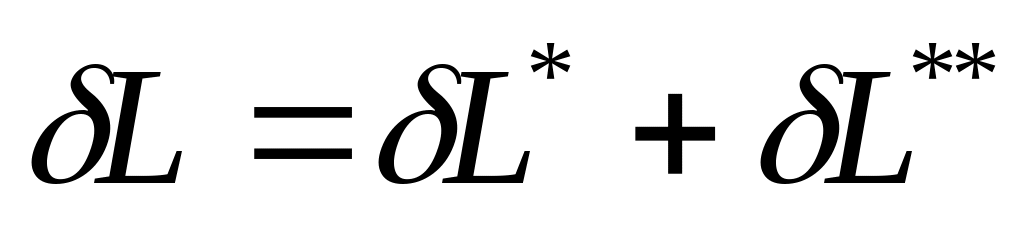 ,
где
,
где
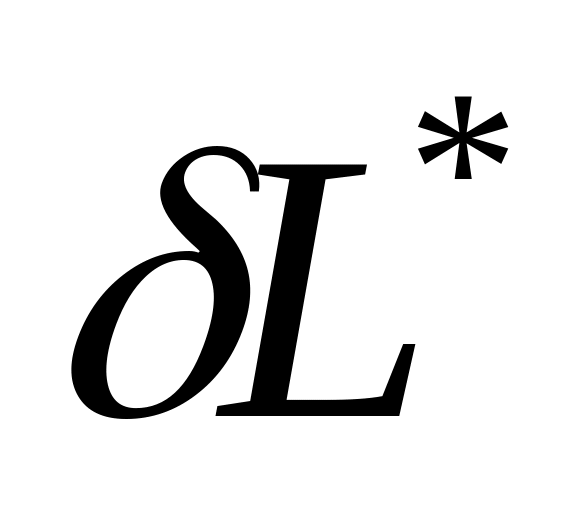 - эффективная работа,
- эффективная работа,
 - необратимые потери, при этом
- необратимые потери, при этом
 - теплота внутреннего теплообмена, то
есть необратимые потери превращаются
в теплоту.
- теплота внутреннего теплообмена, то
есть необратимые потери превращаются
в теплоту.
Потенциальная работа – работа, вызываемая изменением давления.
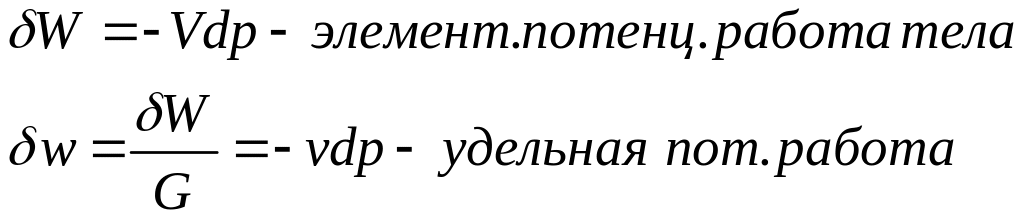
Если
![]() и
и
![]() ,
то идёт процесс расширения. Если
,
то идёт процесс расширения. Если
![]() и
и
![]() ,
то идёт процесс сжатия.
,
то идёт процесс сжатия.
Если рассматривать малое изменение давления, то объём при этом изменении практически не изменяется.
П олную
потенциальную работу можно найти по
формуле:
олную
потенциальную работу можно найти по
формуле:
![]() .
.
В случае если
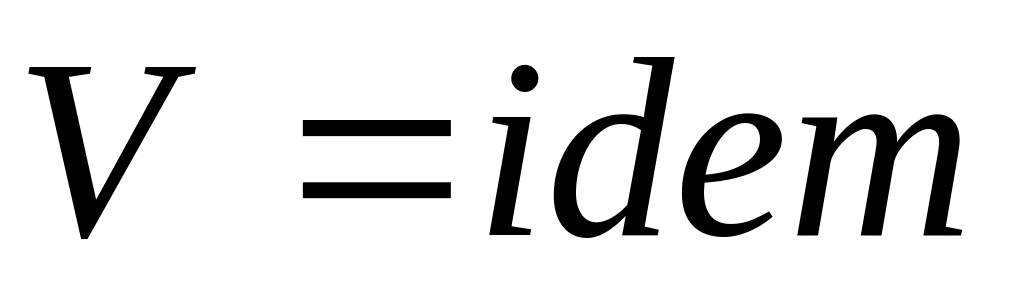 ,
то
,
то
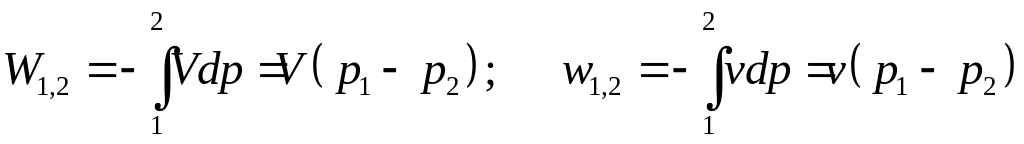 .
.В случае если дано уравнение процесса -
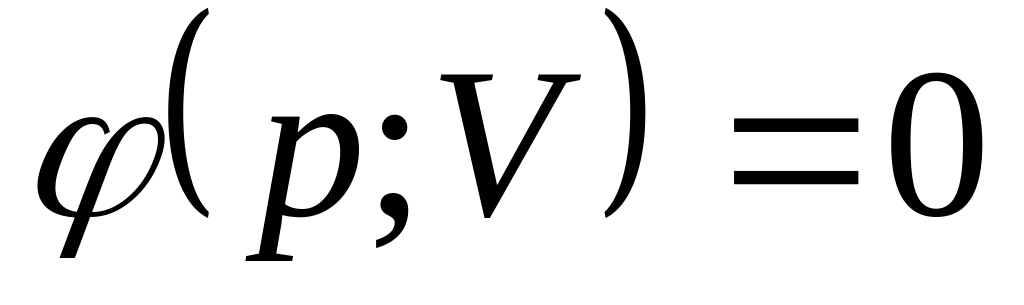 ,
то
,
то
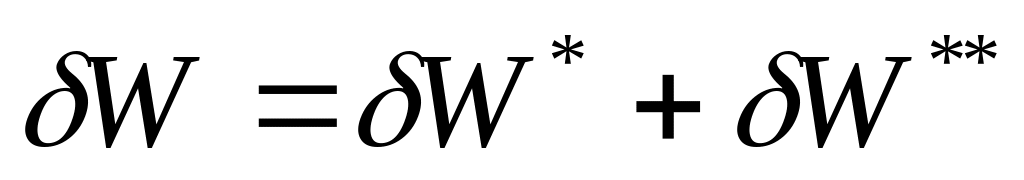 .
.
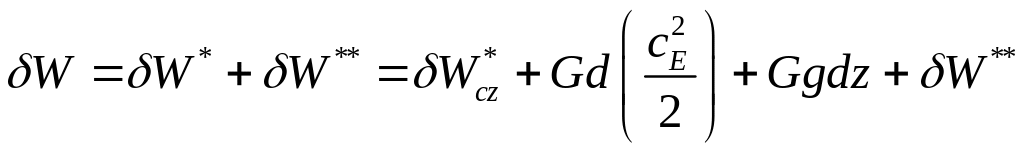 ,
где
,
где
![]() - работа, переданная внешним системам.
- работа, переданная внешним системам.
![]() ,сE-скорость
движения тела,dz-изменение
высоты центра тяжести тела в поле
тяготения
,сE-скорость
движения тела,dz-изменение
высоты центра тяжести тела в поле
тяготения
Вопрос №4 Теплоёмкость.
теплоёмкость –количество тепла,которое надо сообщить еденице массы,количества или объема вещества,чтобы его температура повысилась на 1 градус.
Истинная
теплоемкость:![]() ,
где
,
где
![]() - какой-то процесс.
- какой-то процесс.
![]() .
При изохорном процессе
.
При изохорном процессе
![]() ,
следовательно, получаем изохорную
теплоёмкость -
,
следовательно, получаем изохорную
теплоёмкость -
![]() .
При изобарном процессе
.
При изобарном процессе
![]() ,
следовательно, получаем изобарную
теплоёмкость
,
следовательно, получаем изобарную
теплоёмкость
![]() .
.
Объёмная
теплоёмкость
![]() :
:
Объемная изобарная теплоёмкость -
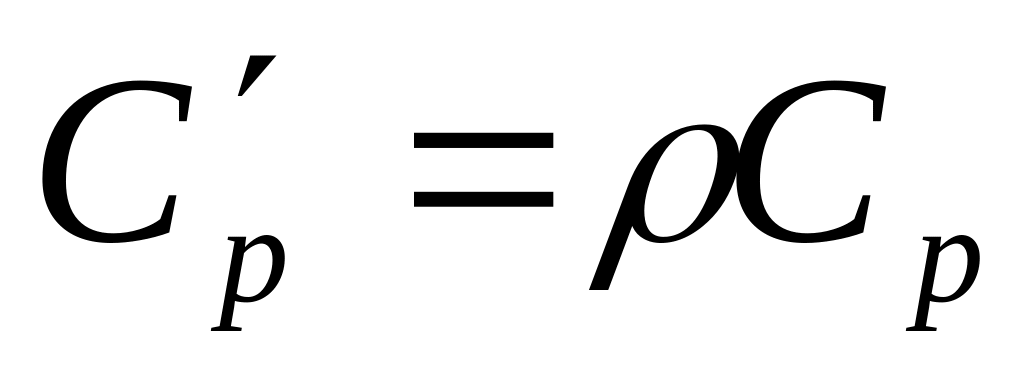 .
.Объёмная изохорная теплоёмкость -
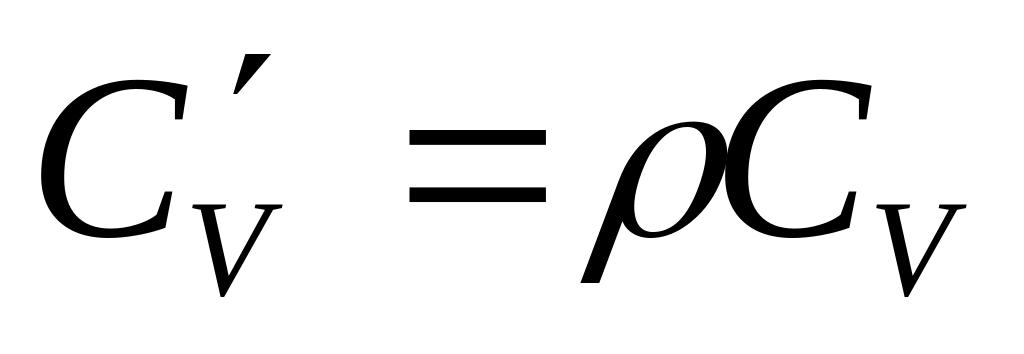 .
.
Молярная
теплоёмкость
![]() :
:
Молярная изобарная теплоёмкость -
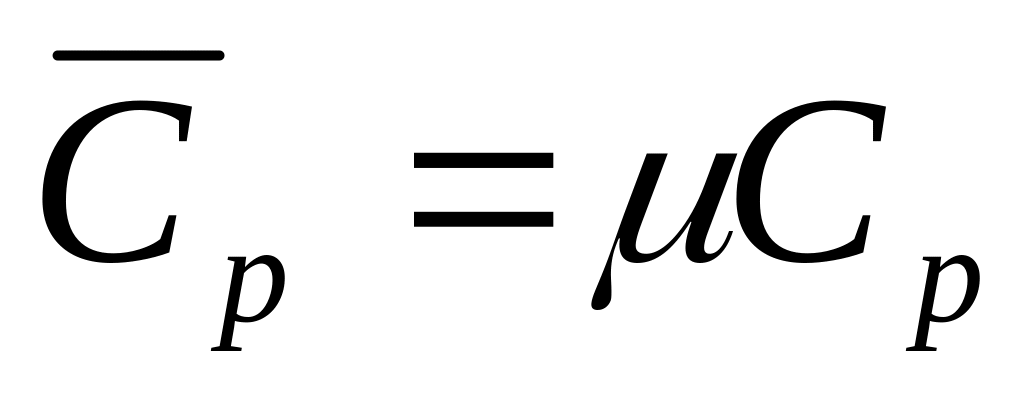 .
.Молярная изохорная теплоёмкость -
 .
.
Средняя
теплоёмкость
![]() .
.
![]() -первая
сред.теплоемкость-численно равна
истинной теплоемкоти при
среднеарифм.температуре процесса.
-первая
сред.теплоемкость-численно равна
истинной теплоемкоти при
среднеарифм.температуре процесса.
Вопрос №5
Первое начало термодинамики – это количественное выражение закона сохранения и превращения энергии.
Закон сохранения и превращения энергии является универсальным законом природы и применим ко всем явлениям. Он гласит: «запас энергии изолированной системы остается неизменным при любых происходящих в системе процессах; энергия не уничтожается и не создается, а только переходит из одного вида в другой».
Математическое выражение первого начала термодинамики.
Внутренняя
энергия изолированной системы сохраняет
своё постоянное значение при всех
изменениях, протекающих внутри системы,
то есть
![]() .
Изменение внутренней энергии
неизолированной системы складывается
из подведённой (отведённой) теплоты и
подведённой (отведённой) работы, то есть
.
Изменение внутренней энергии
неизолированной системы складывается
из подведённой (отведённой) теплоты и
подведённой (отведённой) работы, то есть
![]() .
.
Первое
начало термодинамики по внешнему
балансу:
![]() ,
где
,
где
![]() - теплота внешнего теплообмена, то есть
количество теплоты, которая подводится
из вне,
- эффективная работа, то есть
термодинамическая работа без учёта
работы эффективных потерь. Первое начало
термодинамики по внешнему балансу
справедливо для обратимых процессов.
- теплота внешнего теплообмена, то есть
количество теплоты, которая подводится
из вне,
- эффективная работа, то есть
термодинамическая работа без учёта
работы эффективных потерь. Первое начало
термодинамики по внешнему балансу
справедливо для обратимых процессов.

В термодинамике приняты следущие знаки при определении работы и теплоты в уравнениях первого начала термодинамики: если работа выполняется телом, то она положительная; если работа подводится к телу, то она отрицательная. Если теплота сообщается телу, она имеет положительное значение; если теплота отводится от тела, она имеет отрицательное значение.
