
- •Вопрос № 1.Метод и законы.
- •Вопрос №2.
- •Вопрос №3.
- •Вопрос №4 Теплоёмкость.
- •Вопрос №5
- •Вопрос №6
- •Второе начало термостатики
- •Вопрос 19.
- •Истечение паров, жидкостей и газов.
- •Истечение сжимаемых жидкостей (паров и газов).
- •Переход через критическую скорость (сопло Лаваля).
- •Особенности истечения из каналов переменного сечения.
- •Дросселирование.
- •Циклы газотурбинных установок (гту)
- •Циклы поршневых двигателей внутреннего сгорания
- •Теплопередача.
- •Основы теории теплообмена.
- •Теплопроводность.
- •Дифференциальное уравнение теплопроводности.
- •Решение:
- •Лучистый теплообмен.
- •Решение:
- •Холодильные установки.
- •Воздушная холодильная установка
- •Аборбционная холодильная установка
- •Газотурбинные установки.
Вопрос 19.
Следствия второго начала термостатики широко применяются в термодинамических расчетах и формулируются на основе анализа его математического выражения (162), (163).
Следствие I. Совместное выражение первого начала термодинамики и второго начала термостатики позволяет получить дифференциальное уравнение термодинамики, которое связывает между собой все термодинамические свойства веществ
T
ds=
cv
dT
+
![]() =
cp
dT
+
=
cp
dT
+
![]() .
.
Следствие II. Координаты Т - S являются универсальными координатами термодинамического теплообмена.
Следствие III. Адиабатный процесс является процессом изоэнтропийным.
Так
как в адиабатном процессе теплообмен
отсутствует (Q
= 0),
то, согласно второму началу термостатики
(162), в таком процессе изменение энтропии
dS
= 0
(S
= idem).
Согласно этому следствию, показатель
адиабатного процесса (![]() )
равен показателю изоэнтропийного
процесса (
)
равен показателю изоэнтропийного
процесса (![]() )
)
![]() .
.
Следствие IV. Коэффициент полезного действия и холодильный коэффициент термодинамических циклов тепловых машин не зависят от вида цикла и природы рабочего тела, а определяются лишь средними абсолютными температурами рабочего тела в процессах подвода и отвода теплоты.
(8)
Следствие
V.
Коэффициент
полезного действия и холодильный
коэффициент цикла Карно всегда выше
этих коэффициентов эффективности для
любых других термодинамических циклов
тепловых машин, осуществляемых в
одинаковом диапазоне предельных
температур рабочего тела (![]() ).
).
Это
следствие вытекает из анализа соотношений
по определению КПД цикла Карно![]() и любого термодинамического цикла
и любого термодинамического цикла![]() =
=
![]() =1
-
=1
-
![]() теплового двигателя. Вследствие того,
что Т1
>Тm1
и Т2
< Тm2
теплового двигателя. Вследствие того,
что Т1
>Тm1
и Т2
< Тm2
![]() .
(9)
.
(9)
Аналогичный вывод можно сделать и при сравнении холодильных коэффициентов обратных циклов
![]() .
(10)
.
(10)
Рассматриваемое следствие утверждает, что цикл Карно является эталонным циклом, по сравнению с которым можно определить термодинамическое совершенство любого цикла, осуществляемого в заданном интервале предельных значений температур рабочего тела.
Следствие VI. Изменение энтропии системы равно сумме изменений энтропии всех тел, входящих в систему (теорема аддитивности энтропии).
Количество
теплоты, полученное в элементарном
процессе системой, состоящей из
![]() тел, можно определить из соотношения
тел, можно определить из соотношения
![]() ,
(11)
,
(11)
что и подтверждает справедливость сформулированного следствия
![]() .
(12)
.
(12)
Вопрос №20.
В
рамках классической термодинамики
второе начало термодинамики формулируется,
как обобщённый принцип существования
и возрастания энтропии, то есть
![]() .
Если
.
Если
![]() ,
то процесс – обратимый. Если
,
то процесс – обратимый. Если
![]() ,
то процесс реальный.
,
то процесс реальный.
Для
изолированной системы (то есть
![]() )
выполняется принцип существования
энтропии:
)
выполняется принцип существования
энтропии:
![]() .
Для реальной системы выполняется принцип
возрастания энтропии:
.
Для реальной системы выполняется принцип
возрастания энтропии:
![]() .
.
Поскольку в рамках классической формулировки второго начала термодинамики невозможно определение энтропии реального газа, то этот процесс делят на два этапа:
Второе начало термодинамики (принцип существования энтропии)
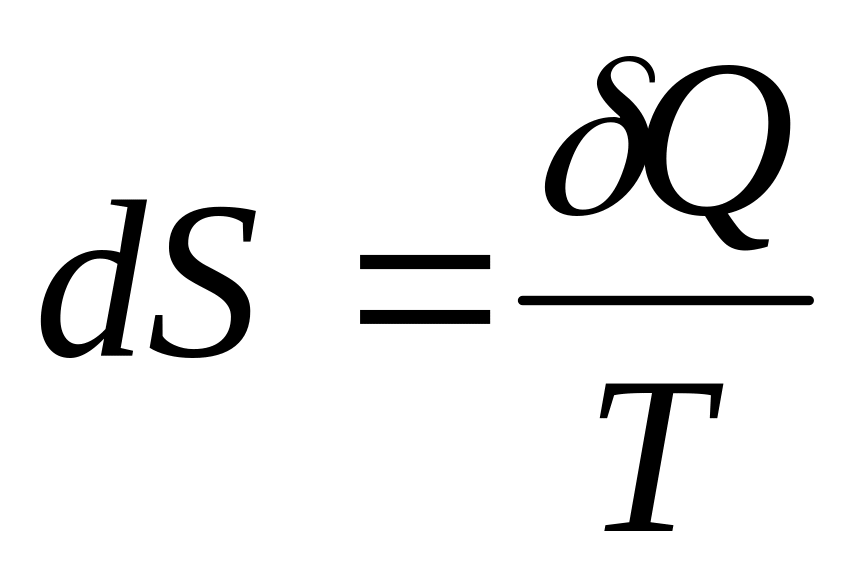 .
.Второе начало термодинамики (принцип возрастания энтропии) .
Математическое выражение принципа существования энтропии: . При этом выполняются следующие условия:
Абсолютная температура является единственной функцией (спросить!!!).
Невозможен одновременный теплообмен.
Невозможно в рамках одной пространственной системы осуществить одновременное превращение работы в тепло и тепла в работу.
Вопрос № 21
Следствие
I.
Невозможно осуществление полного
превращения теплоты работу, т.е. нельзя
создать вечный двигатель второго рода
с коэффициентом полезного действия
равным единице.Это следствие вытекает
из постулата в формулировке Томсона-Кельвина,
согласно которой всякий тепловой
двигатель должен иметь как минимум два
источника теплоты с различной температурой
Т1
и
Т2.
Следовательно, всегда ![]() >
0 и поэтому
>
0 и поэтому
![]() .
.
Следствие II. КПД реального теплового двигателя и холодильный коэффициент реальной холодильной машины, в которых осуществляются циклы при температурах внешних источников Т1 и Т2 , всегда меньше КПД и холодильного коэффициента обратимых тепловых машин, циклы в которых осуществляются между теми же внешними источниками:
< обр ; < обр .
Следствия принципа существования энтропии.
И
 зменение
энтропии всей системы может быть
подсчитано отдельно:
зменение
энтропии всей системы может быть
подсчитано отдельно:
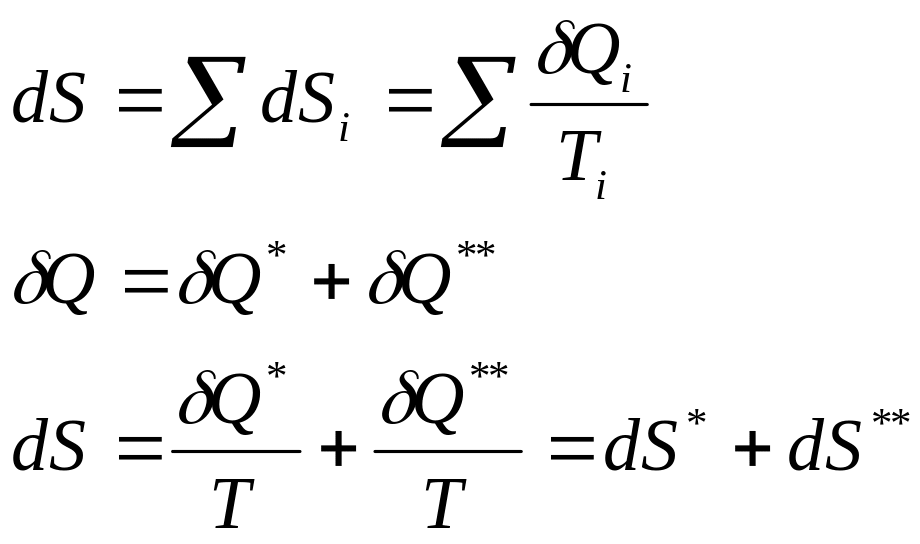
Площадь под графиком
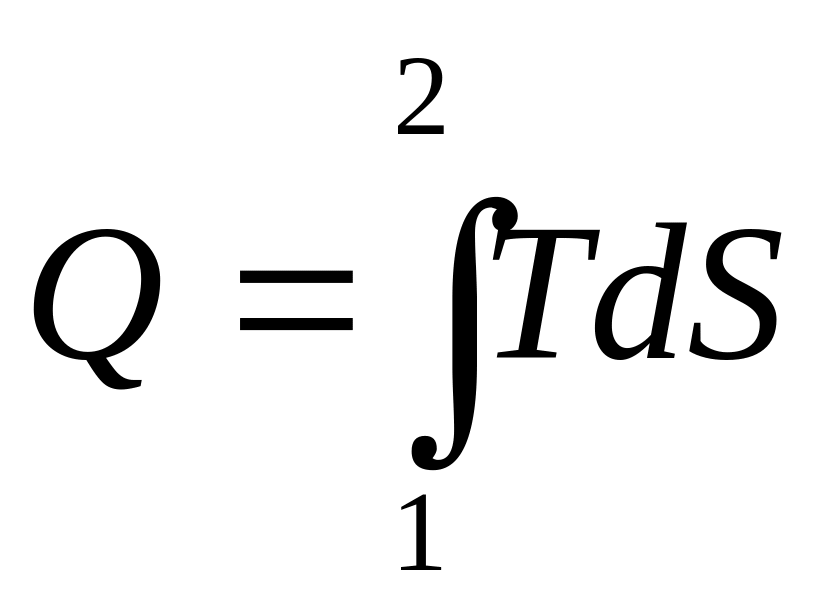 .
Если
,
то
.
Если
,
то
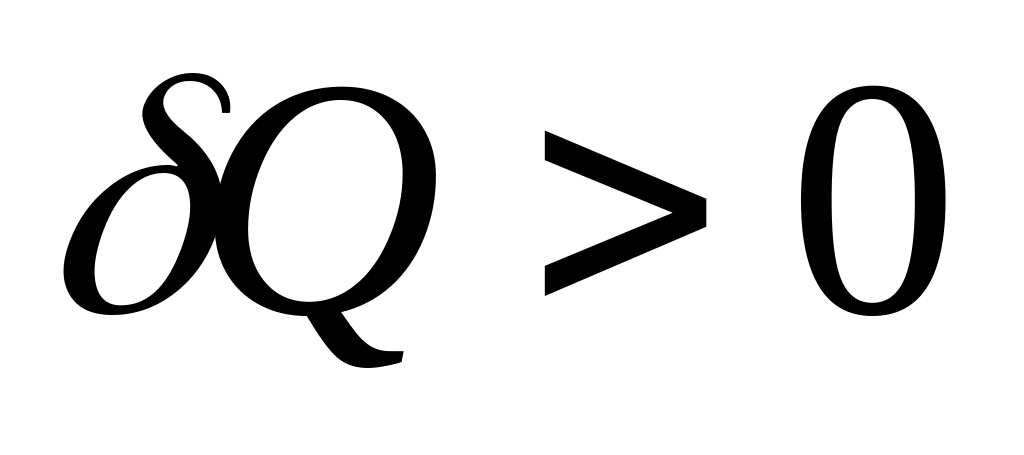 ,
если
,
если
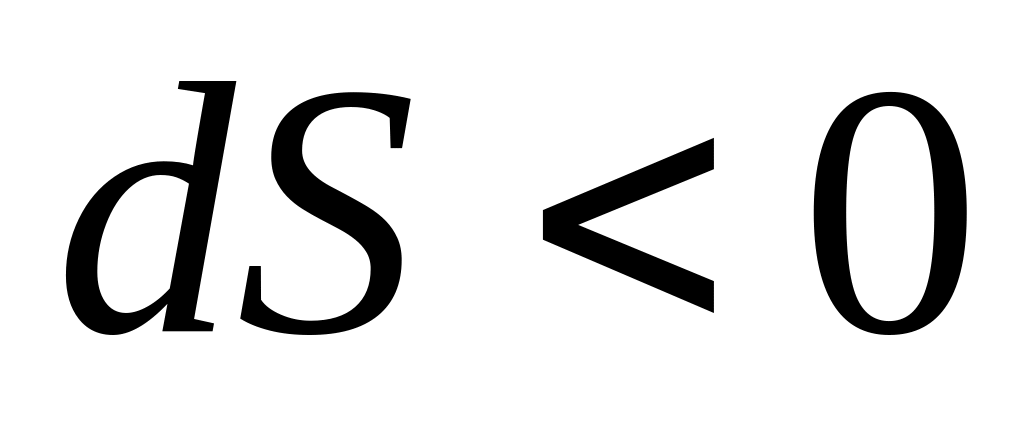 ,
то
,
то
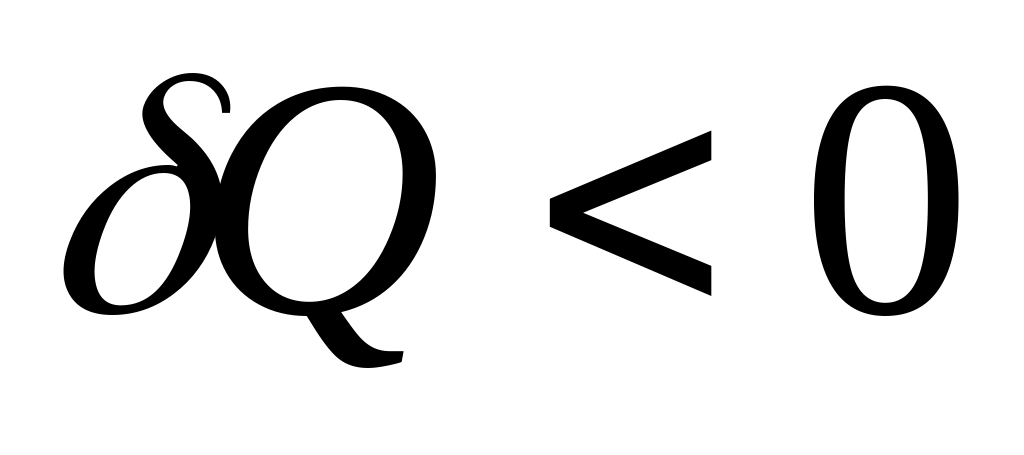 .
.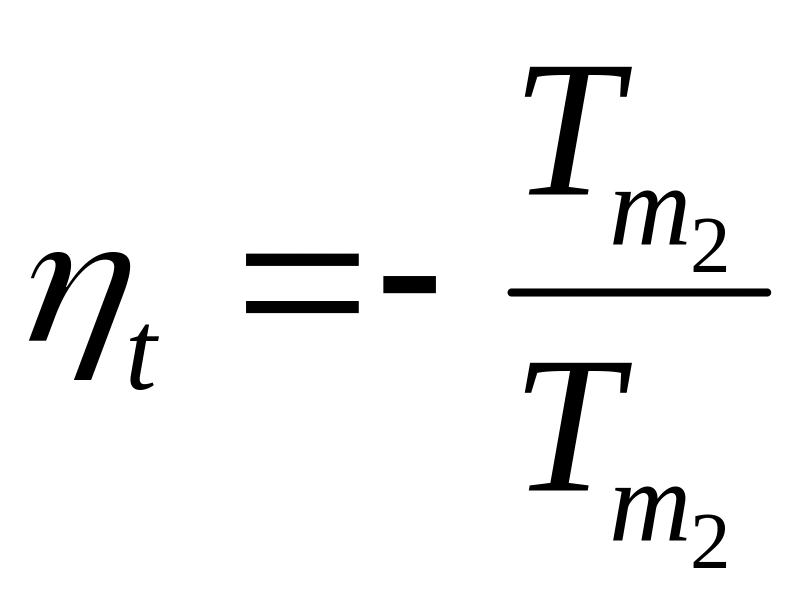
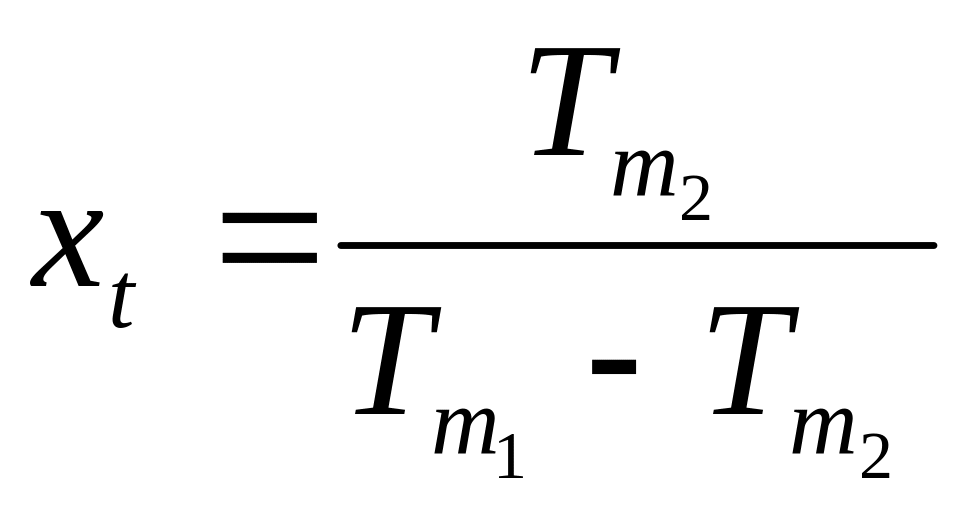
Математическое определение абсолютной температуры:
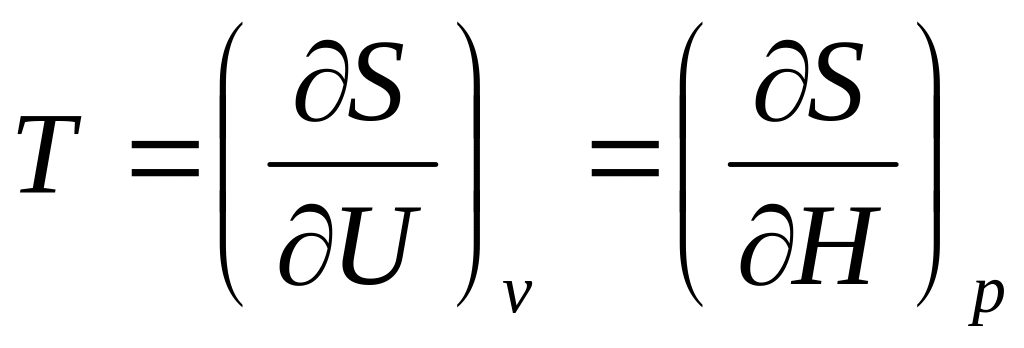 .
.
Принцип возрастания энтропии.
Работа может быть полностью превращена в теплоту: .
Принцип необратимости процессов в природе:
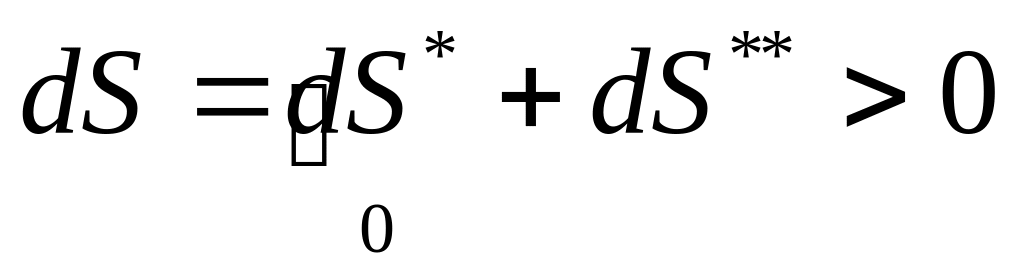 .
. .
.Абсолютная температура
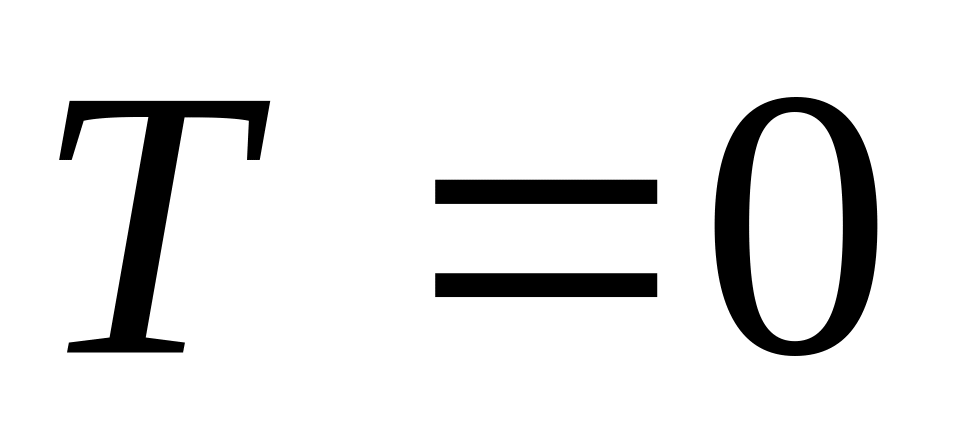 недостижима, так как
недостижима, так как
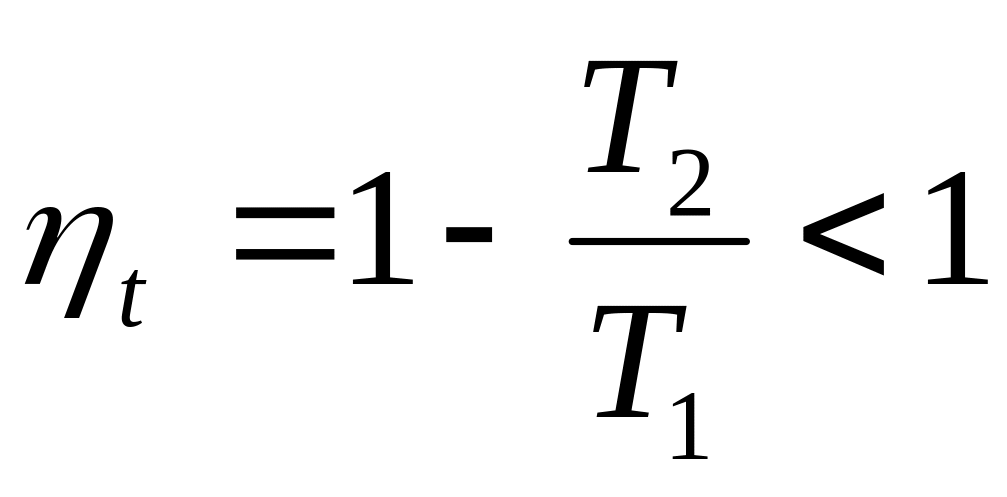 .
Так как
.
Так как
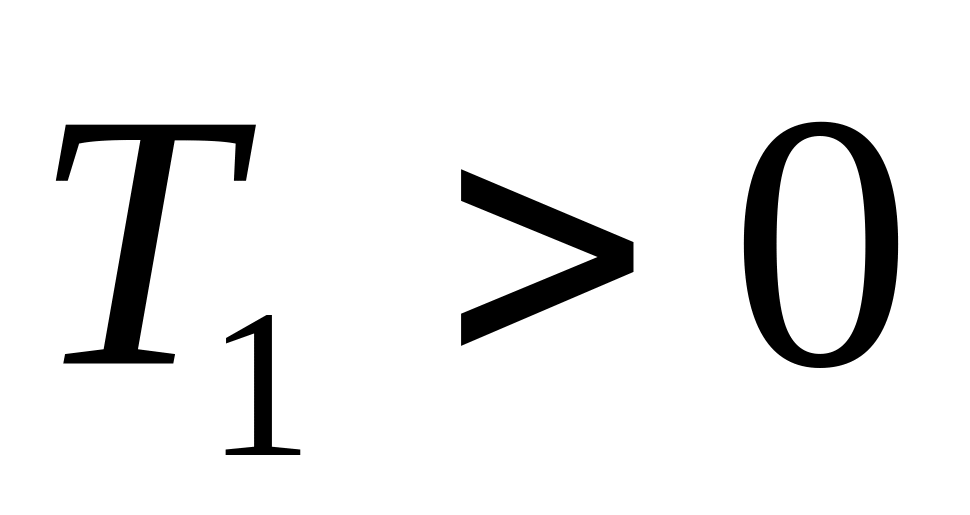 ,
то
,
то
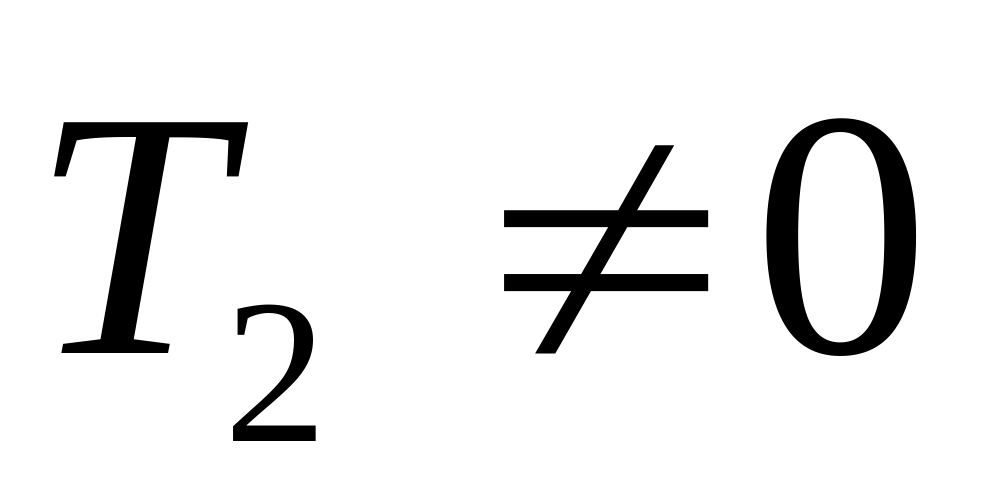 .
.
Вопрос №22
Смеси жидкостей, паров и газов.
Термодинамическая смесь – система, состоящая из химически невзаимодействующих друг с другом компонентов.
Состав
смеси задаётся либо массовой концентрацией
компонентов -
![]() ,
либо молярным составом -
,
либо молярным составом -
![]() (объёмный).
(объёмный).
![]() ,
где
,
где
![]() - масса одного компонента смеси,
- масса одного компонента смеси,
![]() - масса всей смеси.
- масса всей смеси.
![]()
![]()
![]() ,
где
,
где
![]() - число киломолей вещества,
- число киломолей вещества,
![]() - число киломолей смеси.
- число киломолей смеси.
![]()
Для
смеси нужно уметь определять среднюю
молекулярную массу
![]() и среднюю газовую постоянную
и среднюю газовую постоянную
![]() .
.
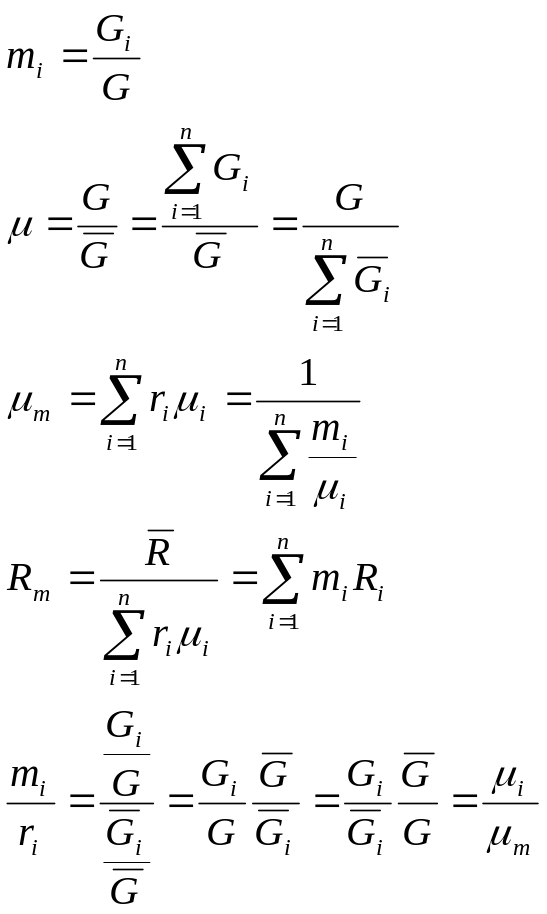
Если
смесь является идеальным газом, то
![]() .
.
Если
смесь является реальным газом, то
![]() .
.
Псевдокритические параметры:
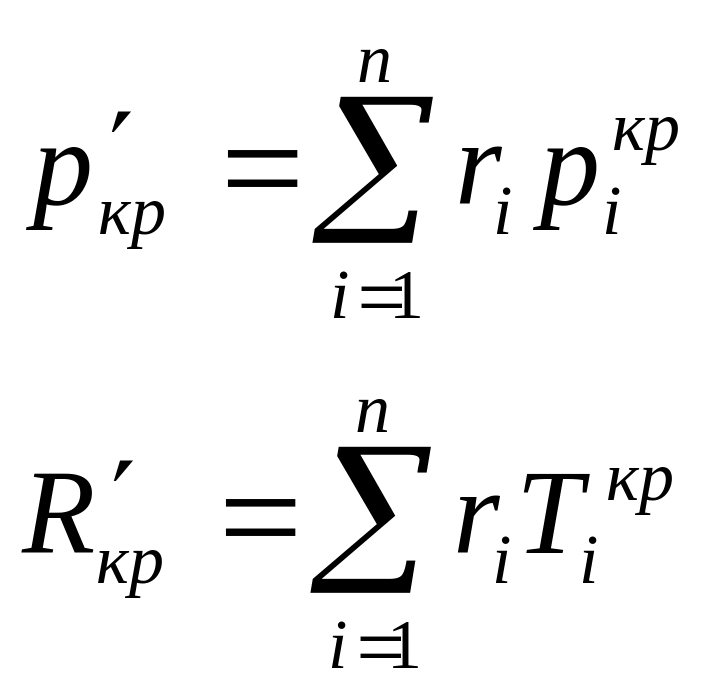
Схемы смешивания газов.
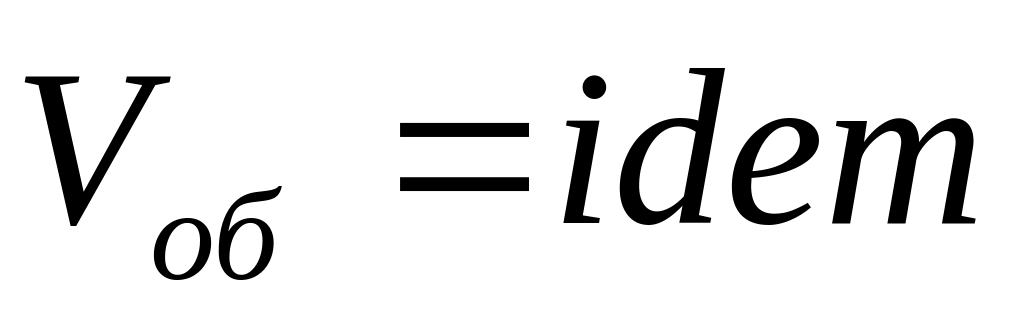 ,
следовательно
,
следовательно
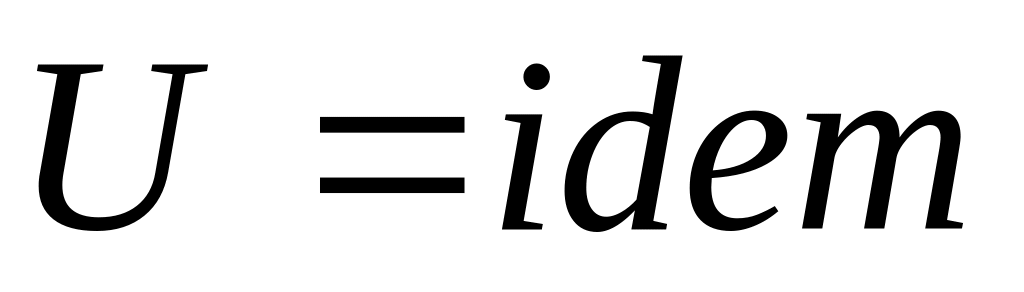 .
.
 ,
следовательно
.
,
следовательно
.

Закон Дальтона: давление смеси равно сумме парциальных давлений компонентов.
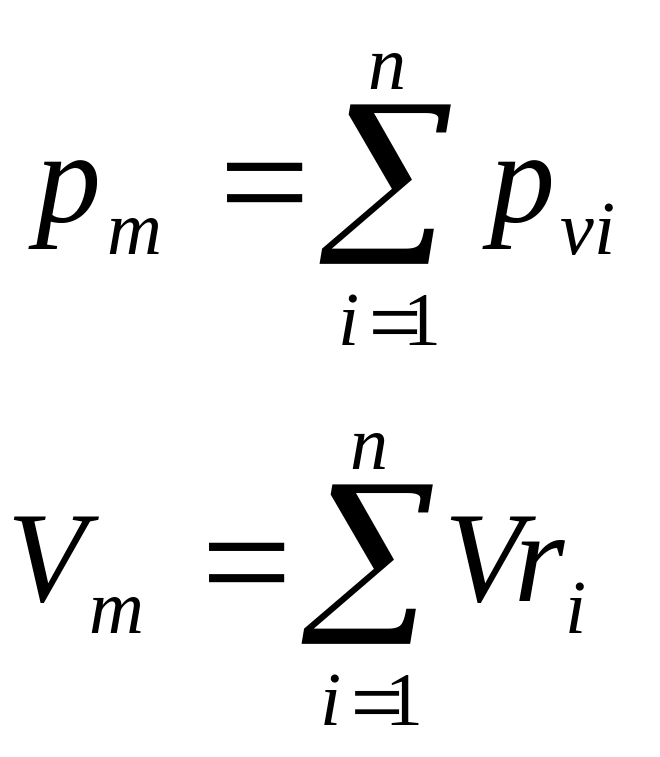
Парциальное давление.
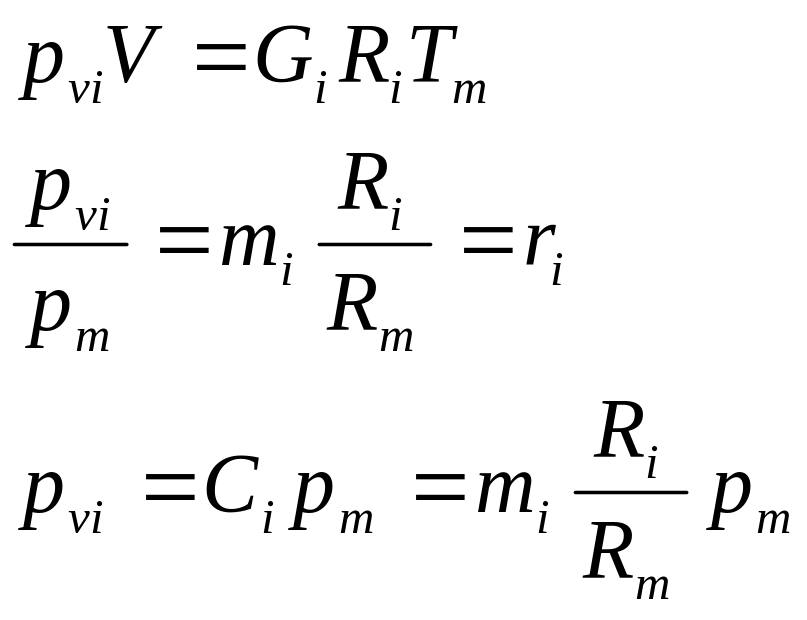
![]()
Вопрос № 23
