
- •Окислительно-восстановительное титрование Примерное содержание контрольной работы
- •1. Приготовление первичных стандартов
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •2. Стандартизация титранта
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •3. Расчет массы и массовой доли определяемого вещества в анализируемом растворе или образце
- •Примеры решения типовых задач Прямое титрование
- •Заместительное титрование
- •Обратное титрование
- •Задачи для самостоятельного решения
- •4. Кривые окислительно-восстановительного титрования
- •Титрование восстановителя
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
Контрольная работа № 11
Окислительно-восстановительное титрование Примерное содержание контрольной работы
1. Приготовление первичных стандартов.
2. Стандартизация титранта.
3. Расчет массы и массовой доли определяемого вещества в анализируемом растворе или образце.
4. Расчет точек на кривых титрования.
В основе окислительно-восстановительного титрования (редоксиметрии) лежат реакции окисления-восстановления.
Титрантами в методах редоксиметрии служат растворы окислителей и восстановителей. Чаще употребляются растворы окислителей в связи с их большей устойчивостью.
1. Приготовление первичных стандартов
Первичные стандарты можно приготовить из точных навесок стандартных веществ: возогнанного иода, дихромата калия, бромата калия.
Примеры решения типовых задач
Пример 1. Вычислите массу навески кристаллического иода для приготовления 2,000 л раствора с t(I2/S2–) = 0,001000 г/мл.
Дано: V(I2) = 2,000 л
t(I2/S2–) = 0,001000 г/мл
Найти: m(I2)
Решение. При титровании протекает реакция:
I2 + S2– 2 I– + S,
которой соответствуют полуреакции:
I2 + 2ē 2 I– ,
S2– - 2ē S.
fэкв.( I2) = 1/2 fэкв.( S2–) = 1/2
Рассчитываем молярную концентрацию эквивалента иода:
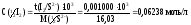
Рассчитываем массу навески иода:
m(I2) = C(1/2I2) · M(1/2I2) · V(I2) = 0,06238·126,90·2,000 = 15,83 г
Ответ: 15,83 г
Пример 2. В 1,000 л раствора растворено 4,9267 г К2Сr2О7. Определите титриметрический фактор пересчета К2Сr2О7 по железу (II).
Дано: m(К2Сr2O7) = 4,9267 г
V(К2Сr2О7) = 1,000 л
Найти: t(K2Cr2O7/Fe2+)
Решение. При титровании протекает реакция:
6 Fе2+ + Сr2О72– + 14 Н+ 6 Fе3+ + 2 Сr3+ + 7 Н2О,
которой соответствуют полуреакции:
Cr2O72– + 14 Н+ + 6ē 2 Сr3+ + 7 H2O,
Fe2+ – ē Fe3+
fэкв.(К2Сr2О7) = 1/6; fэкв.(Fе2+) = 1.
1 вариант. Определяем молярную концентрацию эквивалента К2Сr2О7:
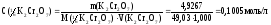
Вычисляем титриметрический фактор пересчета:
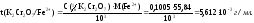
2 вариант. Определяем титр К2Сr2О7:
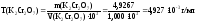
Вычисляем титриметрический фактор пересчета:
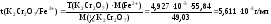
Ответ: 5,611∙10-3 г/мл
Пример 3. Методика анализа предусматривает использование раствора бромата калия с титриметрическим фактором пересчета по мышьяку(III) равным 3,750·10-3 г/мл. Приготовленный раствор содержит 0,6971 г бромата калия в 250,0 мл раствора. Вычислите поправочный коэффициент.
Дано: t(КВrO3/As3+) теор.= 3,750·10-3 г/мл
m(КВrO3) = 0,6971 г
V(КВrO3) = 250,0 мл =0,2500 л
Найти: F
Решение. При титровании протекает реакция:
3 As3+ + ВrO3– + 6 Н+ 3 As5+ + Вr– + 3 Н2О,
которой соответствуют полуреакции:
ВrO3– + 6 Н+ + 6ē Вr– + 3 H2O,
As3+ – 2ē As5+
fэкв.( КВrO3) = 1/6; fэкв.( As3+) = 1/2.
Определяем практический титриметрический фактор пересчета бромата калия по мышьяку(III):
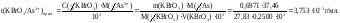
Вычисляем поправочный коэффициент F:

Ответ: 1,001
Задачи для самостоятельного решения
1. Вычислите массу навески дихромата калия для приготовления 250,0 мл раствора с С(1/6К2Сr2О7) = 0,1000 моль/л. Ответ: 1 ,226 г
2. Вычислите массу навески кристаллического иода для приготовления 250,0 мл раствора с концентрацией С(½I2) = 0,05000 моль/л. Ответ: 1,586 г
3. Вычислите массу навески иода для приготовления 500,0 мл раствора с титром по тиосульфату натрия 7,905·10-3 г/мл. Ответ: 3,173 г
4. Вычислите массу навески бромата калия для приготовления 200,0 мл раствора с t(КВrО3/Sb3+) = 6,088·10-3 г/мл. Ответ: 0,5566 г
5. Вычислите массу навески К2Сr2О7 для приготовления 1,000 л раствора, 1 мл которого соответствует 5,585 мг Fе2+. Ответ: 4,903 г
6. В растворе объемом 200,0 мл растворено 1,2534 г кристаллического иода. Рассчитайте титриметрический фактор пересчета иода по Аs(III). Ответ: 1,850∙10-3 г/мл
7. Навеску дихромата калия массой 0,6130 г растворили в воде и получили 250,0 мл раствора. Вычислите титр дихромата калия по железу (II). Ответ: 2,793∙10-3 г/мл
8. Навеску бромата калия массой 0,1395 г растворили в воде и получили 500,0 мл раствора. Вычислите титриметрический фактор пересчета бромата калия по олову (II).
Ответ: 5,949∙10-3 г/мл
9. Методика анализа предусматривает использование раствора дихромата калия с титриметрическим фактором пересчета по железу(II) 5,584∙10-3 г/мл. Приготовленный раствор содержит 0,9991 г дихромата калия в 200,0 мл раствора. Вычислите поправочный коэффициент.
Ответ: 1,019
10. Методика анализа предусматривает использование раствора иода с титриметрическим фактором пересчета по Аs(III) 1,873∙10-3 г/мл. Приготовленный раствор содержит 6,354 г I2 в 1,000 л раствора. Вычислите фактор пересчета. Ответ: 1,001
