
- •Окислительно-восстановительное титрование Примерное содержание контрольной работы
- •1. Приготовление первичных стандартов
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •2. Стандартизация титранта
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
- •3. Расчет массы и массовой доли определяемого вещества в анализируемом растворе или образце
- •Примеры решения типовых задач Прямое титрование
- •Заместительное титрование
- •Обратное титрование
- •Задачи для самостоятельного решения
- •4. Кривые окислительно-восстановительного титрования
- •Титрование восстановителя
- •Примеры решения типовых задач
- •Задачи для самостоятельного решения
Обратное титрование
Пример 3. Навеску образца, содержащего сульфат и сульфит натрия, массой 1,2415 г растворили в мерной колбе вместимостью 200,0 мл. К 20,00 мл полученного раствора добавили 25,00 мл раствора иода, С(I2) = 0,05000 моль/л. Избыток иода оттитровали раствором Na2S2O3, C(Na2S2O3) = 0,05114 моль/л. Вычислите массовую долю (%) сульфита натрия в образце, если на титрование затрачено 24,28 мл титранта.
Дано: m*= 1,2415 г
Vк = 200,0 мл
Vпип = 20,00 мл
V(I2) = 25,00 мл
С(I2) = 0,05000 моль/л
V(Nа2S2О3) = 24,28 мл
C(Na2S2O3) = 0,05114 моль/л
Найти: w%(Nа2SО3)
Решение. Сульфат натрия не реагирует с йодом, поэтому при анализе проходят следующие реакции:
I2 + 2ē 2 I– , fэкв.( I2) = ½
SO32– - 2ē SO42–. fэкв .( (Nа2SО3) = 1/2
SO32– + I2→ SO42– + 2 I–
Х Т1
I2 + 2ē 2 I– ,
2 S2O32– – 2ē → S4O62- fэкв (Nа2S2О3) = 1.
I2 + 2 S2O32– → 2 I– + S4O62–.
Т1 Т2
Используется обратное иодиметрическое титрование, метод пипетирования.
С(1/2I2) = 2С(I2) = 2∙0,05000=0,1000 моль/л

Вычисляем массовую долю сульфита натрия в образце:
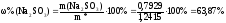
Ответ: 63,87%
Задачи для самостоятельного решения
1. Из 4,675 г раствора Н2О2 приготовили 500,0 мл раствора; на титрование 15,00 мл этого раствора в кислой среде расходуется 20,50 мл раствора перманганата калия, t(КMnО4/Н2О2) = 2,077∙10-3 г/мл. Определите массовую долю Н2О2 в образце. Ответ: 0,3036
2. Вычислите массу Н2О2 в растворе, на титрование которого в сернокислой среде было затрачено 12,75 мл раствора КМnО4 с молярной концентрацией С(КМnО4) = 0,02040 моль/л. Ответ: 0,02212 г
3. Навеску известняка массой 0,1584 г растворили в хлороводородной кислоте, кальций осадили в виде СаС2О4. Промытый осадок обработали разбавленной серной кислотой и оттитровали 22,75 мл раствора перманганата калия, Т(КМnО4) = 3,793∙10-3 г/мл. Вычислите массовую долю СаСО3 в известняке. Ответ: 86,25%
4. К раствору соли стронция добавили избыток щавелевой кислоты. Образовавшийся осадок отфильтровали, обработали разбавленной Н2SО4 и оттитровали 18,89 мл раствора КМnО4 с молярной концентрацией С(КМnО4) = 0,0222 моль/л. Вычислите массу ионов стронция в растворе. Ответ: 0,0919 г
5. Навеску препарата, содержащего МgО2, массой 0,1545 г обработали серной кислотой, выделившийся после протекания реакции
MgO2 + Н2SО4 МgSО4 + Н2О2
пероксид водорода оттитровали 18,25 мл раствора КМnО4, С(1/5КМnО4) = 0,1057 моль/л. Вычислите массовую долю пероксида магния в препарате. Ответ: 0,3515
6. Для определения содержания сероводорода в воде 100,0 мл воды оттитровали 0,01 моль/л I2 (F0,01 = 1,002). Вычислите массу сероводорода в 1,00 л воды, если на титрование затрачено 7,50 мл титранта. Ответ: 0,0128 г
7. Навеску образца, содержащего сульфит натрия и индифферентные примеси, массой 0,4415 г растворили в мерной колбе вместимостью 100,0 мл. К 20,00 мл полученного раствора добавили 25,00 мл раствора иода, С(I2) = 0,05000 моль/л. Избыток иода оттитровали раствором Na2S2O3, C(Na2S2O3) = 0,1000 моль/л. Вычислите массовую долю (%) сульфита натрия в образце, если на титрование затрачено 12,28 мл титранта. Ответ: 90,77%
8. К раствору соли железа (III) добавили серную кислоту и 10 мл 20% раствора иодида калия. Выделившийся иод оттитровали 13,75 мл раствора Na2S2O3, C(Na2S2O3)= 0,05770 моль/л. Вычислите массу железа (III) в растворе. Ответ: 0,04431 г
9. К 10,00 мл раствора сульфата меди (II) добавили 5 мл 1 моль/л Н2SО4, 2 г КI, 20 мл воды и оттитровали раствором тиосульфата натрия, C(Na2S2O3) = 0,1100 моль/л. На титрование затрачено 13,28 мл титранта. Вычислите массу меди (II) в 500,0 мл раствора. Ответ: 4,642 г
10. К смеси нитрита и хлорида натрия массой 0,1111 г добавили 20 мл 0,1 моль/л Н2SО4 и 20 мл 10% раствора иодида калия. Через 10 минут смесь оттитровали 13,33 мл раствора Na2S2O3 с концентрацией 0,0666 моль/л. Вычислите массовую долю (%) NaNO2 в смеси. Ответ: 55,1%
11. Пробу, содержащую соли свинца, массой 0,2764 г растворили в уксусной кислоте и обработали хроматом калия. Выделившийся осадок промыли, отфильтровали и растворили в хлорной кислоте, после чего добавили избыток КI. По истечении 10 минут смесь оттитровали 16,75 мл раствора тиосульфата натрия с молярной концентрацией С(Nа2S2О3) = 0,1005 моль/л. Вычислите массовую долю свинца в пробе. Ответ: 0,4206
12. Навеску кристаллогидрата хлорида бария массой 0,2793 г растворили в мерной колбе вместимостью 100,0 мл. К аликвотной доле объемом 25,00 мл добавили избыток хромата калия. Выделившийся осадок промыли, растворили в хлорной кислоте и обработали избытком иодида калия. Выделившийся иод оттитровали раствором тиосульфата натрия с молярной концентрацией 0,05009 моль/л. Определите состав кристаллогидрата, если на титрование затрачено 17,12 мл титранта.
Ответ: ВаСl2∙2Н2О
13. Навеску препарата, содержащего стрептоцид и индифферентные примеси, массой 0,3333 г растворили в 20 мл Н2SО4 (1:1), перенесли в мерную колбу вместимостью 100,0 мл, довели объем до метки водой и перемешали. В колбу для титрования отмерили 15,00 мл полученного раствора, добавили 15 мл 5% раствора КВr, индикатор метиловый оранжевый и оттитровали раствором КВrО3, С(КBrO3) = 0,01560 моль/л. Стрептоцид количественно бромируется по реакции:
Н2NС6Н4SО2NН2 + 2Вr2 Н2NС6Н2Вr2SО2NН2 + 2НВг.
Вычислите массовую долю стрептоцида в препарате, если на титрование затрачено 11,15 мл титранта.
Ответ: 0,8987
14. 15,00 мл раствора салицилата натрия перенесли в колбу для титрования с притертой пробкой. Прибавили 25,00 мл раствора КВrО3, С(1/6КВrO3) = 0,1010 моль/л, 1 г КВr и 5 мл 4 моль/л НСl. Смесь перемешали и оставили на 10 минут. После окончания реакции:
С6H4(ОН)СООН + 3Вг2 С6Н2Вr3ОН + СO2 + 3НВr
внесли в колбу 1 г КI и оставили в темноте на 10 мин. Выделившийся иод оттитровали 0,1120 моль/л раствором Na2S2O3, расход титранта 17,48 мл. Вычислите массу салицилата натрия в 100,0 мл раствора.
Ответ: 0,1009 г
15. Навеску препарата, содержащего стрептоцид и индифферентные примеси, массой 0,4382 г растворили в разбавленной соляной кислоте и оттитровали раствором нитрита натрия, С(NаNО2) = 0,1012 моль/л. Вычислите массовую долю стрептоцида Н2NС6Н4SО2NН2 в препарате, если на титрование затрачено 20,14 мл титранта. Ответ: 80,10%.
16. На титрование 10,00 мл раствора новокаина С13H20N2O3∙HСl в солянокислой среде затрачено 15,26 мл раствора нитрита натрия, С(NаNО2) = 0,1028 моль/л. Рассчитайте титр новокаина, если при титровании проходит реакция:
NН2С6H4С(O)OСН2СН2N(С2H5)2∙HСl + NаNО2 + HСl
Сl[N=NН2С6H4С(O)OСН2СН2N(С2H5)2] + NаСl + 2 H2O.
Ответ: 0,04279 г/мл
17. Навеску препарата, содержащего парацетамол и индифферентные примеси, массой 0,2217 г обработали при нагревании раствором соляной кислоты для прохождения реакции
(OH)С6H4NHСOСH3 + H2O НОС6Н4NН2 + СН3СООН.
Образовавшийся n-аминофенол оттитровали 12,23 мл 0,1102 моль/л NаNО2. Вычислите массовую долю парацетамола С8H9NO2 в препарате. Ответ: 0,9189
