
- •2. Общая характеристика р-элементы V группы.
- •1. Системa д.И.Менделеева
- •1. Гидролиз солей. Типы гидролиза. Обр н необр гидролиз
- •2. Марганец. Строение атома, со. Оксиды, гидроксиды, соли, перманганат калия.
- •1.Осн полож квант мех: корпускулярно-волновой дуализм, ур-ние Шредингера, принцип неопределённости Гейзенберга.
- •2.Общая хар р – эл-тов VII группы. Получ галогенов, их св-ва. Соед галогенов с водородом.
- •1.Метод вс. Типы геом форм молекул. Исп теории гибридизации для прогнозирования геометрической формы молекул.
- •2.Соед As, Sb, Bi (оксиды, гидроксиды, галогениды, сульфиды). Получ и св-ва
- •1. Растворы слабых электролитов. Константа ионизации. Ступенчатый характер ионизации. Смещение ионных равновесий в растворах слабых кислот и оснований.
- •2.Олово и свинец. Их хим активность. Гидроксиды, галогениды, сульфиды этих элементов. Свинцовый сурик.
- •1.Равновесие между р-ром и осадком малор-римого электролита. Константа р-римости (Кsp). Условия р-рения и обр осадков.
- •2.Пероксид водорода, получение и хим св-ва. Пероксикислоты серы и их соли
- •1. Термодинамические параметры. Внутренняя энергия и энтальпия. Первый закон термодинамики.
- •2.Кислородосодерж соед галогенов (оксиды к-ты соли). Получ и хим св-ва. Хлорная известь.
1. Растворы слабых электролитов. Константа ионизации. Ступенчатый характер ионизации. Смещение ионных равновесий в растворах слабых кислот и оснований.
В-ва, распадающиеся в р-рах или расплавах на ионы, называют электролитами, а процесс распада молекул на + и - заряженные ионы под действием р-рителя наз электролитической диссоциацией.
Слабые электролиты – это в-ва, которые лишь частично диссоциируют на ионы. Из неорг соед к ним относят: H2O, H2O2, некоторые кислоты, например, H2CO3, H2S, H2SiO3, H2SO3, HNO2, HClO, H3PO4, HCN, H3BO3. Силу электролита удобно характеризовать с помощью константы диссоциации. Это более общая количественная характеристика силы электролитов, чем степень диссоциации т: к как она не зависит от концентрации.
Диссоциацию слабого электролита АВ
АВ↔А++В-
Как всякий равновесный процесс можно охарактеризовать константой равновесия, называемой константой диссоциации:
Ка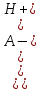 .
для осн Kb=
.
для осн Kb=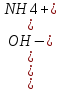
Слабые электролиты – в-ва, молекулы кот в р-рах ионизированы со степенью ионизации α <3%. К ним отн слабые кислоты и слабые основания.
Процесс ионизации обратим:
Константа ионизации показывает отношение частиц, диссоциирующих в р-р, к количеству непродиссоциировавшего вещества.
Ионизация слабого электролита — процесс равновесный: СН3СООН <± Н+ + СН3СОO-.
В отл от солей среди кислот и оснований есть и сильные и слабые электролиты. Большинство кислот и оснований — слабые электролиты. Ka и Kb зависят от природы, темп, но не зависят от конц в-ва.
Ионизация электролитов, основность и (или) кислотность которых более 1 происходит ступенчато:
I. H3PO4↔H++H2PO4-
Ка
I=
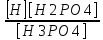
II. H2PO4-↔H++HPO42-
Ка
II=
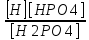
III. HPO42-↔H++PO43-
Ка
III=
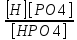
Диссоциация по каждой последующей ступени происходит в меньшей степени, чем по предыдущей.
Ка I > Ка II > Ка III Ka общ.= Ка I *Ка II *Ка III
Смещение ионных равновесий.
Равновесие в р-рах электролитов, как и всякое хим равновесие, сохр неизменным, пока определяющие его усл не меняются; изменение условий влечет за собой нарушение равновесия.
Так, равновесие наруш при изменении конц одного из участвующих в этом равновесии ионов: при ее увелич происходит процесс, в ходе которого эти ионы связываются. Напр, если в р-р ортофосфорной к-ты, диссоциирующей согласно уравнению H3PO4↔H++H2PO4- ввести какую-либо соль этой к-ты и тем самым увелич конц ионов, то, в соответствии с принципом Ле Шателье, равновесие смещается влево, т. е. степень дисс ортофосф к-ты уменьш. Отсюда следует, что введение в р-р слабого электролита одноименных ионов уменьшает степень диссоциации этого электролита. Наоборот, уменьш конц одного из ионов вызывает диссоциацию нового количества молекул. Например, при введении в р-р указанной кислоты гидроксид-ионов, связывающих ионы водорода, диссоциация кислоты возрастает.
Аналогично нарушается равновесие в случае малор-римого электролита: всякий раз, как только произведение концентраций ионов малор-римого электролита в р-ре превысит величину произведения растворимости, обр осадок. Так, если к насыщ р-ру сульфата кальция добавить другой, хорошо р-римый электролит, содержащий общий с сульфатом кальция ион, например, сульфат калия, то вследствие увеличения концентрации ионов SO42- равновесие сместится в сторону образования кристаллов CaSO4; ионы Ca2+ и SO42- будут удаляться из раствора, образуя осадок.
Процесс будет идти до тех пор, пока произведение концентраций этих ионов станет равно произведению растворимости. В итоге количество сульфата кальция в растворе уменьшится.
Таким образом, р-римость электролита уменьш от введения в р-р одноименных ионов. Исключением являются те случаи, когда происходит связывание одного из находящихся в растворе ионов с вводимыми ионами в более сложные (комплексные) ионы.
