
- •2. Общая характеристика р-элементы V группы.
- •1. Системa д.И.Менделеева
- •1. Гидролиз солей. Типы гидролиза. Обр н необр гидролиз
- •2. Марганец. Строение атома, со. Оксиды, гидроксиды, соли, перманганат калия.
- •1.Осн полож квант мех: корпускулярно-волновой дуализм, ур-ние Шредингера, принцип неопределённости Гейзенберга.
- •2.Общая хар р – эл-тов VII группы. Получ галогенов, их св-ва. Соед галогенов с водородом.
- •1.Метод вс. Типы геом форм молекул. Исп теории гибридизации для прогнозирования геометрической формы молекул.
- •2.Соед As, Sb, Bi (оксиды, гидроксиды, галогениды, сульфиды). Получ и св-ва
- •1. Растворы слабых электролитов. Константа ионизации. Ступенчатый характер ионизации. Смещение ионных равновесий в растворах слабых кислот и оснований.
- •2.Олово и свинец. Их хим активность. Гидроксиды, галогениды, сульфиды этих элементов. Свинцовый сурик.
- •1.Равновесие между р-ром и осадком малор-римого электролита. Константа р-римости (Кsp). Условия р-рения и обр осадков.
- •2.Пероксид водорода, получение и хим св-ва. Пероксикислоты серы и их соли
- •1. Термодинамические параметры. Внутренняя энергия и энтальпия. Первый закон термодинамики.
- •2.Кислородосодерж соед галогенов (оксиды к-ты соли). Получ и хим св-ва. Хлорная известь.
1.Равновесие между р-ром и осадком малор-римого электролита. Константа р-римости (Кsp). Условия р-рения и обр осадков.
В насыщ р-ре сильного малор-римого электролита устанавливается равновесие между осадком (тв.форма) и ионами электролита.
СаСО3 = Са2+(р)+ СО32-(р).
Кр (константа равновесия)=
(а(Са2+(р))*а(СО32-(р))/а(СаСО3(т)).
Где, а(Са2+(р)) и а( СО32-(р) – активные концентрации ионов Са2+ и СО32-.т.к. а(СаСО3(т)) – постоянна, т.е. произведение Кр*а(СаСО3(т)) при данной температуре, величина постоянная. Ksр = а(Са2+(р))*а(СО32-(р)). Произведение растворимости – постоянная величина при постоянной темп, характеризующая р-римость труднорастворимого электролита.
Для труднорастворимого электролита АmBn. Ksр(АmBn) = [A]m *[B]n,
([A]в степени m *[B] в степени n). Если в растворе произведение реальных конц ионов[A]m и [B]n (больше чем произведение растворимости при данной температуре то выпадет осадок). Чтобы растворить осадок нужно:
1) уменьшить в его насыщ р-ре концентрации соответствующих ионов, за счет вовлечения их в разные комплекс, либо путем изменения кислотности среды.
2)более полное связывание ионов.
3)за счет связывания ионов в слабый электролит.
4)за счет связывания ионов в малорастворимый комплекс.
Если ПКИ= Ksр, то равновесие
Если ПКИ< Ksр, осадок не выпадет
2.Пероксид водорода, получение и хим св-ва. Пероксикислоты серы и их соли
Пероксид водорода H2O2 — простейший представитель пероксидов. Бесцв жидкость с «металлическим» вкусом, неограниченно р-римая в воде, спирте и эфире. Конц водные р-ры взрывоопасны.
Пероксид водорода является хорошим р-рителем. получают гидролизом пироксидисерной к-ты и её солей: H2S2O8+2H2O=2H2SO4+H2O2 и окислением пропан-2-ола и других в-в. В р-ре Н2О2 проявляет слабо выраженные кислотные свойства (диссоциирует по двум ступеням): H2O2↔H++HO2-, реагирует с основаниями H2O2+LiOH=Li2O2+2H2O
Оба атома кислорода находятся в промежуточной СО −1, что и обуславливает способность пероксидов выступать как в роли ок-лей, так и восст-лей. Наиболее характерны для них ок-ные свойства: H2O2+2HI=I2+2H2O
При взаим-ии с сильными ок-лями Н2О2 выступает в роли в-ля, окисляясь до кислорода:
H2O2+Ag2O=2Ag+O2+H2O
Молекула H2O2 сильно полярна, что приводит к возникновению водородных связей между молекулами. Связь O—O непрочна, поэтому H2O2 — неустойчивое соед, легко разлагается.
Так же этому может поспособствовать присутствие ионов переходных ме. В разб р-рах пероксид водорода тоже неустойчив и самопроизвольно диспропорц на H2O и O2. Р-ция диспропорц катализируется Pt, MnO2, NaOH:
2H2O2=2H2O+O2
Однако очень чистый пероксид водорода устойчив.
Ок-ные св-ва H2O2 проявляет в р-ции с хлоридом хрома (III) в щелочной среде CrCl3+4NaOH=Na[Cr(OH)4]+3NaCl
2Na[Cr(OH)4]+3H2O2+2NaOH=2Na2CrO4+8H2O
А восст-ные – с перманганатом калия: 2KMnO=+3H2SO4+5H2O2=2MnSO4+5O2+K2SO4+8H2O
Известны следующие Пероксикислоты серы: H2SO5 – пероксомоносерная (к-та Каро) и H2S2O8- пероксидисерная (надсерная).
Перксидисерную к-ту в промыш получают электролизом серной кислоты. Электролизом конц р-ров гидросульфатов калия и аммония получают перксидисульфаты. Пероксомоносерную кислоту можно получить из хлорсульфановой кислоты и пероксида водорода: HOSO2Cl+H2O2=H2SO5+HCl, а также при обработке 100% H2S2O8 пероксидом водорода: H2S2O8+H2O2=2H2SO5
При гидролизе пероксикислот образуется пероксид водорода: H2S2O8+2H2O=2H2SO4+H2O2 на этой реакции основан промыш способ получения Н2О2.
Пероксисерные кислоты и пероксисульфаты сильные окислители:
K2S2O8+2Ag=Ag2SO4+K2SO4
2FeSO4+K2S2O8=Fe2(SO4)3+K2SO4
В отлич от Н2О2 в-ные св-ва для них не характерны.
Билет 8
1.Р-ры сильных электролитов. Понятие об активности ионов, коэффициенте активности, ионной силе раствора.
Электролиты — в-ва, образующие в растворах и расплавах ионы. К электролитам относят соли, кислоты и основания. Сильные электролиты в растворе полностью ионизированы:
НСl = Н+ + Сl; Ва(ОН)2 = Ва2+ + 2ОН.
Практически все соли относятся к сильным электролитам. Большинство кислот и оснований — слабые электролиты. К сильным относят некоторые кислоты элементов V—VII групп и все комплексные кислоты. В число оснований — сильных электролитов входят основания, образованные S-элементами I и II групп, и все комплексные основания. Коэффициент активности иона как величина, учитывающая взаимодействие ионов в растворе, определяется двумя факторами: зарядом ионов и концентрацией ионов.
Под активностью ионов понимают реальную концентрацию ионов, существующую в растворе. Активность ионов где C иона – истинная концентрация иона (моль/л), а γ – коэффициент активности, показывающий отклонение св-в данного раствора от идеального (в оч. разбавленных р-рах = 1). Ионная сила р-ра учитывает оба фактора (заряд и концентрацию ионов), от которых зависит коэффициент активности. Суммарное влияние различных ионов на его активность выражается с помощью ионной силы раствора. а(Х)=γС(Х), где γ-коэффициент активности, а(Х)- активность иона, С(Х)- аналитическая (расчётная) концентрация.
Закон действия масс становится применимым для описания реальных р-ров электролитов при условии использования во всех формулах активности ионов. Например, pH=-lg a(X), Kw=a(H+)*a(OH-). Коэффициент активности безразмерная величина, изменяющаяся в пределах γ≤1. зависит от концентрации ионов и их зарядов.
Оба
эти фактора учитываются в новом
показателе I, названном ионной
силой раствора.
I=1/2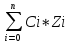 ²,
где I- ионная сила, z-заряд иона
²,
где I- ионная сила, z-заряд иона
Коэффициент активности уменьш с возрастанием ионной силы и заряда иона. Для теоретич расчёта коэффициента активности используется формула Дебая-Хюккеля: lg γ=-0.512z²*sqrt(I)
2.Соединения серы с водородом и кислородом (получение и св-ва). Тиосульфат натрия (строение, получение, свойства).
С водородом сера дает ряд соед, важнейшим из которых является Н2S.
Сероводород — бесцв газ с запахом протухших яиц и сладковатым вкусом. Плохо р-рим в воде, хорошо — в этаноле. Ядовит. При больших концентрациях разъедает многие металлы.
В лаб получают действием разб соляной к-ы на сульфид железа (II)
FeS+2HCl=H2S+FeCl2
Взаимодействие сульфида алюминия с водой (эта реакция отличается чистотой полученного сероводорода): Al2S3+6H2O=2Al(OH)3+3H2S
Физические свойства Термически устойчив. Молекула сероводорода имеет угловое строение, поэтому она полярна. В отличие от молекул воды, атомы водорода в молекуле не образуют прочных водородных связей, поэтому сероводород явл газом. Р-р сероводорода в воде — очень слабая сероводородная к-tа.
Химические свойства Сульфид водорода- сильный в-ль, сгорает с обр серы, диоксида серы, а в р-рах окисляется до серы и сульфат иона:
5H2S+2KMnO4+3H2SO4=5S+2MnSO4+K2SO4+8H2O
H2S+4Cl2+4H2O=H2SO4+8HCl
Реагирует со щелочами:
H2S+2NaOH=Na2S+H2O (обычная соль, при избытке NaOH)
H2S+NaOH=NaHS+H2O (кислая соль, при отношении 1:1)
На воздухе горит синим пламенем: 2H2S+3O2=2H2O+2SO2
при нед кислорода: 2H2S+O2=2S+2H2O (на этой р-ции основан промыш способ получения серы).
При взаимодействии полисульфидов (Na2Sn) с изб конц соляной кислоты обр маслянистая желтая жидкость, представляющая собой смесь сульфанов (полисероводородов) H2Sn. В структуре этих соед имеются гомоатомные цепи из атомов серы.
Известно несколько соед серы с кислородом; практическое значение имеют два – диоксид SO2 и триоксид SO3. Оксид серы(IV) — SO2. В н. у. бесцв газ с характерным резким запахом (запах загорающейся спички). Под давлением сжижается при комн темп. Р-ряется в воде с обр нестойкой сернистой кислоты; р-римость 11,5 г/100 г воды при 20 °C, снижается с ростом темп. Р-ряется также в этаноле, серной кислоте.
Получение: Промыш способ получения — сжигание серы или обжиг сульфидов, в основном — пирита: 4FeS2+11O2=2Fe2O3+8SO2
В лаб и в природе SO2 получают воздействием сильных кислот на сульфиты и гидросульфиты. Образующаяся сернистая кислота H2SO3 сразу разлагается на SO2 и H2O: Na2SO3(тв.)+H2SO4=Na2SO4+SO2+H2O
Также диоксид серы можно получить действием конц серной кислоты на малоактивные металлы при нагревании: Cu+2H2SО4=CuSO4+SO2+2H2O
При сгорании серы или обжиге природных сульфидов: S+O2=SO2
2ZnS+3O2=2ZnO+2SO2
Химические свойства:
Относится к к-ным оксидам. В водном р-ре устанавливается равновесие SO2+H2O↔H2SO3
Со щелочами образует сульфиты: 2NaOH+SO2=Na2SO3+H2O
Хим активность SO2 весьма велика. Наиболее ярко выражены вос-ные св-ва SO2, CO серы в таких р-циях повышается: SO2+Br2+2H2O=H2SO4+2HBr
При каталитическом окислении V2O5: 2SO2+O2=2SO3
Диоксид серы может проявлять свойства восстановителей SO2+Cl2=SO2Cl2
2Na2SO3+O2=2Na2SO4 и окислителей SO2+2H2S=3S+2H2O
При нагр сульфиты различных ме разлагаются следующим образом:
4Na2SO3=Na2S+3Na2SO4
ZnSO3=ZnO+SO2
2Ag2SО3=4Ag+2SO2+O2
В присутствии сильных во-лей SO2 способен проявлять ок-ные св-ва. Напр, для изв серы из отходящих газов металлургич промыш используют вос-ние SO2 оксидом углерода(II): SO2+2CO=2CO2+S
Или для получения фосфорноватистой кислоты: PH3+SO2=H3PO2+S
Оксид серы (VI) SO3 — высший оксид серы, тип хим связи: ковалентная полярная. В обычн усл легколетучая бесцв жидкость с удушающим запахом. При темп ниже 16,9 °C застывает с обр смеси различных кристаллических модификаций твёрдого SO3.
Получение: термическим разложением сульфатов: Fe2(SO4)3=Fe2O3+3SO3
Для окисления SO2 используют также NO2: SO2+NO2=SO3+NO
Химические свойства:
1.Кислотно-основные: SO3 — типичный кислотный оксид, ангидрид серной кислоты. Его хим активность достаточно велика.
SO3 р-ряется в 100%-й серной кислоте, образуя олеум: H2SO4+SO3=H2S2O7
2.Окислительно-восстановительные: SO3 характеризуется сильными ок-ными св-вами, восстанавливается, обычно, до сернистого ангидрида: 5SO3+2P=P2O5+5SO2, 3SO2+H2S=4SO2+H2O, 2SO3+2KI=SO2+I2+K2SO4
3. При взаим-ии с хлоридом водорода получается хлорсерная кислота. SO3+HCl=HOSO2Cl это дымящаяся на воздухе жидкость. Разлагается водой со взрывом: HOSO2Cl+H2O=H2SO4+HCl
Также взаим-ет с двухлористой серой и хлором, образуя тионилхлорид: SO3+Cl2+2SCl2=3SOCl2
При нагревании разлагается: 2SO3=2SO2+O2
Тиосульфат натрия — Na2S2O3, соль натрия и тиосерной кислоты, образует кристаллогидрат Na2S2O3•5H2O.
Получение: окислением полисульфидов Na кислородом воздуха или сульфитов серой S + Na2SO3 →(t) Na2S2O3;
взаимодействием H2S и SO2 с NaOH: 4SO2 + 2H2S + 6NaOH → 3Na2S2O3 + 5H2O;
кипячение избытка серы с гидроксидом натрия: 4S + 6NaOH → 2Na2S + Na2S2O3 + 3H2O
2Na2S2+3O2=2Na2S2O3
При подкислении р-ра тиосульфата натрия выделяется неустойчивая тиосерная кислота, Которая легко разлагается Na2S2O3+2HCl=2NaCl+S+SO2+H2O
Свойства: Бесцв моноклинные кристаллы. Молярная масса 248,17 г/моль (пентагидрат).
Р-рим в воде (41,2 % при 20 ̊С, 69,86 % при 80оС).
При 48,5 °C плавится в своей кристаллизационной воде, обезвоживается около 100 ̊С.
При нагр до 220 °C распадается по схеме: 4Na2S2O3 →(t) 3Na2SO4 + Na2S5; Na2S5 →(t) Na2S + 4S
Тиосульфат натрия сильный восстановитель:
С сильными ок-лями, напр, свободным хлором, окисляется до сульфатов или серной кислоты:
Na2S2O3 + 4Cl2 + 5H2O → 2H2SO4 + 2NaCl + 6HCl.
Более слабыми или медленно действующими ок-лями, напр, йодом, переводится в соли тетратионовой кислоты:
2Na2S2O3 + I2 → 2NaI + Na2S4O6.
Выделить тиосерную кислоту (тиосульфат водорода) реакцией тиосульфата натрия с сильной кислотой невозможно, так как она неустойчива и тут же разлагается:
Na2S2O3 + H2SO4 → Na2SO4 + H2S2O3
H2S2O3 → H2SO3 + S
Билет 9
1.Колич хар-ки гидролиза (степень, константа). Формулы, примеры. Влияние различных факторов на степень гидролиза. Количественные характеристики гидролиза (степень гидролиза, константа гидролиза). Вывод формул, примеры. Влияние различных факторов на степень гидролиза солей.По наличию или отсутствию электрической проводимости растворы веществ делят на электролиты – проводящие электрический ток, и неэлектролиты – не проводящие электрический ток.
Гидролиз — обменное взаимодействие между ионами соли и водой.
1)
Степень гидролиза. В
р-ре устанавливается равновесие между
солью и образующими её к-той и осн. Доля
в-ва, подвергающаяся гидролизу – степень
гидролиза-
зависит от константы этого равновесия,
а также от темп и конц соли. Запишем
ур-ние гидролиза в общем виде:
MA+H2O=HA+MOH. Этому равновесию отвечает
константа: K=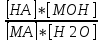 . Конц воды представляет собой практически
постоянную величину K*[H2O]=Kг,
Кг=
. Конц воды представляет собой практически
постоянную величину K*[H2O]=Kг,
Кг=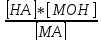
Кг- константа гидролиза соли. Её значение характеризует способность данной соли подвергаться гидролизу: чем больше Кг, тем в большей степени протекает гидролиз.
Если соль обр сильн к-той и слаб осн, то Кг=Кw/Косн.. поэтому чем слабее осн, тем в большей степени подвергаются гидролизу образованные им соли.
Если соль обр слаб к-той и сильн осн, то Кг=КH2O/Ккисл
Для солей, обр слаб осн и слаб к-той Кг=КH2O/Косн*Ккисл
2) Kг (Кр) – константа гидролиза, выводимая на основании закона действующих масс применительно ионного уравнения.
Природа в-ва.
Концентрация соли: степень гидролиза увелич с уменьшением конц соли, что связано с увеличением конц воды. Повышение темп усиливает гидролиз, т.е. это процесс эндотермический.
2.Углерод. Аллотропия, типы гибридизации. Оксиды углерода. Угольная кислота и ее соли Углерод химический элемент IV-ой группы главной подгруппы II-го периода периодической системы Менделеева, порядковый номер 6 Аллотропные модификации углерода Кристаллический углерод: Алмаз, Графен, Графит, Карбин Аморфный углерод: Активированный уголь, Древесный уголь, Ископаемый уголь, Кокс каменноугольный, нефтяной и др., Стеклоуглерод, Техуглерод, Сажа, Углеродная нанопена.
Для атома углерода возможно три типа гибридизации: sр3-гибридизация, sр2-гибридизация, sр-гибридизация.
Гибридные орбитали атома углерода способны участвовать в образовании только g(сигма)-связей, незатронутые гибридизацией р-орбитали образуют только п - связи.
sp3 гибридизация характерна для алмаза, предельных углеводородов, тетрахлорметана и других. Sp2- для графита, ароматических углеводородов, этилена, карбонат иона. Sp-гибридное состояние характерно для карбина, СО2б CS2, углеводородов, содержащие тройные связи.
Химические свойства При обычн темп углерод химически инертен, при достаточно высоких соединяется со многими элементами, проявл сильные восст-ные св-ва. Хим активность разных форм углерода убывает в ряду: аморфный углерод, графит, алмаз, на воздухе они воспламеняются при температурах соответственно выше 300—500 °C, 600—700 °C и 850—1000 °C.
Степени окисления +4 (напр., CO2), −4 (напр., CH4), редко +2 (СО, карбонилы металлов), +3 (C2N2). Продукты горения углерода в кислороде являются CO и CO2.
Углекислый газ реаг с водой, образуя слабую угольную кислоту — H2CO3, которая образует соли — карбонаты.
Графит с галогенами, щел ме и др. в-вами обр соед включения. При пропускании электрич разряда между угольными электродами в атмосфере азота образуется циан.
При р-ции углерода с серой получается сероуглерод CS2, известны также CS и C3S2. С большинством ме углерод обр карбиды, напр: 4Al+3C=Al4C3, Ca+2C=CaC2
Важна в промыш р-ция углерода с водяным паром: C+H2O=CO+H2.
При нагр углерод вос-ет оксиды ме до ме. Данное св-во широко исп в металлургич промыш.
Оксиды углерода — бинарные хим соед (оксиды) углерода с кислородом. Наиболее известны два: монооксид углерода CO (угарный газ), Диоксид углерода CO2 (углекислый газ)
Оксид углерода(II) СО— бесцв ядовитый газ (при н.у.) без вкуса и запаха.
Получение: 2C+O2=2CO, CO2+C=2CO
СO соединяется со многими ме, образуя карбонилы ме, напр, Fe(CO)5, Ni(CO)4
Оксид углерода(IV) — CO2, бесцв газ (в н.у.), без запаха, со слегка кисловатым вкусом.
В промыш кол-вах углекислота выделяется из дымовых газов, или как побочный продукт хим процессов, напр, при разложении природных карбонатов (известняк, доломит) или при производстве алкоголя. Смесь получ газов, промывают р-ром карбоната к, котор поглощ углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагр или при пониженном давлении разлагается, высвобождая углекислоту. CaCO3=CaO+CO2
Оксид углерода(IV) не поддерживает горения. Только некоторые активные ме горят в нем, так как отнимают кислород: 2Mg + CO2 = 2MgO + C
При р-рении в воде образует угольную кислоту: CO2 + H2O ↔ H2CO3
Реаг со щелочами с обр карбонатов и гидрокарбонатов: Ca(OH)2+CO2=CaCO3↓+H2O,
KOH + CO2 → KHCO3
Угольная к-та — слабая двухосновная к-та с химической формулой Н2СО3 . В чистом виде неустойчива. Образуется в малых кол-вах при р-рении углекислого газа в воде. Образует ряд устойчивых неорг и орг производных: соли (карбонаты и гидрокарбонаты), сложные эфиры, амиды и др.
Получение: Угольная кислота образуется при р-рении в воде диоксида углерода: CO2+H2O=CO2*H2O=H2CO3
при взаимодействии её солей с более сильной к-той. При этом большая часть образовавшейся угольной кислоты, как правило, разлагается на воду и диоксид углерода: Na2CO3+2HCl=2NaCl+H2CO3
Химические свойства: Угольная к-та подвергается обратимому гидролизу, создавая при этом кислую среду: H2CO3+H2O=HCO3-+H3O+
Угольная к-та существует в водных растворах в состоянии равновесия с гидратом диоксида углерода:
Карбонаты и гидрокарбонаты — соли и эфиры H2CO3. Среди солей известны нормальные карбонаты (с анионом СО32−) и кислые или гидрокарбонаты (с анионом НСО3−).
При нагр кислые карбонаты переходят в нормальные карбонаты: 2NaHCO3=Na2CO3+H2O+CO2
При сильном нагр норм карбонаты разлаг на оксиды и углекислый газ: Na2CO3=Na2O+CO2
Карбонаты реаг с к-тами сильнее угольной (почти все известные кислоты, включая органические) с выделением углекислого газа: Na2CO3+2HCl=2NaCl+CO2+H2O
NaHCO3+HCl=NaCl+H2O+CO2
Р-ры карбонатов щел ме вследствие гидролиза имеют сильно щелочную среду.
Из солей угольной кислоты в природе распространён CaCO3, он встречается в виде мела, мрамора, известняка.
Na2CO3 - сода, в виде кристаллогидрата отвечает формуле Na2CO3*10H2O.
Билет 10
