
- •2. Общая характеристика р-элементы V группы.
- •1. Системa д.И.Менделеева
- •1. Гидролиз солей. Типы гидролиза. Обр н необр гидролиз
- •2. Марганец. Строение атома, со. Оксиды, гидроксиды, соли, перманганат калия.
- •1.Осн полож квант мех: корпускулярно-волновой дуализм, ур-ние Шредингера, принцип неопределённости Гейзенберга.
- •2.Общая хар р – эл-тов VII группы. Получ галогенов, их св-ва. Соед галогенов с водородом.
- •1.Метод вс. Типы геом форм молекул. Исп теории гибридизации для прогнозирования геометрической формы молекул.
- •2.Соед As, Sb, Bi (оксиды, гидроксиды, галогениды, сульфиды). Получ и св-ва
- •1. Растворы слабых электролитов. Константа ионизации. Ступенчатый характер ионизации. Смещение ионных равновесий в растворах слабых кислот и оснований.
- •2.Олово и свинец. Их хим активность. Гидроксиды, галогениды, сульфиды этих элементов. Свинцовый сурик.
- •1.Равновесие между р-ром и осадком малор-римого электролита. Константа р-римости (Кsp). Условия р-рения и обр осадков.
- •2.Пероксид водорода, получение и хим св-ва. Пероксикислоты серы и их соли
- •1. Термодинамические параметры. Внутренняя энергия и энтальпия. Первый закон термодинамики.
- •2.Кислородосодерж соед галогенов (оксиды к-ты соли). Получ и хим св-ва. Хлорная известь.
1. Термодинамические параметры. Внутренняя энергия и энтальпия. Первый закон термодинамики.
Основной характеристикой системы является состояние. Важнейшими функциями состояния являются U внутренняя энергия системы, Н- энтальпия системы, S энтропия системы, G-энергия Гиббса. Рассмотрим первые две функции состояния.
Внутренняя энергия – это часть всей энергии системы, не связанная с кинетически энергией. Она представляет собою сумму энергий движения молекул, энергии химических связей, энергии не ковалентных взаимодействий, межъядерного взаимодействия. Даже неполное перечисление составляющих показывает, что учесть все факторы, определяющие её величину невозможно. Следовательно, нельзя опр и абсолютную величину внутренней энергии системы. Поэтому для характеристики состояния системы используют функцию ΔU=U2-U1, где ΔU- внутреннее изменение энергии системе при переходе из состояния 1 в состояние 2, U2, U1 внутренняя энергия системы в состояния 1 и 2.
Энтальпия системы. Для опред энтальпии системы р-рим изменение энергии системы происходящие в процессе нагревания газа при постоянном давлении (изобарный процесс) и постоянном объёме (изохорный процесс). Для анализа протекающих в системах процессов используем первый закон термодинамики: внутренняя энергия изолированной системы, независимо от протекающих в ней процессов остаётся постоянной. (закон сохранения энергии). Обратимся к более реальным системам, для которых возможен обмен с окружающей средой. В случае этих систем подводимое к системе тепло расходуется на увеличение внутренней энергии системы и работу против внешних сил: Q=ΔU+A, где Q-подводимое к системе тепло, А - работа против внешних сил. Применим первое начало термодинамики для опред энтальпии системы. В качестве модели исп систему на рисунке.
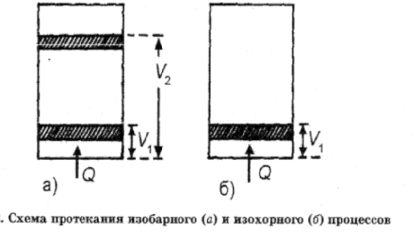
Газ в цилиндре нагревается за счёт подводимого тепла Q, и в случае изобарного процесса поршень свободно передвигается, а в случае изохорного процесса поршень закреплён. Работа газа при расширении равна A=p(V2-V1). Следовательно, Q=U2-U1+p(V2-V1)=(U+pV2)-(U1+PV1). Величины (U+pV2) и (U1+PV1) представляют новую функцию состояния, которую называют энтальпией. H=U+pV. Энтальпия системы представляет собой сумму внутренней энергии системы и произведения давления на объём, она имеет размерность энергии.
В изобарном процессе подводимое тепло расходуется на увеличение энтальпии системы. Из определения величины энтальпии видно, что абсолютная величина энтальпии вычислена быть не может.
Для характеристики системы используют изменение энтальпии при переходе из одного состояния в другое: ΔH=H2-H1. Размерность энтальпии кДж. В случае изохорного процесса, работа против внешних сил будет равняв 0. Подводимое к системе тепло будет расходоваться на увеличение внутренней энергии системы.
2.Кислородосодерж соед галогенов (оксиды к-ты соли). Получ и хим св-ва. Хлорная известь.
Все кислородные соед галогенов получены косвенным путем. Наиболее устойчивы соли, наименее — оксиды и кислоты. Для галогенов характерно обр большого числа оксидов, отвечающих различным СО. ионы BrO-2 и IO-2 неустойчивы. Больше всего устойчивых оксидов образует хлор Сl, меньше всего — йод I.
Из соединений кислорода с фтором существует фторид кислорода OF2: Связь между атомами фтора и кислорода ковалентная, очень близка к неполярной. Это бесцв газ с резким запахом озона, плохо р-рим в воде, t кипения= 145°С.Получается взаимодействием фтора с 2% -ным р-ром гидроксида натрия:
2F2+2NaOH=2NaF+Н2О+F2O
Р-рим важнейшие из кислородных соед остальных галогенов. Все оксиды неустойчивы, разлагаются с большим выделением тепла.
Оксид хлора (I) Сl2О — газ буро-желтого цвета с неприятным запахом. Характеризуется низкой темп кип, относительная плотность по воздуху равна 3. Связь в молекуле оксида малополярная ковалентная.
Химические св-ва:
1. При нагр легко распадается (со взрывом) на хлор и кислород: 2Сl2O=Сl2+О2
2. Будучи к-ным оксидом, гидратируется с обр хлорноватистой кислоты: Сl2O+Н2O=2НСlO
3. Взаим-ет с щелочами и основными оксидами:
Сl2O+2NaOH=2NaClO+Н2O Сl2O+K2O=2KСlO
Оксиду хлора (I) соответствует хлорноватистая кислота. Хлорноватистая кислота НСlO и ее бромный и йодный аналоги — очень слабые к-ты, причем их сила уменьш при переходе от НСlO к НIO. Это объясняется тем, что хлор обладает большей эо и сильнее своих аналогов притягивает электронную пару, связывающую его с кислородом. Это в свою очередь приводит к смещению электронной пары, связывающей водород с кислородом, к кислороду и увеличению способности водорода к отщеплению.
Хлорноватистая к-та представляет собой р-р желто-зеленого цвета с характерным запахом. Она и ее аналоги обладают всеми св-вами слабых летучих к-т, явл ок-лями. Причем ок-ная активность в ряду НСlO, НBrO, НIO снижается.
1. На свету хлорноватистая кислота разлагается:
НСlO = НСl+О
2. При действии водоотнимающих средств распадается: 2НСlO=Сl2O+Н2О
3. При нагревании хлорноватистой к-ты образуется соляная и хлорноватая кислоты:
3НСlО=2НСl+НСlO3
Наибольшее значение имеют соли кислородных кислот хлора. Все их можно получить, исходя из реакции взаимодействия хлора с водой.
Сl2+Н2О=НСl+НСlO
Равновесие этой р-ции легко сместить в сторону продуктов р-ции, добавив в р-р щелочи, которая реагирует с двумя образующимися кислотами:
НСl+НСlO+2КОН=КСl+КСlO+2Н2O I Просуммировав эти два уравнения, получим: Сl2+2КОН=КСl+КСlO+Н2O
Соли хлорноватистой кислоты называют гипохлоритами. Водный р-р, содерж гипохлорит и хлорид калия, называют жавелевой водой. Она, как и хлорная (раствор хлора в воде) вода, употребляется для беления хлопчатобумажной ткани и бумаги. Механизм окисляющего и дезинфицирующего действия хлорноватистой к-ты и ее солей объясняют наличием хлора со степенью окисления +1, проявляющего в этих процессах активные ок-ные св-ва.
Гипохлориты — очень сильные ок-ли. При пропускании хлора в р-р щелочи, нагретый до 100°С, процесс протекает с обр хлоратов (солей хлорноватой кислоты НСlO3) и хлоридов:
ЗСl2+6КОН=5КСl+КСlO3+3Н2O
При нагр до 400°С в отсутствие катализаторов из хлоратов образуются перхлораты (соли хлорной кислоты НСlO4): 4КСlO3=3КСlO4+КСl
В присутствии катализатора (MnO2) процесс протекает по уравнению: 2КСlO3=2КСl+3O2
Таким образом, соли кислородных к-т хлора получают взаимодействием хлора с щелочью. При этом при комн темп обр гипохлориты, при 100°С — хлораты. Это ОВР.
Хлористая кислота НСlО2 — средней силы. Она малоустойчива в водных р-рах, а ее аналоги брома и йода еще менее прочны. Сила кислородных к-т хлора возрастает с ростом СО центрального атома: НСlO — слабая; НСlO2 — несколько более сильная; НСlO3 — очень сильная и НСlO4 — самая сильная из всех известных кислот.
Если хлор взаимодействует с гидроксидом кальция, который берется в виде порошка — пушонки, то обр хлорная, или белильная, известь — рыхлый белый порошок с запахом хлора. Она состоит главным образом из гипохлорита кальция Са(СlO)2, основных солей кальция и хлорида кальция.
Примерное уравнение:
2Сl2+2Са(ОН)2=Са(СlO)2+СаСl2+2Н2О
Часто для повышения качества хлорной извести к ней добавляют Са(СlO)2. Хлорная известь — сильный ок-ль. Она очень реакционноспособна. Применяется для беления хлопчатобумажных тканей, бумаги, для хлорирования воды, дезинфекции, а также для дегазации местности, зараженной стойкими отравляющими в-вами.
Белящие и дезинфицирующие свойства хлорной извести аналогичны свойствам жавелевой и хлорной воды: угольная кислота вытесняет из гипохлорита кальция хлорноватистую кислоту; на свету она разлагается с выделением атомарного кислорода, который и оказывает окисляющее действие.
