
Лекция 3 Кристаллизации металлов.
Из химической термодинамики следует, что фаза – это совокупность гомогенных частей термодинамической системы, одинаковых по составу и свойствам вне зависимости от массы.
Фазовые превращения (переходы) в чистых металлах бывают двух типов: I и II рода.
При фазовых переходах I рода энтальпия (теплосодержание) Н и удельный объем изменяются скачком при температуре перехода (Рис 2.1а).
Разницу в энтальпии двух фаз Н при температуре перехода называют теплотой фазового превращения. В металловедении к переходам I рода относят плавление, кристаллизацию и полиморфные превращения.
Рис. 2.1 а. б.
При фазовых переходах второго рода скачкообразного изменения энтальпии и удельного объема в точке превращения не происходит (Рис 2.1б). К фазовым превращениям второго рода в металлах относят магнитное превращение: переход из ферромагнитного состояния в парамагнитное и обратный переход при охлаждении. Температуру перехода при в этом случае называют точкой Кюри (см.с на рис. 2б).
При переходе через точку Кюри кристаллическая решетка не меняется. Выше температуры Кюри у парамагнетика при отсутствии внешнего магнитного поля собственные магнитные моменты атомов имеют хаотическую пространственную ориентацию – ферромагнетик становиться парамагнетиком.
Рассмотренное магнитное превращение происходит в железе (С = 769oC) , никеле, кобальте и в некоторых редкоземельных металлах.
Поскольку магнитное не превращение не сопровождается изменением типа кристаллической решетки и не связано с диффузионным перемещением атомов, температура Кюри не зависит от скорости охлаждения (и нагрева).
Когда в материаловедении говорят о фазовых превращениях, не указывая, какого они рода, то имеют в виду фазовые переходы I рода.
Именно они и являются предметом нашего разговора на сегодняшней лекции.
При подводе теплоты к металлическому кристаллу возрастает энергия колебательного движения атомов и повышение концентрации точечных дефектов (вакансий и межузельных атомов). По достижении критической концентрации этих дефектов при определенной температуре исчезает кристаллическая решетка. Некоторое время подводимая теплота затрачивается на разрыв межатомных связей во всем объеме. В это время твердая и жидкая фазы сосуществуют, температура не повышается и на кривой нагрева в координатах «температура – время» видна площадка при Т0 (рис. 2.3).
Рис 2.3.
Кривая нагрева
чистого металла
Перегрев кристаллов выше Т0 в обычных условиях никогда не наблюдается. В отличие от кристаллизации, которая всегда идет при большем или меньшем переохлаждении Т0 (температуры плавления). Т.е. плавленипе кристаллов начинаеися с их поверхности при Т0.
(Подумайте над этим положением и объясните его: почему процесс начала кристаллизации требует определенной степени переохлаждения системы, которая не является, кстати, постоянной величиной, а процесс плавления не нуждается в перегреве относительно точки равновесия энергий жидкой и твердой фазы).
Любое вещество может находиться в трех агрегатных состояниях: твердом, жидком, газообразном. Возможен переход из одного состояния в другое, если новое состояние в новых условиях является более устойчивым, обладает меньшим запасом энергии.
Жидкое состояние металла по большинству характеристик ближе к твердому, чем к газообразному. Металлический пар (если он не ионизирован) – изолятор между его атомами действуют только ванн-дер-вальсовы связи. В жидком металле, как и в твердом, валентные электроны коллективизированы и основной тип связи здесь металлический.
Поэтому значения электропроводности жидкого и твердого металлов различаются относительно слабо.
Качественное отличие жидкого металла от кристаллического состояния состоит в отсутствии дальнего порядка, который характеризуется строго определенным периодическим расположением атомов по узлам кристаллической решетки.
В расплаве имеется ближний порядок – упорядоченное расположение атомов вокруг произвольно выбранного атома на расстояниях, соизмеримых с межатомными.
Количестве6нными характеристиками ближнего порядка являются наиболее вероятное кратчайшее расстояние и среднее число ближайших соседей (координационное число).
С повышением температуры расплава среднее координационное число уменьшается, и ближний порядок постепенно размывается.
Реальный металлический расплав не является гомогенным. В нем в тончайшей взвеси находятся высокодисперсные частицы тугоплавких металлов (оксиды, карбиды, нитриды), перешедшие в расплав из шихты или образовавшиеся при взаимодействии расплава со стенками плавильной печи. Эти дисперсные частицы в расплаве, оказывают сильное влияние на формирование структуры слитка и отливок при кристаллизации.
Сам процесс кристаллизации связан с изменением свободной энергии системы.
G = H -TS
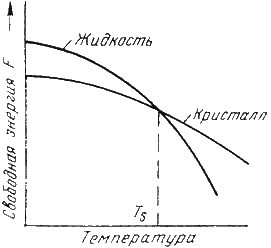
С изменением внешних условий свободная энергия изменяется по сложному закону различно для жидкого и кристаллического состояний. Характер изменения свободной энергии жидкого и твердого состояний с изменением температуры показан на рис. 3.1.
G
 T
T
Рис.3.1. Изменение свободной энергии в зависимости от температуры
В соответствии с этой схемой выше температуры ТS вещество должно находиться в жидком состоянии, а ниже ТS – в твердом.
G = -Gоб + Gпов или,
G = -Vgоб + F .,
Где F –площадь поверхности раздела; - межфазная энергия Гиббса единицы поверхности.
При температуре равной ТS жидкая и твердая фаза обладают одинаковой энергией, металл в обоих состояниях находится в равновесии, поэтому две фазы могут существовать одновременно бесконечно долго. Температура ТS – равновесная или теоретическая температура кристаллизации.
Для начала процесса кристаллизации необходимо, чтобы процесс был термодинамически выгоден системе и сопровождался уменьшением свободной энергии системы. Это возможно при охлаждении жидкости ниже температуры ТS.
Температура, при которой практически начинается процесс кристаллизации, называется фактической температурой кристаллизации.
Охлаждение
жидкости ниже равновесной температуры
кристаллизации называется переохлаждением,
которое характеризуется степенью
переохлаждения
(![]() ):
):
![]()
Степень переохлаждения зависит от природы металла, от степени его загрязненности (чем чище металл, тем больше степень переохлаждения), от скорости охлаждения (чем выше скорость охлаждения, тем больше степень переохлаждения).
Возникает вопрос, откуда берется энергия, необходимая для образования кристаллического зародыша. Считается, что в расплаве из-за хаотического теплового движения всегда существуют группы атомов, кинетическая энергия которых может быть как больше, так и меньше средней величины, характерной для данной температуры. Отклонение энергии от среднестатического значения называют флуктуацией энергии.
Кинетический зародыш образуется там, где участок расплава размером не меньше критического обладает повышенной энергией не ниже определенного уровня.
Его размер определяется зависимостью:
акр = 4/(gоб)2
Обычная степень переохлаждения металлов при кристаллизации в производственных условиях находится в пределах от 10 до 300С; при больших скоростях охлаждения она может достигать сотен градусов.
При плавлении металла, как правило, как мы отметили ранее, не требуется перегрев для начала процесса расплавления.
Рассмотрим переход металла из жидкого состояния в твердое.
При нагреве всех кристаллических тел наблюдается четкая граница перехода из твердого состояния в жидкое. Такая же граница существует при переходе из жидкого состояния в твердое. (Особенности начала превращения в том и другом случае мы рассмотрели).
Кристаллизация – это процесс образования участков кристаллической решетки в жидкой фазе и рост кристаллов из образовавшихся центров.
Кристаллизация протекает в условиях, когда система переходит к термодинамически более устойчивому состоянию с минимумом свободной энергии.
При изучении процесса кристаллизации используют термический анализ с построением кривых охлаждения в координатах «температура – время». Вид кривой охлаждения зависит от скорости охлаждения (рис.2-11).
Процесс перехода металла из жидкого состояния в кристаллическое можно изобразить кривыми в координатах время – температура. Кривая охлаждения чистого металла представлена на рис. 3.2.

Рис.3.2. Кривая охлаждения чистого металла
![]() –
теоретическая
температура кристаллизации;
–
теоретическая
температура кристаллизации;
![]() .
– фактическая
температура кристаллизации.
.
– фактическая
температура кристаллизации.
Процесс кристаллизации чистого металла:
До точки 1 охлаждается металл в жидком состоянии, процесс сопровождается плавным понижением температуры. На участке 1 – 2 идет процесс кристаллизации, сопровождающийся выделением тепла, которое называется скрытой теплотой кристаллизации. После окончания кристаллизации в точке 2 температура снова начинает снижаться, металл охлаждается в твердом состоянии.
Механизм и закономерности кристаллизации металлов.
При соответствующем понижении температуры в жидком металле начинают образовываться кристаллики – центры кристаллизации или зародыши. Для начала их роста необходимо уменьшение свободной энергии металла, в противном случае зародыш растворяется.
Минимальный размер способного к росту зародыша называется критическим размером, а зародыш – устойчивым.
Кривые охлаждения
Рис 2.11.
Переход из жидкого состояния в кристаллическое требует затраты энергии на образование поверхности раздела между жидкой и твердой образующейся фазами. Процесс кристаллизации будет осуществляться, когда выигрыш от перехода в твердое состояние больше потери энергии на образование поверхности раздела. Зависимость энергии системы от размера зародыша твердой фазы представлена на рис. 3.3.
Зародыши с размерами равными и большими критического размера растут с уменьшением энергии и поэтому способны к существованию.
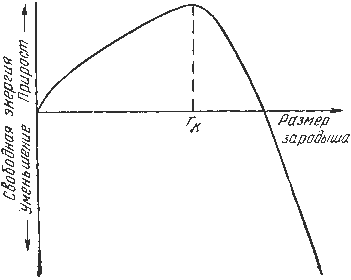
Рис.3.3. Зависимость энергии системы от размера зародыша твердой фазы
Механизм кристаллизации представлен на рис.3.4.

Рис.3.4. Модель процесса кристаллизации
Центры кристаллизации образуются в исходной фазе независимо друг от друга в случайных местах.
Сначала кристаллы имеют правильную форму, но по мере столкновения и срастания с другими кристаллами форма нарушается. Рост продолжается в направлениях, где есть свободный доступ питающей среды. После окончания кристаллизации имеем поликристаллическое тело.
Качественная схема процесса кристаллизации может быть представлена количественно кинетической кривой (рис.3.5).
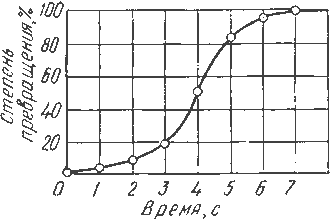
Рис. 3.5. Кинетическая кривая процесса кристаллизации
Процесс вначале ускоряется, пока столкновение кристаллов не начинает препятствовать их росту.
Объем жидкой фазы, в которой образуются кристаллы - уменьшается. После кристаллизации 50 % объема металла, скорость кристаллизации будет замедляться.
Таким образом, процесс кристаллизации состоит из образования центров кристаллизации и роста кристаллов из этих центров.
В свою очередь, число центров кристаллизации (ч.ц.) и скорость роста кристаллов (с.р.) зависят от степени переохлаждения (рис. 3.6).
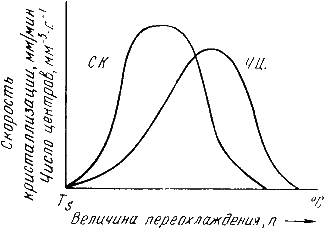
Рис. 3.6. Зависимость числа центров кристаллизации (а) и скорости роста кристаллов (б) от степени переохлаждения
Рассмотренный механизм кристаллизации относится к так называемому гомогенному зарождению кристаллов – флуктационному зарождению зародышей в случайных участках чистого расплава.
В реальных расплавах такое зародышеобразование происходит крайне редко, т.к. для зарождения кристаллов всегда имеются готовые поверхности - стенки литейной формы и взвешенные в расплаве частицы разной природы.
Размеры образовавшихся кристаллов зависят от соотношения числа образовавшихся центров кристаллизации и скорости роста кристаллов при температуре кристаллизации.
При равновесной температуре кристаллизации ТS число образовавшихся центров кристаллизации и скорость их роста равняются нулю, поэтому процесса кристаллизации не происходит.
Если жидкость переохладить до температуры, соответствующей т.а, то образуются крупные зерна (число образовавшихся центров небольшое, а скорость роста – большая).
При переохлаждении до температуры соответствующей т.в – мелкое зерно (образуется большое число центров кристаллизации, а скорость их роста небольшая).
Если металл очень сильно переохладить, то число центров и скорость роста кристаллов равны нулю, жидкость не кристаллизуется, образуется аморфное тело.
Рост кристаллов (самостоятельно). Рассмотреть два механизма роста кристаллов, который зависит от атомного строения границы раздела кристалл – жидкость. Используют представление о двух крайних типах этого строения – атомно-гладкой и атомно-шероховатой границе.
