
Министерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
Санкт-Петербургский Государственный Горный университет

Кафедра минералогии, кристаллографии и петрографии
Геохимия
Реферат
Тема: U-Pb радиогенные изотопные системы
Выполнила студентка: гр. МГП-09 _________________ /Хлыстун Е.С/
Проверил: Проверил доцент: __________________ /м.В Морозов./
(подпись) (Ф.И.О.)
Санкт-Петербург
2011 год
Содержание
Общая информация об изотопах …………………………………………………..3
Распространенность элементов и их изотопов…………………………………..5
Применение изотопных отношений для определения абсолютного возраста………………………………………………………..……………………………..7
Список используемой литературы
Общая информация об изотопах
Уран — очень тяжёлый, серебристо-белый глянцеватый металл. В чистом виде он немного мягче стали, ковкий, гибкий, обладает небольшими парамагнитными свойствами.
Уран может проявлять степени окисления от +III до +VI. Соединения урана(III) образуют неустойчивые растворы красного цвета и являются сильными восстановителями:
4UCl3 + 2H2O → 3UCl4 + UO2 + H2↑
Соединения урана(IV) являются наиболее устойчивыми и образуют водные растворы зелёного цвета.
Соединения урана(V) неустойчивы и легко диспропорционируют в водном растворе:
2UO2Cl → UO2Cl2 + UO2
Химически уран очень активный металл. Быстро окисляясь на воздухе, он покрывается радужной пленкой оксида. Мелкий порошок урана самовоспламеняется на воздухе, он зажигается при температуре 150—175 °C, образуя U3O8. При 1000 °C уран соединяется с азотом, образуя жёлтый нитрид урана. Вода способна разъедать металл, медленно при низкой температуре, и быстро при высокой, а также при мелком измельчении порошка урана. Уран растворяется в соляной, азотной и других кислотах, образуя четырёхвалентные соли, зато не взаимодействует с щелочами. Уран вытесняет водород из неорганических кислот и солевых растворов таких металлов, как ртуть, серебро, медь, олово, платина и золото. При сильном встряхивании металлические частицы урана начинают светиться. Уран имеет четыре степени окисления —III—VI. Шестивалентные соединения включают в себя триокись урана (окись уранила) UO3 и хлорид уранила (уранилхлорид) UO2Cl2. Тетрахлорид урана UCl4 и диоксид урана UO2 — примеры четырёхвалентного урана. Вещества, содержащие четырёхвалентный уран, обычно нестабильны и обращаются в шестивалентные при длительном пребывании на воздухе. Ураниловые соли, такие как уранилхлорид, распадаются в присутствии яркого света или органики.
Природный уран состоит из смеси трёх изотопов: 238U (изотопная распространённость 99,2745 %, период полураспада T1/2 = 4,468×109 лет), 235U (0,7200 %, T1/2 = 7,04×108 лет) и 234U (0,0055 %, T1/2 = 2,455×105 лет). Последний изотоп является не первичным, а радиогенным, он входит в состав радиоактивного ряда 238U. Радиоактивность природного урана обусловлена в основном изотопами 238U и 234U, в равновесии их удельные активности равны. Удельная активность изотопа 235U в природном уране в 21 раз меньше активности 238U. На данный момент известно 23 искусственных радиоактивных изотопа урана с массовыми числами от 217 до 242. Наиболее долгоживущий из них — 233U (T1/2 = 1,59×105лет) получается при облучении тория-232 нейтронами и способен к делению под
воздействием тепловых нейтронов.
Изотопы урана 238U и 235U являются родоначальниками двух радиоактивных рядов. Конечными элементами этих рядов являются изотопы свинца 206Pb и 207Pb.
Свинец — Свинец мягок, пластичен, легко прокатывается в тончайшие листы, сравнительно легкоплавкий металл, серого цвета.
В хим. отношении свинец довольно инертен. Стандартный электродный потенциал свинца — 0,1265 В для Рb0/Рb2+. В сухом воздухе не окисляется, во влажном-тускнеет, покрываясь пленкой оксидов, переходящей в СО2 в основной карбонат 2РbСО3·Рb(ОН)2. Скислородом свинец образует ряд оксидов: Рb2О, РbО (глет), РbО2, Рb3О4 (сурик) и Рb2О3 . При комнатной температуре свинец не реагирует с разбавленной серной и соляной кислотами, так как образующиеся на его поверхности труднорастворимые пленки PbSO4 и РbС12 препятствуют дальнейшему растворению металла.
Имеет степени окисления +2 и +4 свинец может проявлять металлические и неметаллические свойства
Уран-торий-свинцовый метод. Радиоактивный распад урана и тория в стабильные
изотопы свинца долгое время (до появления самарий-неодимового метода)
рассматривался в качестве стандарта, с которым сравнивались данные других методов.
(рис.1). Вместе с тем это один из наиболее сложных методов в изотопной
геохронологии. В уран-ториевой изотопной системе существует три независимых
семейства радиоактивного распада:
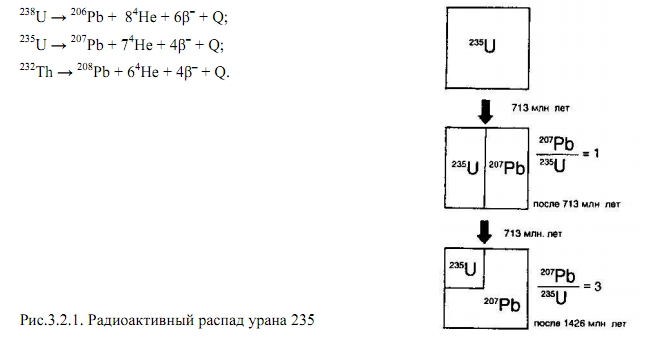
Рис 1. Радиоактивный
распад урана 235
Распад каждого радиоактивного изотопа порождает длинный ряд промежуточных
продуктов распада и заканчивается стабильным изотопом свинца. [Короновский Н.В.
, 1988 г.]
Первичные радионуклиды 238U, 235U в процессе радиоактивных превращений образуют длинные цепочки переходящих друг в друга радионуклидов - радиоактивные ряды распада, или радиоактивные семейства. Конечными продуктами распада всех рядов являются изотопы свинца. При изучении достаточно медленно идущих процессов можно пренебречь сравнительно короткоживущими промежуточными членами рядов и рассматривать упрощенные системы: 238U - 206Pb, 235U - 207Pb. Основные параметры этих систем следующие:
Таблица 1
Материнский нуклид М |
Содержание, % от суммы изотопов |
Период полураспада, годы |
Константа распада, годы |
Дочерний нуклид D |
238U |
99,2743 |
4,468 · 109 |
1,55125 · 10-10 |
206Pb |
235U |
0,7200 |
0,7038 · 109 |
9,8485 · 10-10 |
207Pb |
Отношение 238U/ 235U постоянно и равно 137,88 (за единственным исключением урановых руд). Поэтому изотопный анализ урана заменяют определением его общего содержания. Помимо радиогенных изотопов 206Рb, 207Рb и 208Рb в природе существует еще один стабильный изотоп свинца: 204Рb. Концентрация 204Рb не меняется во времени, и его считают нерадиогенным.[Титаева Н.А, 2000 г.]
Свинец располагается в группе IIб Периодической системы и является халькофильным элементом. Наиболее распространенный его минерал - галенит PbS. Однако свинец может проявлять и литофильные свойства. Благодаря большому ионному радиусу (RPb2+ = 1,20 Å), он может замещать калий (RK+ = 1,33 Å) в калиевых полевых шпатах и кальций (RCa2+ = 0,99 Å) в плагиоклазах. Первый вариант предпочтительнее. Свинец не может входить в решетки циркона, урановых и ториевых минералов в связи с большой разницей зарядов ионов и разницей ионных радиусов. Свинец, содержащийся в неизмененных позднейшими процессами минералах этих элементов, в основном радиогенного происхождения.
