
- •Первое начало термодинамики.
- •В более точном виде
- •Работа газа при изменении его объема.
- •Теплоемкость.
- •Применение первого начала изопроцессов.
- •При изохорном процессе газ не совершает работы над внешними телами
- •Круговой процесс. Обратимые и необратимые процессы.
- •Энтропия, ее статическое толкование и связь с термодинамической вероятностью. Второе и третье начала термодинамики.
- •Реальные газы. Силы и потенциальная энергия межмолекулярного взаимодействия.
- •Считается, что сила отталкивания есть положительная сила, т.Е. Больше нуля, а сила притяжения – отрицательная сила, т.Е. Меньше нуля.
- •Из данной потенциальной кривой следует, что система из двух взаимодействующих молекул в состоянии устойчивого равновесия обладает минимальной энергией.
Применение первого начала изопроцессов.
1) Изохорный процесс (V = const).
При изохорном процессе газ не совершает работы над внешними телами
dA = PdV,
поэтому dQ = dU, а для произвольной массы газа
![]()
2) Изобарный процесс (P = const).
При изобарном процессе работа газа при увеличении объема от V1 до V2

Использовав уравнение Менделеева-Клапейрона для двух состояний
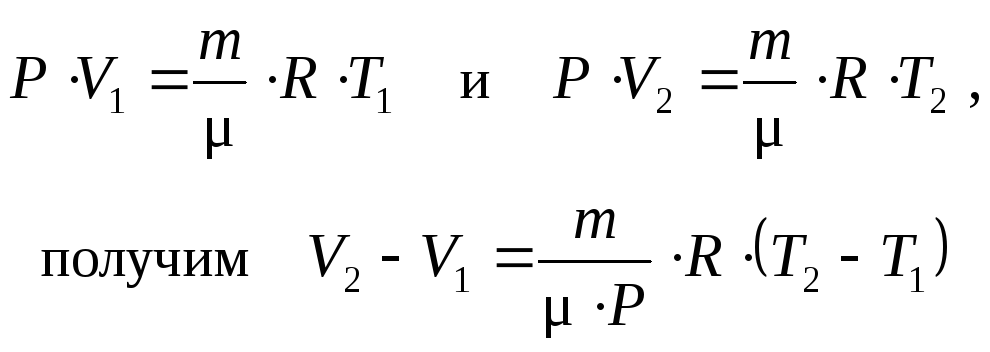
При этом газ совершает работу
![]()
Из (1) вытекает физический смысл молярной газовой постоянной R: если разница температур равна 1 К, то для одного моля газа R равна работе изобарного расширения одного моля газа при нагревании его на 1 К. При сообщении газу массой m количества теплоты
![]()
его внутренняя энергия возрастает на величину
![]()
3) Изотермический процесс (T = const).
Используем уравнение Менделеева-Клапейрона для работы газа:

При T = const dU = 0, следовательно
![]()
Следовательно, для того, чтобы при расширении газа температура не повышалась к газу в течение изотермического процесса необходимо подводить количество теплоты эквивалентно внешней работе расширения.
4) Адиабатический процесс.
Это процесс, при котором отсутствует теплообмен с окружающей средой, следовательно, dQ = 0. К адиабатическим процессам можно отнести все быстро протекающие процессы. Например, процесс распространения звука в среде. Скорость распространения звука настолько велика, что процесс обмена энергией между звуковой волной и средой произойти не успевает и т.д. и т.п.
Из I начала термодинамики получают, что dA = –dU, т.к. dQ = 0, т.е. внешняя работа совершается за счет изменения внутренней энергии системы. Для произвольной массы газа имеем:
![]()
Если продифференцировать уравнение Менделеева-Клапейрона, то получим
![]()
Исключив T, получим
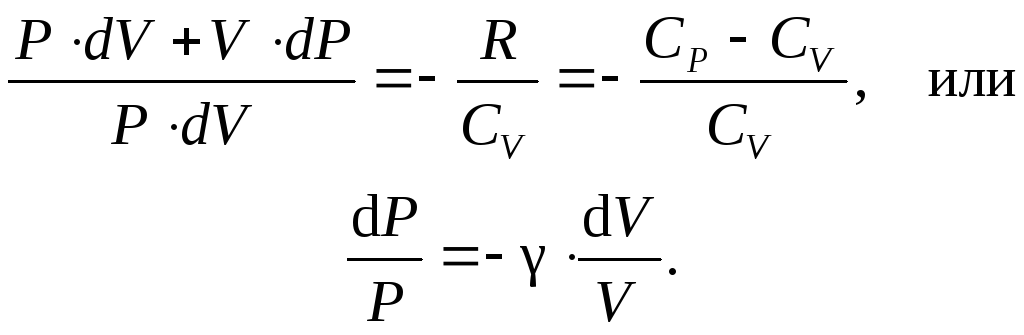
Интегрирую обе части от P1 до P2 и от V1 до V2, получим

Т.к. состояния 1 и 2 выбраны произвольно, то можно записать, что
PV = const.
Полученный результат есть уравнение адиабатического процесса, или уравнение Пуассона. Перейдя к переменным T и V или к переменным P и T, используя уравнение Менделеева-Клапейрона, получим
TV –1 = const; T P 1– = const.
Эти формулы тоже выражают уравнение Пуассона, только в других параметрах.
![]()
Для одноатомных газов i = 3, = 1,67; для двухатомных газов i = 5, = 1,4.
Значение , вычисленное по формуле, хорошо подтверждается экспериментом.
Диаграмма адиабатического процесса изображается гиперболой.
В ычислим
работу, совершаемую газом в адиабатическом
процессе. Если газ адиабатически
расширяется отV1
до
V2,
то его температура уменьшается от T1
до T2.
ычислим
работу, совершаемую газом в адиабатическом
процессе. Если газ адиабатически
расширяется отV1
до
V2,
то его температура уменьшается от T1
до T2.

Произведя некоторые преобразования, можно перейти к виду

Работа, совершаемая газом при адиабатическом расширении, меньше, чем при изотермическом. Это можно объяснить тем, что при адиабатическом расширении происходит охлаждение газа, тогда как при изотермическом – температура поддерживается постоянно за счет притока извне эквивалентного количества теплоты.
Рассмотренные процессы имеют общую особенность – они проходят при постоянной теплоемкости; в первых двух процессах они соответственно равны CV и CP. При изотермическом процессе dt = 0, теплоемкость равна . В адиабатическом процессе dQ = 0, следовательно, теплоемкость тоже равна нулю.
ОПРЕДЕЛЕНИЕ: Процесс, при котором теплоемкость остается постоянной, называется политропным.
Исходя из I начала термодинамики, при условии, что теплоемкость постоянна, выводится уравнение политропы:

Очевидно, что при C = 0 n = , получаем уравнение адиабаты. При C = n = 1, получаем уравнение изотермы. При C = CP n = 0, получаем уравнение изобары. При C = CV n = , получаем уравнение изохоры. Таким образом, все процессы являются частным образом от изотропного процесса.
