
Утворення галової кислоти з таніна
Танін
( танінова кислота) представляє собою
неоднорідну групу речовин в загальному,
вони представляють собою ефіри з
ароматичною кислотою. Інколи їх називають
депсидами. Багато із танінів містять
флороглюцинол замість глюкози і
протокатехінову кислоту замість галієвої
кислоти. Вони зустрічаються тільки в
рослинах, причому ними особливо багаті
так звані галлові горішки, які утворюються
на деяких деревах у відповідь на
пошкодження, викликані комахами. Цих
речовин особливо багато в листках
сумаха, в корі хемлока, дубі і в деревині
каштана. Ці останні служать джерелами
для промислового здобуття танінів , які
використовуються при виробленні шкір,
а також мають фармацевтичне застосування.
Подібно більшості танінів , галова
кистота ( триоксибензойна кислота),
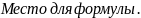 ,яка
володіє ефірною формою гідролізується
ензимом
таназою, згідно наступного рівняння:
,яка
володіє ефірною формою гідролізується
ензимом
таназою, згідно наступного рівняння:
Танін + n H2 → Галова кислота + Інші речовини.
Галотанін – звичайна речовина яка поступає в продаж. Розщеплення дигаллової кислоти під дією танази протікає наступним чином:
Таназа була виявлена Шееле в 1786р. в галах рослин, і вона була знайдена у грибів Роленом у 1860р. під іменем Aspergillus niger. Значення танази для мікробіолога заклечається в тому , що продукт дії танази на танін, а саме галова кислота , має промислове значення. Деякі гриби виявляються особливо продуктивними джерелами ензиму і використовуються в промислових «бродіннях» для отримання галової кислоти. Галова кислота використовується при виробництві красок галоцианіну і алізаринової коричневої. Вона використовується також при виготовленні чорнил, гексаоксиантрахінона та фармацевтичних препаратів для окраски шкіри.
Хоч і інші гриби, особливо из групи Penicillium glaucum, володіють особливістю утворювати таназу , все ж таки А.niger найбільш ефективний і всюди використовується як джерело танази. В даний час бродіння проводиться в очищених водних розчинах, які містять екстракти таніну із рослинного матеріалу. Бродіння ведеться в занурених умовах , тобто проводиться аерація і перемішування рідини після засіву її культурою певного штаму гриба. В минулі часи гідроліз проводився у вологих купках галлових горішків , із яких в подальшому віділялась галлові кислота.
При високому вмісті таніну в субстраті ( 10-відсотковий розчин) вивільняється галова кислота кристалізується із розчину. Ван-Тигам (1867) показав, що для росту гриба необхідно повітря. Якщо міцелій занурений нижче поверхні середовища, то глюкоза, утворена при гідролізі, спочатку накопичується, а потім зникає. Галова кислота також може споживатися під час бродіння. Кальметт в 1902р. запатентував занурений процес виробництва таніну, що було першим випадком використання техніки зануреного росту. Фернбах (1900) і Поттевен (1900), незалежно один від одного, відкрили ензиматичну природу цього процесу и приготували безкліткові препарати ензиму. Висушений міцелій і осаджений спиртом мацирирований міцелій дають дуже активні препарати танази. Поттевен (1900) ясно охарактеризував пристосовану природу цього ензиму: він не утворюється в звичайному вуглеводному синтетичному середовищі Ролена; утворення танази в культурах пліснявих грибів спостерігається лише в тому випадку, коли в середовищі міститься танін або продукт його розщеплення – галлові кислота. Це було підтверджено Кнудсоном (1913b; див. також Риппель і Кезелінг, 1931, і розділ про пектин). Таназа, утворена А. niger діє також на танати, тобто продукти осадження танінової кислоти такими речовинами, як желатину. Гидролизу піддаються також феніл- і менилсаліцилати, хоча це залежить від домішку естерази до препаратів танази (див. нижче).
Роботи Кнудсона (1913a і b) представляють собою найбільш обширне дослідження мікробіологічних процесів, зв’язаних з таніном і таназою. Серед 23 різноманітних видів грибів, поміщених в розчинах танінової кислоти в синтетичному середовищі, лише одна третя частина володіла здатністю до росту, так як для більшості видів танінова кислота виявилась ядовитою речовиною. Лише A. oryzae, A. fiavus, A. niger і Penicillium glaucum переживали в 10-відсоткових розчинах цієї кислоти. Тільки два останніх вида були дуже стійкими до високих концентрацій таніну, і тільки ці види мали здатність використовувати танін в якості єдиного джерела вуглецю. В загальному, можна сказати, що сапрофітні гриби більш стійкі до отравлення таніном, ніж паразити, так як більшість паразитичних грибів подавлюється таніном в концентрації 0,1 – 0,8% (Кук і Таубенхаус, 1911). Кнудсон, подібно тому як Ван-Тигам і Поттевен спостерігали за 40 років до нього, встановив, що галова кислота, утворена під час росту , A. niger на середовищі з таніном, в подальшому піддається розпаду, що співпадає з співпадає з використанням інших органічних речовин, утворених з таніну. Спостерігали, що один штам пеніцилів використовував галову кислоту скоріше, ніж вона утворилась, і тому ця речовина не накопичувалась в живильному середовищі. Додавання до середовища 10% цукру повністю захищало галову кислоту від розпаду і дозволяло їй накопичуватись в живильному середовищі, що зв’язано з кращим використанням енергії цукру пліснявим грибом ( див. розділ IV). Концентрація 5% цукру не чинила дії, так як він дуже швидко вживався. Виборчий характер цього процесу в розчинах таніну доводиться тим, що в чистому розчині галової кислоти і глюкози лише остання використовується грибом. Процес використання галової кислоти був виявлений Нікольсоном з співавторами (1931). Вони показали, що, A. niger утворює не тільки таназу, але також і специфічний ензим, руйнуючий галову кислоту, який був названий пірогалазою і отриманий в безклітковій формі. Існування цього ензиму пояснює, чому в дійсності не спостерігається теоретичних виходів галової кислоти з таніну. Згаданий ензим утворюється також на середовищі, яке містить пірогалол або галову кислоту в якості єдиних джерел вуглецю. Продуктів розмноження не вдалось виділити, проте про глибоке змінення , протікаючим під дією ензиму, можна судити на основі того, що продукти реакції втрачають здатність давати забарвлені сполуки з залізом.
Надлишкова аерація сприяє росту гриба, однак вона несприятлива для накопичення галової кислоти, так як остання використовується при цьому в якості енергетичного і пластичного матеріалу. Максимальні виходи галової кислоти були отримані в умовах органічного анаеробіозу, як це спостерігав ще Ван-Тигам. В цих умовах організм гідролізує танін, однак він не розпоряджує достатньою кількістю кисню для подальшого окислення цієї речовини. При цьому 1мг міцелію (по сухій масі) може провести перетворення 2,7 г таніну в перебігу 10 днів. Шестикратне пасирування , A. niger на середовищі з гало таніном значно підвищує здатність гриба до утворення танази; в одному випадку активність при цьому збільшилась майже вдвічі( Нікольсон з авторами,1931).
У всіх дослідах Кнудсона був вивчений поверхневий ріст гриба, і в цих умовах промисловий метод отримання галової кислоти зв’язаний двома вимогами: 1)ріст в розчинах таніну в аеробних умовах в присутності 10% цукру; 2)ріст в розчинах таніну, представленим єдиним джерелом вуглецю, в умовах органічного доступу кисню. Таніаза виділяється в навколишнє середовище при вмісту в останній таніну або галової кислот. Кнудсон (1913b) показав, що утворення ензиму пропорційно концентрації таніна в 10-відсотковому розчині цукру, однак при меншому вмісті цукру утворення танази значно знижується.
Препарати танази и характеристика її дії
Препарати танази були вивчені різними авторами. Звичайним вихідним матеріалом служив , A. niger , однак використовували також і A. luchuensis. Активність ензиму вимірювалась шляхом титрування їдким натрієм карбоксильних груп, звільнених в процесі гідролізі метилового ефіру голової кислоти (Фройнденберг і Фольбрехт, 1921). За використанням таніну можна слідкувати також шляхом осадження казеїном не перетвореного вихідного матеріалу (галотаніну) і зваженням утвореного осаду ( Нікольсон з авторами,1931). Перетворення таніну можна вимірювати також з допомогою поляриметрії, так як танін володіє позитивним обертом, а продукти його розпаду позбавлені оптичного оберту ( Фернбах, 1900; Поттевен, 1900).
Детальніше дослідження властивостей танази, утворене грибами провели Дікергоф і Армбрустер (1933). Вони провели екстракцію міцелія A. niger за участю розведеної соляної кислоти для руйнування оксидаз, щоб звільнити від них препарати танази. Неочищені препарати танази діють на різноматінті таніно подібні речовини і ефіри. Неправдива специфічність танази вільної від постійно зв’язаних з нею естераз було встановлено шляхом вибіркового руйнування послідовним нагріванням протягом 10 хвилин при 40 ͦС і рН 8,9. Необхідно згадати що естерази також руйнують деякі ефірі таніна; відповідними цією властивістю два ензима: тазана і естераза. Розділення цих ензимів модна досягнути за допомогою хроматографії ( Тот і Барсоні, 1943). Естераза отримується на колонці з оксиду алюмінія тоді як таназа проходить через колонку. Згадані автори виявили що глюконатін також розкладається двома різними ензимами, β-глюкооксидазою і таназою. Наявність в екстрактах із A. niger різних ензимів які діють на той же субстрат виходить із того, що гідролізуюча дія екстракта на метилгалат танінову кислоту і m-дигалову кислоту різко змінюється після адсорбції на оксиди алюмінію.
Препарати танази, звільні від оксидаз і естираз, як вказано вище, діють лише на з’єднання таніну, яке містить дві фенольні гідроксильні групи в кислій суміші. Естерифікований карбоксил повинен знаходитися в окисленому бензойному кільці і не повинен бути в сигма-положенні по відношенню до однієї із гідроксильних груп. У зв’язку з тим таназа діє на танінову, хебулінову, m-дигалову кислоти, на метилгалат і метилпротокатехінову кислоту. При наявності хоча б однієї гідроксильної групи в цій речовині вона не піддається дії танази.
Як вже згадувалось, естераза грибів також може діяти на ці речовини з різною інтенсивністю. Очевидно, що екстракт міцелію або препарат із культуральної рідини, діє на танін і називається таназою, в дійсності містить суміш ензимів, здатних до руйнування таніно подібних речовин, з я ких тільки один ензим являє собою копію таназу. Другі ензими складають домішки і представлені естиразами,глюкозид азами та ін. Дійсно, Тот(1944) показав, що глюкогалін і м-дигалова кислота руйнуються екстрактами із A. niger , які містять два різних ензима; перший із них він назвав естеразою галової кислоти, а другий – депсидазою.
Теотанін в екстрактах з чаю розщеплюється таназою A. niger ( Дейс і Дікман, 1937).
Окиснення ненасичених жирних кислот з довгим ланцюгом атомів
Використання і перетворення грибами низьких членів ряду жирних кислот, а також мурашиної і оцтової, було детально розглянуто в других частинах цієї книги.
Пропіонова кислота
Це жирна кислота досить токсична для грибів,і її солі використовуються в якості промислових препаратів для інгібування рості плісняви; вони знаходять особливе застосування для попередження розвитку плісняви на хлібі ( «мікобан»). Звичайно додають 1,2-2,0 г цього препарату на 1 кг муки. Тим не менше було виявлено, що A. niger володіє здатністю переорювати пропіоновокислий кальцій, утворюючи при цьому молочну і піровиноградну кислоти ( Уокер і Коппок, 1928). Оскільки молочна кислота накопичується швидше і в більшій кількості, то окиснення пропіонової кислоти було представлено в наступному вигляді: жирна кислота → α-оксикислота (молочна) → α-кетокислота ( піровиноградна).
Вищі жирні кислоти
Більшість з наших відомостей по цьому питанні зв’язані з вивченням псування рослинних масел: пальмового і кокосового. Руйнування цих масел пов’язано з окисленим розпадом, викликаним цільовими грибами. Жирні кислоти спочатку звільняються під дією лі політичних ферментів, а потім руйнуються грибами. Це призводить до утворення ряду метил кетонів, які містять на один вуглецевий атом менше ніж вихідна жирна кислота. Звичайно утворюються метил-, аміл-, метилгептил- і метилнонілкетони. Метиламілкетон викликає характерний запах зруйнованого масла, який частково нагадує запах духів. Грибами які руйнують маслинні масла, утворюються також вторинні спирти, які відповідають кетонам, ефіри вторинних спиртів і жирних кислот, а також вільні жирні кислоти.
Відкриття ролі грибів в процесах руйнування рослинних масел належить Штєркле (1924). Із зруйнованого мала було виділено Penicillium glaucum. Було показано також, що A. niger і A. fumigatus утворюють метил кетони при рості в чистих культурах на відділених жирних кислотах, які є джерелом вуглецю.
Згідно Штєркле (1924), псування масла залежить не від утворення ефірів масляної кислоти, як раніше думали, а від утворення метипропілкетона і метинонілкетона із капронової і лауринової кислот, присутніх в маслі. Таким чином характерний запах деяких сирів (Рокфор та ін..), дозрівання яких пов’язано з дією плісняви ( переважно пенецілів, але крім них, і Cladosporium та ін..), відносять летючим кетонам, утвореним з вихідного жиру. Метиамілкетон і метингаптилкетон були виділені Штєркле (1924) із сиру «рокфор».
Перетворення відділених жирних кислот в відповідні метил кетони чистими культурами Penicillium glaucum були підтверджені і розширені другими дослідженнями ( Аклін, 1929; Стоко, 1928; Талер і Гейст,1939а; Коппок з співавторами, 1928). Дані таблиці 69 пояснюють перетворення жирних кислот у відповідні кетони, які спостерігалися різними авторами.
В деяких випадках відповідні кетони були виділенні із чистих тригліцеридів. Із трикапроїна був виділений метилпропілкетон з виходом до 48% від теоретичного ( Аклін, 1929). При роботі з вільними жирними кислотами був отриманий менший вихід, які були зворотно пропорційні використаним концентраціям кислоти:
Капронова кислота,% Вихід метилпропілкетона, %
0,25 10
0,5 7
1,0 3
Утворення кетонів
Ряд дослідників, названих вище, а також Бреуш (1948) вважають безпосереднім попередником кетона відповідну β-кетокислоту, яка при декарбоксилюванні дає кетон:
R · CO · CH2 · COOH → RCOCH3
Це декарбоксилювання було точно доведено у випадках утворення ацетону із ацетооцтової кислоти, а також в ряді других процесів, які протікають в клітинах тварин і бактерій. Аналогічно можна завершити що така ж реакція здійснюється і у грибів, хоча декарбоксилювання β-кетокислот у грибів ніколи не було точно вивчено. Все ж таки непотрібно сумніватись в тому, що цей процес протікає по вказаній вище схемі.
Досить цікаво, що метилкетони не являються незміненими продуктами розпаду насичених жирних кислот, під дією грибів. Ці кислоти легко використовуються багать грибами, які не утворюють і слідів кетонів. Далі,при утворенні кетонами його вихід не буває великим, що вказує на наявність, деяких шляхів розпаду жирних кислот. Сучасні уявлення про перетворення жирних кислот приписують важливі значення теорії β- окислення Кноопа ( новий розгляд див. у Бреуша, 1948). Ця теорія може бути представлена у наступному вигляді:
R · CH2· CH2 · COOH → RCOCH2COOH → RCOOH + 2CO2
Жирна кислота β-кетокислота Жирна кислота без двох атомів
кисню
Таким шляхм жирна кислота скорочується в результаті окиснення двох кінцевих атомів кисню. Це скорочення жирної кислоти піддається подальшому окисленні ( і, відповідно, скороченню) тим самим шляхом що досі, поки не залишиться ланцюг із чотирьох або двох кисневих атомів, тобто оцтова кислота або ацетооцтова кислота. Остання пізніше піддається перетворенню в циклі лимонної кислоти як описано в попередніх розділах. Іноді послідовне відщеплення двох атомів кисню являє собою утворення ацетату, який перетворюється у карбонову кислоту і воду в циклі лимонної кислоти. Дійсно, фрагмент С2, явно, ніколи не відділяється у вільному вигляді, а водночас входить в дихальний цикл С6- три карбоновою ( лимонною)кислоти шляхом зв’язаного окиснення в β-кетокислоти і щавлевооцтової кислоти. Це може бути представлено в наступному вигляді ( Бреуш, 1948):
β-Кетокислота, зображена вище звичайно являється кінцевим продуктом β-окислення, тобто ацетооцтовою кислотою, хоча в реакціях, які призводять до утворення ацетоацитата, приймають участь вищі аналоги.
Таким чином, при окисненні жирних кислот два різних процеси конкурують за володіння β-кетокислотами: декарбоксилювання з утворенням кетона і β-окиснення до карбонової кислоти і води. Пояснення утворення кетонів яке надав Стоко(1928), досить правдоподібне. Він вважав окиснення по Кноопу нормальним процесом який спостерігався в звичайних умовах. Однак у грибів, які утворюють кетони (наприклад, у Penicillium glaucum), жирні кислоти з довгим ланцюгом вуглеводне водневих атомів володіють настільки сильною ядовитою дією, що пригнічує дихання і окиснюючя процеси організму. В результаті цього наступає ненормальний розподіл β-кислот, тобто декарбоксилювання її в кетон. Стоко показав, що жирні кислоти токсичні для Penicillium glaucum. Їх токсичність збільшується із збільшенням довжини ланцюга вуглеводневих атомів до максимуму у каприлової кислоти, а потім знижуються, у зв’язку з нерозчинністю.
Вторинні спирти ( карбіноли), які звичайно супроводжують кетони можна розглядати як продукти відновлення кетонів, хоча Стоко пропонує, що вони в дійсності являються попередниками кетонів. Ця думка основана на пропозиції, що декарбоксилювання як β-кетокислоти, так і β-оксикислоти може приводити до утворення кетону відповідно наступній схемі:
Однак, ця теорія не зустрічає підтримки. Оскільки утворення вторинних спиртів шляхом відновлення проміжних кетонів широко розповсюджених в біологічних системах, можна вважати кетон вірогідною проміжною речовиною при утворені карбінола, а не навпаки. Так, наприклад, при маслянокислому бродінні бактерій ізопропан утворюється в результаті відновлення ацетону:
CH3COCH3→ CH3CHOHCH3
Вихідним способом, при додаванні кетонів в культуру дріжджів які бродять приводить до відновлення кетонів з утворенням вторинних спиртів. Далі, звичайний продукт бактерійного бродіння 2,3: бутеленгліколь виникає в результаті відновлення відповідного кетона – ацетилметилкарбінола ( ацетонїна).
CH3CHOH · CO · CH3 → CH3CHOH · CHOH · CH3
Ацетон 2,3-бутеленгліколь
Утворення карбінола грибами очевидно, протікає по наступній схемі:
R · CO · CH3 → R · CHOH · CH3
Метилкетон вторинний спирт(карбінол)
