
- •Глава 18. Электрохимические элементы
- •18.1. Электрохимические элементы. Электродвижущая сила
- •18.2. Термодинамика электрохимических элементов
- •18.3. Эдс как сумма скачков потенциалов
- •18.4. Двойной электрический слой
- •18.4.1. Электрокапиллярные явления
- •18.5. Электродные потенциалы
- •18.6.Типы электродов
- •18.6.1. Электроды первого рода
- •18.6.2. Электроды второго рода
- •18.6.3. Окислительно-восстановительные электроды
- •18.6.4. Мембранные электроды
- •Стеклянные электроды.
- •Другие ионоселективные электроды.
- •18.7. Типы электрохимических цепей
- •18.7.1.Химические цепи без переноса.
- •18.7.2. Концентрационные цепи без переноса
- •18.7.3. Химические цепи с переносом
- •18.7.4. Концентрационные цепи с переносом
- •18.7.5. Диффузионные потенциалы
- •18.8. Потенциометрия
- •18.8.1. Определение коэффициентов активности электролитов
- •18.8.2. Определение константы диссоциации слабой кислоты
- •18.8.3. Определение рН растворов
- •18.8.4. Определение произведения растворимости
- •18.8.5. Потенциометрическое титрование
18.6.4. Мембранные электроды
Ионоселективные мембранные электроды отличаются от ранее рассмотренных тем, что у них обе граничащие фазы – мембрана и раствор – имеют ионную проводимость и поэтому на их границе не протекает собственно электрохимическая реакция с переносом электронов. Процесс сводится в этом случае к обмену ионами между мембраной и раствором. Межфазную границу пересекают лишь ионы, заряд которых при этом не изменяется, хотя он и может быть перераспределен между ионом и его новым окружением. При соответствующем подборе состава и структуры мембраны потенциал на межфазной границе будет зависеть только от какого-либо одного вида ионов. Таким электродам свойственна селективность, и это дает возможность измерять активность отдельного вида ионов, естественно, с ограничениями, обусловленными термодинамической невозможностью определения активности ионов одного сорта.
Мембраны ионоселективных электродов могут быть твердыми и жидкими. Твердыми мембранами являются стеклянные, кристаллические и гетерогенные. К жидким относятся несмешивающиеся с водою органические растворители с низкой диэлектрической проницаемостью (хлорбензол, толуол и др.), в которых растворены соответствующие ионогены – диэфиры фосфорной кислоты, алифатические кислоты, амины и др. В качестве растворенных веществ могут быть также органические соединения с относительно крупными молекулами (например, краун-эфиры), которые связывают ионы и переносят их из водной среды в органическую.
Стеклянные электроды.
Рис.18.8. Стеклянный
электрод
В стекле определенной подвижностью
обладают лишь низкозарядные небольшие
катионы, прежде всего ионы щелочных
металлов, а силикатные, алюмосиликатные
или другие оксиды образуют практически
неподвижную сетку. Когда создается
контакт между стеклянной мембраной и
раствором, начинается обмен ионами
между граничащими фазами, например,
между ионами щелочного металла в стекле
![]() и ионами водорода в растворе:
и ионами водорода в растворе:
![]() L
L
![]() ,
(18.57)
,
(18.57)
где верхняя черта обозначает ион в стекле.
Псевдоравновесное состояние, которое достигается в ходе обмена, характеризуется константой обмена
![]() . (18.58)
. (18.58)
Условием межфазного равновесия заряженных частиц является равенство их электрохимических потенциалов в этих фазах, т.е. в случае ионов водорода
![]() , (18.59)
, (18.59)
где индексы m и L обозначают мембрану и раствор. Значение электрохимического потенциала определяется величиной химического потенциала иона i и внутренним потенциалом фазы i, в которой находится ион, т.е.
![]() , (18.60)
, (18.60)
![]() . (18.61)
. (18.61)
Отсюда следует, что скачок потенциала между мембраной и раствором m,L определяется уравнением
![]() . (18.62)
. (18.62)
Можно предположить, что в стекле данного сорта сумма активностей ионов металла и водорода постоянна и равна активности ионов металла в исходном стекле:
![]() . (18.63)
. (18.63)
Тогда из уравнения (18.58) следует, что
![]() . (18.64)
. (18.64)
Подстановка этого значения в уравнение (18.62) приводит к выражению для скачка потенциала на границе мембрана – раствор:
![]() , (18.65)
, (18.65)
в котором стандартные химические
потенциалы и постоянная а включены
в
![]() .
.
Потенциал стеклянного, как и любого другого ионоселективного электрода, нельзя измерить, просто соединив его с электродом сравнения, поскольку ионоселективным электродам не свойственна электронная проводимость. Однако можно измерить разность потенциалов между двумя сторонами мембраны, включив ее в электрохимическую систему с двумя одинаковыми электродами и приняв меры для устранения диффузионного потенциала:
Ag | AgCl | p-p Cl– | Мембрана | исслед. р-р | КСl (нас. р-р) | р-р Сl– | AgCl | Ag
Поскольку в такой электрохимической цепи слева и справа находятся одинаковые хлорсеребряные электроды, разность потенциалов которых практически равна нулю, то определяемая ЭДС такой цепи
![]() . (18.66)
. (18.66)
Правая сторона мембраны контактирует
с исследуемым раствором и ее потенциал
![]() определяется уравнением (18.30). Потенциал
определяется уравнением (18.30). Потенциал
![]() левой стороны мембраны, которая
контактирует с раствором внутреннего
электрода сравнения определяется
аналогичным уравнением, но с другими
активностями ионов Н+ и М+,
т.е.
левой стороны мембраны, которая
контактирует с раствором внутреннего
электрода сравнения определяется
аналогичным уравнением, но с другими
активностями ионов Н+ и М+,
т.е.
![]() . (18.67)
. (18.67)
Подстановка значений потенциалов правого и левого электродов в уравнение (18.31) дает
 . (18.68)
. (18.68)
Так как состав раствора слева от мембраны
остается неизменным, то потенциал также
является постоянным, а диффузионный
потенциал D
небольшой и также постоянный, их можно
объединить в константу. В нее также
можно включить небольшую разность
![]() справа и слева. Эта разность возникает
из-за некоторых различий в физических
и химических свойствах двух сторон
мембраны и называется потенциалом
асимметрии. Тогда потенциал стеклянного
электрода выражается уравнением:
справа и слева. Эта разность возникает
из-за некоторых различий в физических
и химических свойствах двух сторон
мембраны и называется потенциалом
асимметрии. Тогда потенциал стеклянного
электрода выражается уравнением:
![]() . (18.69)
. (18.69)
В зависимости от величины константы
обмена K электрод
будет селективным по отношению к ионам
водорода при очень малых значениях К,
когда
![]() ,
или к ионам металла при больших K,
когда
,
или к ионам металла при больших K,
когда
![]() .
.
Стеклянные электроды, предназначенные для определения рН, имеют константу обмена порядка 10–10 – 10–12, поэтому в кислых, нейтральных и даже слабощелочных средах и уравнение для потенциала электрода имеет вид
![]() . (18.70)
. (18.70)
При
![]() ,
т.е. в щелочной области, уравнение (18.69)
преобразуется к виду:
,
т.е. в щелочной области, уравнение (18.69)
преобразуется к виду:
![]() , (18.71)
, (18.71)
где
![]() . (18.72)
. (18.72)
Из уравнения (18.71) следует, что в щелочных
растворах потенциал стеклянного
электрода зависит от активности катионов
щелочи и его можно использовать для
определения активности ионов
соответствующего щелочного металла.
Если в растворе находится только щелочь,
то
![]() ,
а поскольку
,
а поскольку
![]() ,
то для щелочной области растворов можно
записать
,
то для щелочной области растворов можно
записать
![]() , (18.73)
, (18.73)
откуда видно, что в кислых и щелочных растворах потенциал стеклянного электрода является функцией активности ионов водорода. Каждой области рН соответствует свое значение стандартного потенциала стеклянного электрода, а наклоны прямых – рН в кислой и щелочной областях одинаковы по абсолютной величине и обратны по знаку (рис. 18.8). Подбором соответствующего сорта стекла можно изменить константу обмена и добиться того, что стеклянный электрод будет иметь металлическую функцию в кислых и нейтральных растворах.
Рис. 18.8. Зависимость
потенциала стеклянного электрода от
рН раствора
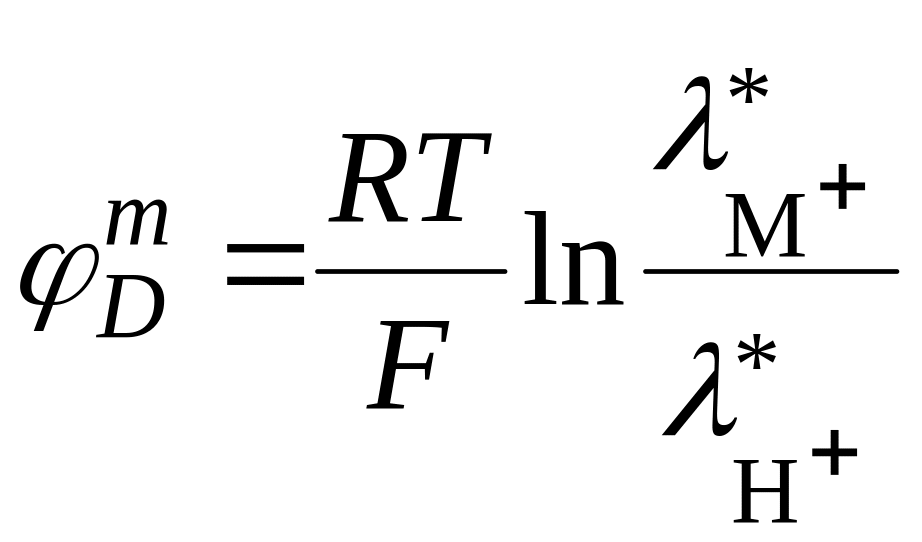 , (18.74)
, (18.74)
где
![]() – эквивалентная электрическая
проводимость соответствующих ионов.
– эквивалентная электрическая
проводимость соответствующих ионов.
Диффузионный потенциал включается в выражение для потенциала стеклянного электрода:
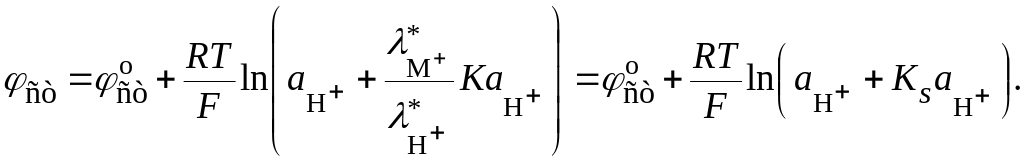 (18.75)
(18.75)
Из последнего уравнения видно, что селективность электрода зависит не только от константы обмена, но и от соотношения подвижностей обменивающихся ионов, т.е. константы селективности
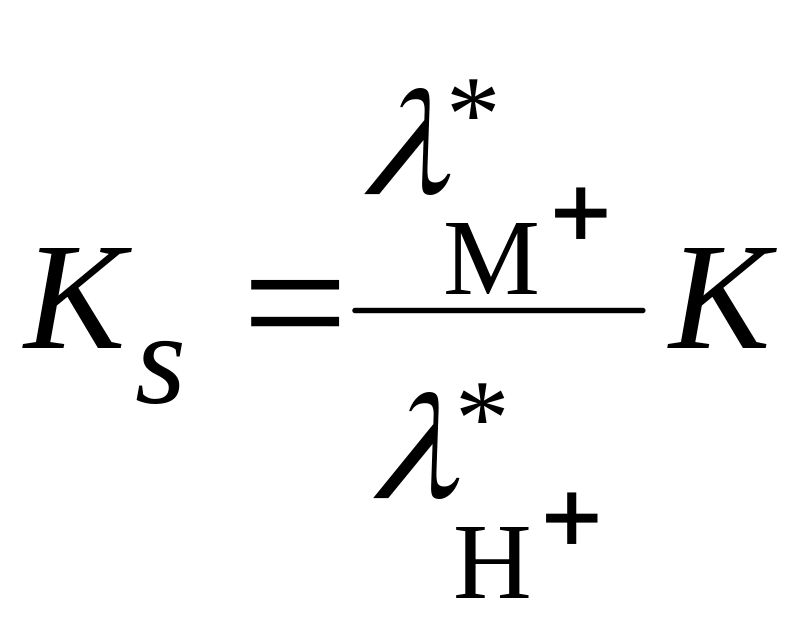 . (18.76)
. (18.76)
Прочность связи иона с его окружением
в мембране оказывает противоположное
влияние на константу обмена и величину
подвижности. Если из двух ионов
![]() и
и
![]() ,
которые участвуют в обмене, первый
связан прочнее, чем второй, то константа
обмена
–
будет больше единицы, но подвижность
меньше, чем
.
Например, константа обмена иона Na+
на ион К+ для типичного К+-селективного
стекла равна примерно 100, а фактический
коэффициент селективности не превышает
10, т.е. подвижность ионов К+ в
мембране примерно в 10 раз меньше
подвижности Na+.
,
которые участвуют в обмене, первый
связан прочнее, чем второй, то константа
обмена
–
будет больше единицы, но подвижность
меньше, чем
.
Например, константа обмена иона Na+
на ион К+ для типичного К+-селективного
стекла равна примерно 100, а фактический
коэффициент селективности не превышает
10, т.е. подвижность ионов К+ в
мембране примерно в 10 раз меньше
подвижности Na+.
